随着对一代和二代EGFR TKI耐药机制的探索,三代EGFR TKI 奥希替尼应运而生。目前,奥希替尼已经成为一代或二代EGFR TKI耐药后T790M突变阳性晚期NSCLC的标准治疗。FLAURA研究的成功,推进了奥希替尼向EGFR m+ NSCLC一线治疗进军。因此,在EGFR突变型晚期NSCLC患者中,奥希替尼已经成为重要的治疗选择之一。然而,接受奥希替尼治疗的患者也会产生耐药,目前奥希替尼在临床的广泛应用,明确耐药机制,并探寻耐药后潜在的治疗方案成为重要的研究课题。在今年ASCO会议上,有多项关于奥希替尼耐药机制的研究报道。
Abs 9068 采用NGS检测AZD9291耐药后的分子突变谱,揭秘耐药机制的异质性
背景:
AZD9291是第三代的EGFR TKI,对既往接受过一代或二代EGFR TKI治疗进展的EGFR T790M突变型NSCLC患者具有抗肿瘤活性。然而,AZD9291也会不可避免的出现获得性耐药。本研究回顾性分析了,晚期NSCLC患者对AZD9291的获得性耐药机制。
方法:
2017年1月~2017年10月,研究共入组了293例AZD9291耐药的晚期肺腺癌患者。组织活检标本是基因分析的优选,在无法取得组织的情况下,可以采用ctDNA作为代替标本。所有样本均采用基于NGS的ER-Seq方法检测,这一检测平台覆盖至少59个基因(59~1021),能同时检测单核苷酸变异(SNV)、基因插入/缺失、重排和体细胞拷贝数变异。
结果:
根据患者耐药的分子突变谱,可分为 3个分子亚型:1. 原始EGFR敏感突变和T790M突变均消失(66例,22.5%);2.尽管仍可检测到潜在的EGFR敏感突变,但T790M突变消失(130例,44.4%);3. EGFR敏感突变和T790M突变均存在(97例,33.1%)。3个亚型患者中,分别有11例(16.7%,11/66)、56例(43.1%,56/130)和62例(63.9%,62/97)患者可检测到已知的耐药机制,总结见下图1。
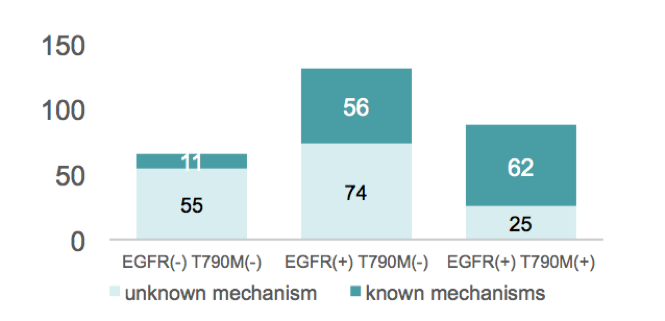
图1. 在3个亚型患者中检测到已知耐药突变的患者比例
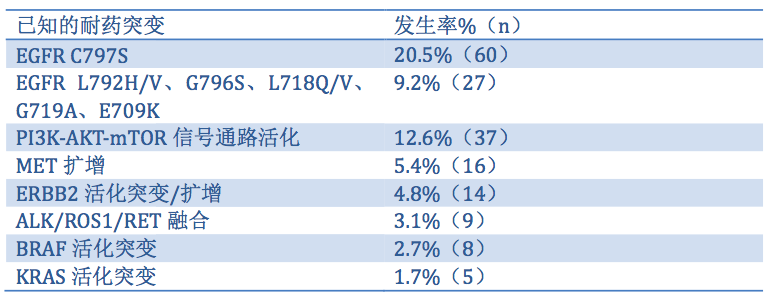
AZD9291最常见的已知的耐药机制及其发生率总结见表1. 此外,24例患者中检测到Rb1失活突变,31例(10.6%)患者中检测到共存耐药机制。
表1. AZD9291最常见的已知的耐药机制及其发生率
AZD9291治疗后,同一患者自身和不同患者之间的耐药机制,均存在较大的异质性,采用NGS检测进行综合分析,有助于进一步探索潜在的耐药机制。
Abs 9077 在大样本量的中国NSCLC患者中探索奥希替尼的耐药机制:来自AURA17研究的报道
背景:
奥希替尼目前已经获批用于EGFR TKI治疗后T790M突变的患者,尽管治疗疗效显著,但患者最终会发生耐药。奥希替尼的耐药机制,是目前研究的热点,且相关研究报道也在不断增多,但奥希替尼在大样本的中国患者中的耐药机制尚未报道。ARUA17研究是一项开放的II期单臂研究,旨在评估奥希替尼在东亚局部晚期或转移性,EGFR TKI治疗进展的T790M突变的NSCLC患者中的疗效和安全性。本研究对来自AURA17研究中的76例中国患者的血浆样本进行了检测,初步探索了奥希替尼的耐药机制。
本研究旨在探寻奥希替尼治疗后中国NSCLC患者的耐药机制,并分析了cfDNA的标志物与患者临床结局的关系。研究入组流程图见下图1。
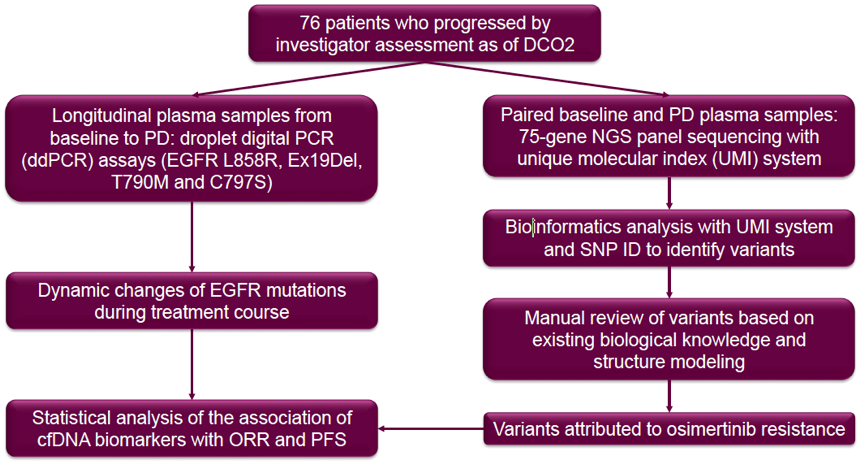
图1. 研究入组流程图
研究共纳入76例患者,自基线开始连续采集患者的血浆标本直PD,采用ddPCR检测EGFR L858R,ex19del,T790M和C797S突变,并动态监测治疗过程中EGFR突变的变化,分析这些突变的动态变化与患者的ORR和PFS的关系。同时采用75个基因的NGS panel,对基线和PD时的对配血浆标本进行测序,并采用独特分子指数系统(unique molecular index)对测序数据进行分析,基于目前已知的生物学知识和结构模型,筛选这些基因变异,并寻找介导奥希替尼耐药的基因变异,分析这些基因变异与患者的ORR和PFS的关系。
76例患者中,有61例患者PD时的cfDNA样本检测到EGFR敏感突变,对这部分患者进行耐药机制分析,排除ctDNA含量较低的患者。奥希替尼耐药患者的基因突变谱见下图2。
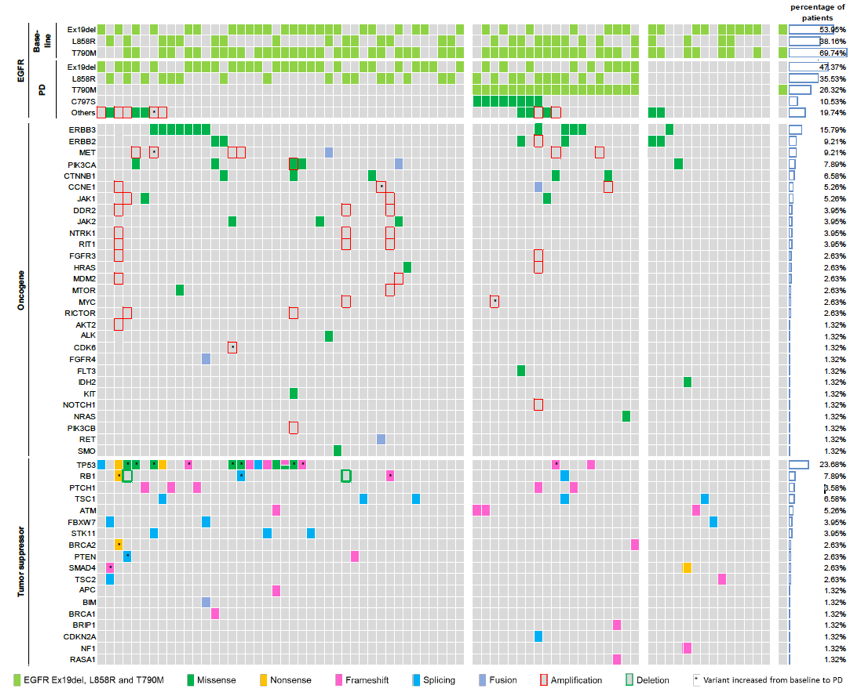
图2. 奥希替尼耐药后患者的基因突变谱
8例患者检测到EGFR C797S,L858R突变和ex19del,EGFR C797S发生率无显著差异,分别为5例和3例。NGS确认了ddPCR检测到的5例C797S突变的患者,同时发现了另外3例患者(突变碱基频率<1%),所有的EGFR C797S突变与T790M突变均为顺式分布。
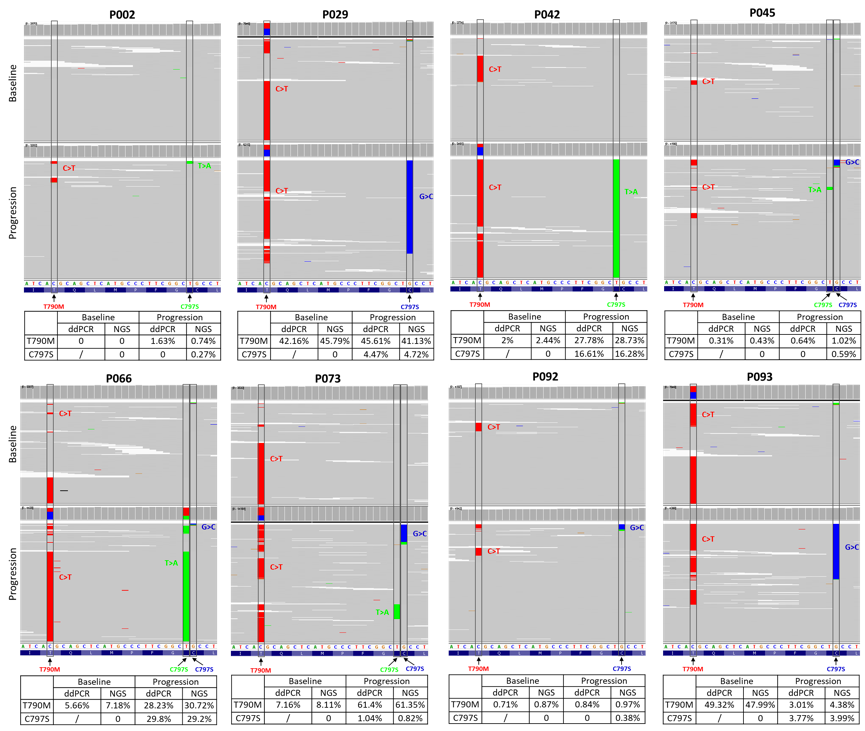
图3. C797S和T790M突变共存
在PD时,C797S突变是EGFR基因介导的耐药突变的最常见形式,此外,还检测到EGFR扩增,L718Q、I744T、C775Y、G796S/D和T854I突变,见下图4。
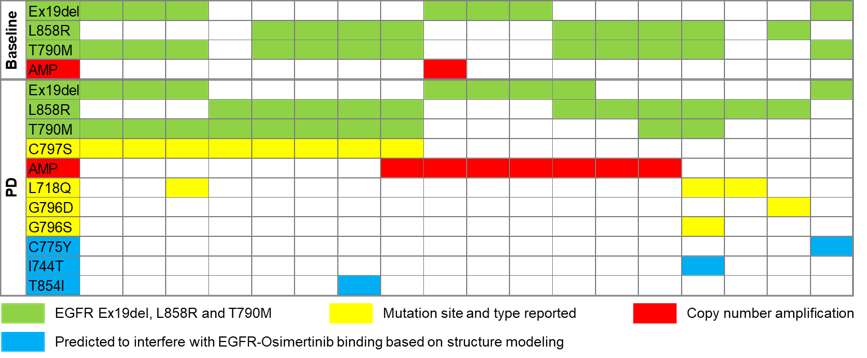
图4. EGFR基因变异介导的奥希替尼耐药机制
35例患者检测到旁路激活,包括ERBB2/3、FGFR3、HRAS、JAK1/2、MET、MTOR、NTRK1、PIK3CA等,见下图5。
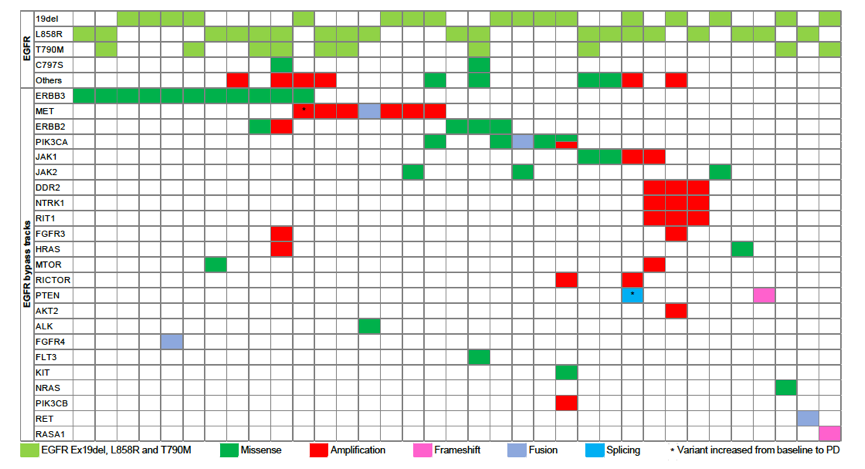
图5. 旁路活化介导的奥希替尼耐药
在奥希替尼耐药的血浆标本中,可以检测到敏感突变,T790M突变和C797S突变的浓度同步升高,且在RECIST标准评价为PD之前的2.8个月(中位数,范围:1.4-8.4)便可在血浆标本中检测到C797S突变。
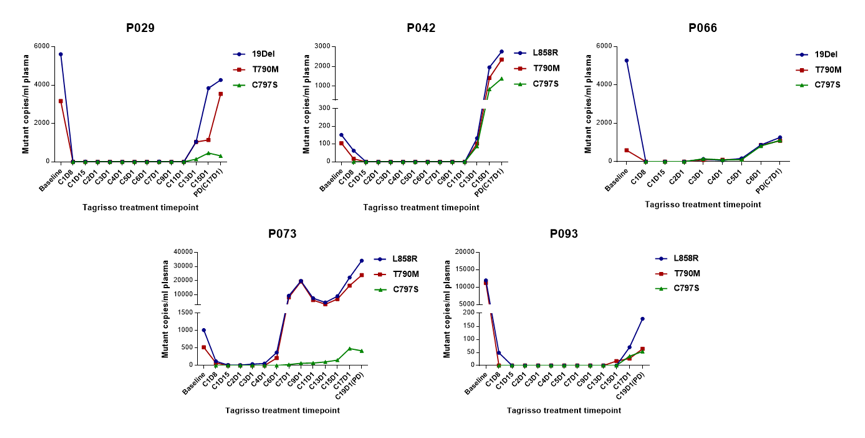
图6. 在PD前提前检测到C797S突变
分析血浆检测的标志物与患者ORR和PFS的关系,结果显示治疗第3周或6周时,血浆EGFR敏感突变的清除率与较好的ORR相关(第3周:69.7% vs 33.3%;第6周:74.3% vs 33.3%),见下图7。
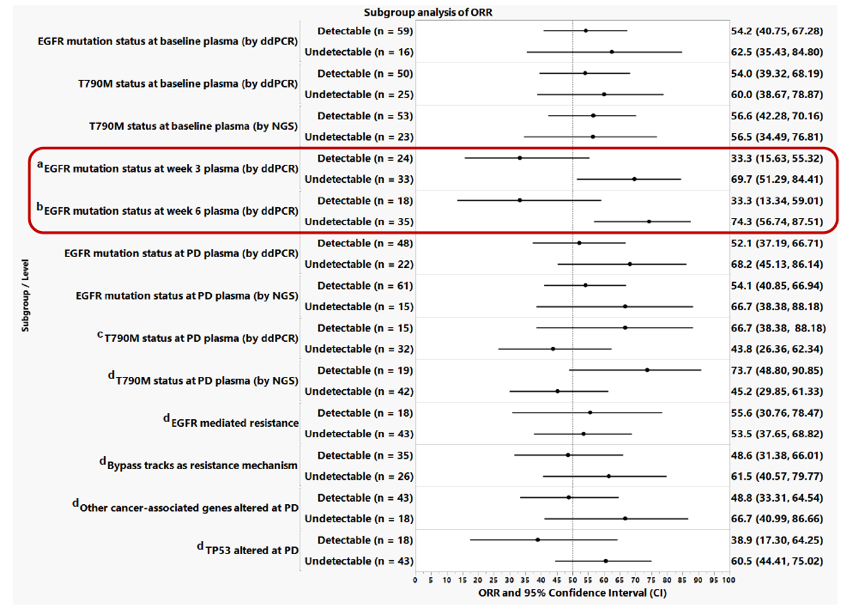
图7. ORR亚组分析
此外,治疗后第3周或6周时,血浆EGFR敏感突变的清除率,与更好的PFS相关(第3周:6.9 vs 4.0个月;第6周:7.1 vs 4.1个月),见下图8。
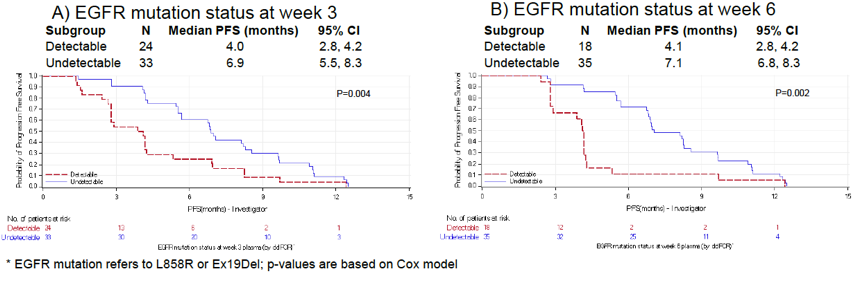
图8. 第3周或6周时血浆EGFR突变的清除率与PFS的相关性
研究者同时评估了PD时T790M突变的清除率与PFS的相关性,结果发现PD时T790M突变存在与较长的PFS相关(8.2 vs 4.2个月),见下图9。
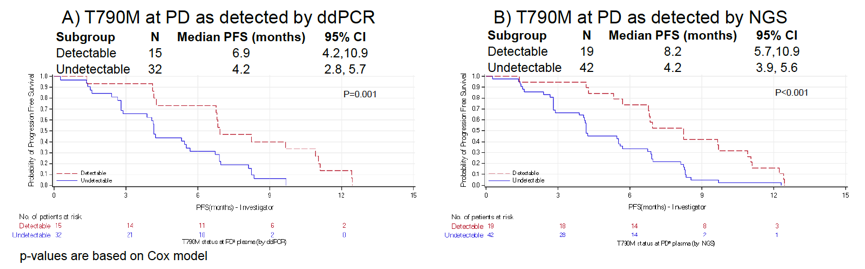
图9. PD时T790M突变的清除率与PFS的相关性
结论:
本研究揭示,在中国NSCLC患者中,存在多种奥希替尼的耐药机制。由于本研究队列中的患者相比AURA17研究中总体人群的PFS更短,分别为6.2 vs 9.7个月,目前正在分析AURA17研究中随访时间更长患者的血浆标本,或许可以帮助更全面的了解奥希替尼的耐药机制。
Abs 9087 探索EGFR突变的NSCLC患者奥希替尼耐药的EGFR依赖性和非依赖性机制
背景:
奥希替尼为第三代EGFR TKI,可以有效抑制EGFR敏感突变和T790M突变。在一项随机III期研究者,奥希替尼对比含铂双药化疗用于EGFR TKI耐药后T790M突变的患者,可以显著延长PFS,提高ORR。此外在FLAURA研究中,奥希替尼对比吉非替尼或厄洛替尼用于EGFR突变型晚期NSCLC一线治疗,可以显著延长PFS。尽管奥希替尼在晚期NSCLC患者的治疗中地位日渐重要,但关于奥希替尼的耐药机制,目前仍未完全阐明。既往个案报道或小样本量的研究显示EGFR exon20的三次突变如C797S突变,MET扩增,HER2扩增,小细胞转化,间质上皮转化(EMT)是介导奥希替尼耐药的可能机制。近期,一些研究报道显示部分患者在进展时T790M突变消失,为了制定有效的克服奥希替尼耐药的治疗方案,有必要全面了解奥希替尼的耐药机制。
方法:
研究筛查了MD Anderson癌症中心(MDACC)肺癌登月项目 GEMINI数据库(一个前瞻性的入组晚期NSCLC的数据库),纳入2014年1月至2017年10月接受奥希替尼治疗的患者。研究同时查询了Moffitt癌症中心(MCC)的电子病例库和临床基因实践委员会数据库,纳入2011年1月至2017年10月接受奥希替尼治疗的T790M突变的NSCLC患者。收集患者的一般临床特征,既往治疗资料,生存状态,数据截止日期分别为2018年2月(MDACC)和2018年1月(MCC)。
结果:
共118例患者满足入组标准,患者的中位年龄位63岁,女性占72%,68%的患者为非吸烟者,95%的患者既往接受过EGFR TKI治疗(厄洛替尼治疗的患者占78%)。从接受奥希替尼治疗起,中位随访时间为13个月,在数据截止前,63%的患者仍然存活。患者接受奥希替尼治疗的中位PFS为8.8个月(95%CI:6.7-10.7),自诊断起的中位OS为76.7个月(95%CI:49.9-94.8),其中进展后继续接受奥希替尼治疗与更长的OS相关(11.2 vs 6.1个月,P=0.02)。此外在进展后继续接受奥希替尼治疗患者中,有21例(48%)接受了局部放疗,其余26例未接受局部放疗,两组的PFS2存在显著差异,mPFS分别为15.5 vs 8.2个月,HR 0.5;95%CI 0.3-1.0;P=0.05;OS亦存在显著差异,mOS分别为15.6 vs10.9个月,HR 0.53;95%CI 0.28-1.01;P=0.05。
在奥希替尼耐药的患者中,42例患者在进展时进行了基因检测,这42例患者在奥希替尼治疗前均存在T790M突变,其中2例为T790M胚系突变。奥希替尼治疗进展后,40例T790M体细胞突变的患者,21例(53%)T790M突变消失,19例(47%)仍可检测到T790M突变。对比这两类患者的耐药机制,可检测到T790M突变的19例患者:C797S/L792H(11/19.58%),MET扩增(5/19,26%);T790M突变消失的21例患者:PIK3CA突变(2/21,10%),MET扩增(1/21,5%),SCLC转化(1/21,5%)。此外,研究者还评估了奥希替尼进展后,细胞周期相关基因的变异情况,其中8例患者细胞周期相关基因出现变异,34例未出现变异,未出现变异的患者,接受奥希替尼治疗的PFS1显著更长,分别为8.8 vs 4.4个月(HR 2.8,95%CI 1.2-6.4,P=0.01)。
结论:
奥希替尼的耐药机制复杂,在耐药后T790M突变依然存在的患者中,EGFR基因的三次突变是最常见的耐药机制;在 T790M突变消失的患者中,奥希替尼的耐药机制,主要为EGFR非依赖性的,且由非驱动基因介导。同时,奥希替尼进展后继续奥希替尼治疗,可能为患者带来获益。
Abs 12108 探索EGFR 19del和L858R突变型NSCLC患者奥希替尼耐药机制的差异
背景:
EGFR位点的三次突变(C797,L792,G796)伴T790M突变是目前报道的奥希替尼最常见的耐药机制。既往研究显示,EGFR 19del患者相比于L858R突变的患者,接受EGFR TKI治疗后的PFS更长。本研究分析了,这两种常见的EGFR突变患者,奥希替尼耐药机制的差异。
方法:
利用目标基因捕获和NGS检测,分析了110例奥希替尼临床耐药的NSCLC患者中的体细胞突变。
结果:
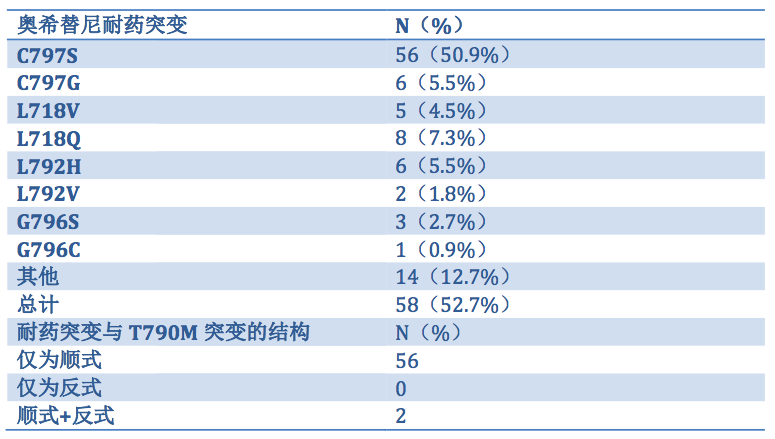
110例患者均携带EGFR敏感突变(64例19del,46例L858R),其中104例患者为EGFR T790M突变。在52.7%的患者(58/110)中,检测到可能介导奥希替尼,获得性耐药的突变,包括C797S(43例),C797G(6例),L792H(6例),L792V(2例),G796S(3例),G796C(1例),L718V(4例),L718Q(7例),18例患者存在多克隆耐药突变。在所有可分析的患者中,T790M与至少一个耐药突变顺式共存,其中2例L858R突变的患者,同时检测到与T790M反式共存的耐药突变,本研究中未检测到患者仅携带反式突变。奥希替尼获得性耐药突变的发生率总结见下表1。
表1. 奥希替尼获得性耐药的突变及其发生率
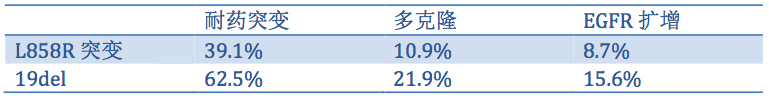
对比19del和L858突变患者,耐药突变的发生率:19del组患者耐药突变发生率显著高于L858R突变组患者(62.5% vs 39.1%,p=0.015,表2);且两组多克隆突变发生率(21.9% vs 10.9%)和EGFR扩增率(15.6% vs 8.7%)也存在差异,这可能与19del患者接受了更长期的药物治疗,因此药物选择压力更大有关。此外,在这些患者中还检测到旁路或下游通路共活化突变:EML4-ALK重排(1例),MET扩增(1例),RET-CCDC6重排(1例),KRAS突变(1例),BRAF突变(7例),PIK3CA突变(5例)和PTEN缺失(3例)。
表2. 19del和L858R突变患者耐药突变谱的差异
小结:
本研究显示,奥希替尼获得性耐药突变在EGFR19del患者中的发生率显著高于L858R突变的患者。通过对奥希替尼耐药患者的耐药机制探索,有助于开发更为有效的治疗方案。
总结
通过对一、二代EGFR TKI进展后耐药机制的探寻,进而研发出三代EGFR TKI奥希替尼,奥希替尼的药物研发和临床研究是精准医学成功的典范。随着奥希替尼在临床的广泛应用,探寻奥希替尼耐药的机制,并寻找克服耐药的有效治疗策略,成为临床研究的重点。目前,奥希替尼耐药的机制主要分为EGFR通路依赖型和非依赖型,下图汇总了目前研究报道的奥希替尼常见的耐药机制及耐药后处理策略。
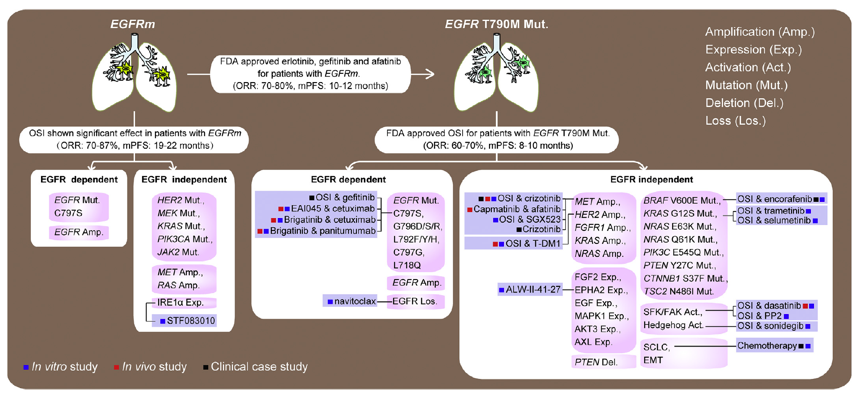
图:EGFR突变患者的治疗模式和潜在的耐药后治疗策略
1. Next Generation Sequencing (NGS) based mutation profiling reveals heterogeneity of resistance mechanisms to AZD9291. ASCO 2018, abs 9068
2. Identification of OsimertinibResistance Mechanisms in Chinese NSCLC Patients: Analysis from AURA17 Trial. ASCO 2018, abs 9077
3. Landscape of EGFR-dependent and independent resistance mechanisms to osimertinib in EGFR-mutant NSCLC. ASCO 2018, abs 9087
4. Landscape of osimertinib resistant mutations between the two common subtypes of EGFR 19del or L858R in NSCLC. ASCO 2018, abs 12108
5. Osimertinib resistance in non-small cell lung cancer: Mechanisms and therapeutic strategies. Cancer Letters 420 (2018) 242e246











 苏公网安备32059002004080号
苏公网安备32059002004080号


