黑色素瘤作为免疫治疗的跑马场, 近年来重磅研究结果层出不穷。今年ASCO免疫治疗相关研究更是百花齐放,【肿瘤资讯】特意邀请中山大学肿瘤医院生物治疗中心张晓实教授为我们点评此次ASCO的黑色素瘤免疫联合治疗。

主任医师,博士生导师
中山大学附属肿瘤医院生物治疗中心副主任
中山大学附属肿瘤医院黑色素瘤单病种首席专家
广东省抗癌协会黑色素瘤专委会主任委员
广东省医院协会肿瘤防治分会副主任委员和肿瘤免疫治疗专委会主任委员
中国临床肿瘤协会黑色素瘤专委会委员
近年来,黑色素瘤免疫治疗重磅研究结果纷至沓来。NCCN指南已经将免疫治疗作为转移或不可切除恶性黑色的一线推荐治疗方案。也正因为近些年长足的进步, 在黑色素瘤领域的研究往往领先于其他瘤种, 新研究的关注点已从确定免疫抑制剂是否可以带来获益, 转移至如何提高免疫抑制剂的有效性和获益人群。
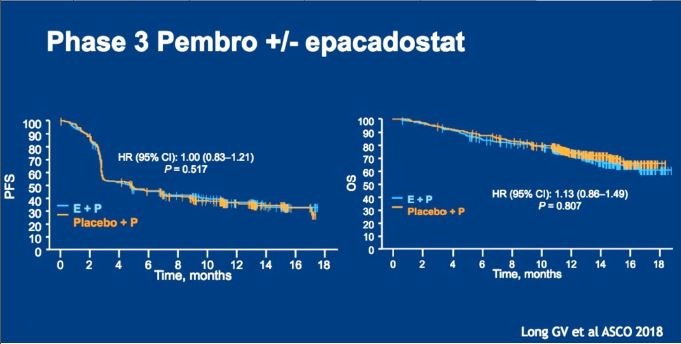
 此前一直备受瞩目的PD-1抗体+IDO抑制剂 (吲哚胺2,3-双加氧酶, 商品名Epacadostat) 于2018年4月6号公布III期临床研究失败的消息, 原本最有希望挑战PD-1单药的联合治疗组合意外落马。
此前一直备受瞩目的PD-1抗体+IDO抑制剂 (吲哚胺2,3-双加氧酶, 商品名Epacadostat) 于2018年4月6号公布III期临床研究失败的消息, 原本最有希望挑战PD-1单药的联合治疗组合意外落马。
尽管如此, 2018年ASCO年会上黑色素瘤免疫治疗研究仍有可圈可点之处。
黑色素瘤PD-1免疫治疗喜获长期生存数据
以帕博利珠单抗(Pembrolizumab)和纳武利尤单抗(Nivolumab)为代表的PD-1抗体已经奠定了晚期转移或不可切除黑色素瘤的绝对领导地位。 大家关心的问题是, 这些PD-1抗体是否可以提供像CTLA-4抗体一样的长效生存获益。本次ASCO大会的两项研究就这一问题给出了漂亮的答卷。
KEYNOTE-001研究(2018年ASCO 摘要9516,简称摘要9516,下同)观察到帕博利珠单抗治疗655例转移性皮肤黑色素瘤的5年生存率达34%,其中一线治疗的5年生存率长达41% (即10位患者中有4位在5年后仍然生存), 这也是该药报道的最长随访结果, 证明了帕博利珠单抗带来的持久性应答。
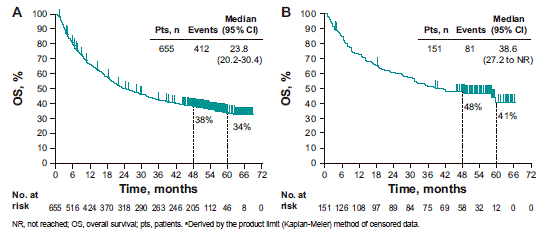
KEYNOTE-001
另一项KEYNOTE-006研究(摘要号9503)观察帕博利珠单抗治疗834例晚期皮肤黑色素瘤的4年随访结果再次佐证PD-1抗体可以达到和CTLA-4抗体相似甚至更为优异的长期生存获益。所有患者的客观缓解率为42%, 4年生存率同样达到42%; 在该研究中所有完成了两年帕博利珠单抗治疗的病人中,86%的病人在停药20个月后未出现疾病进展,长期生存的获益是显而易见的。
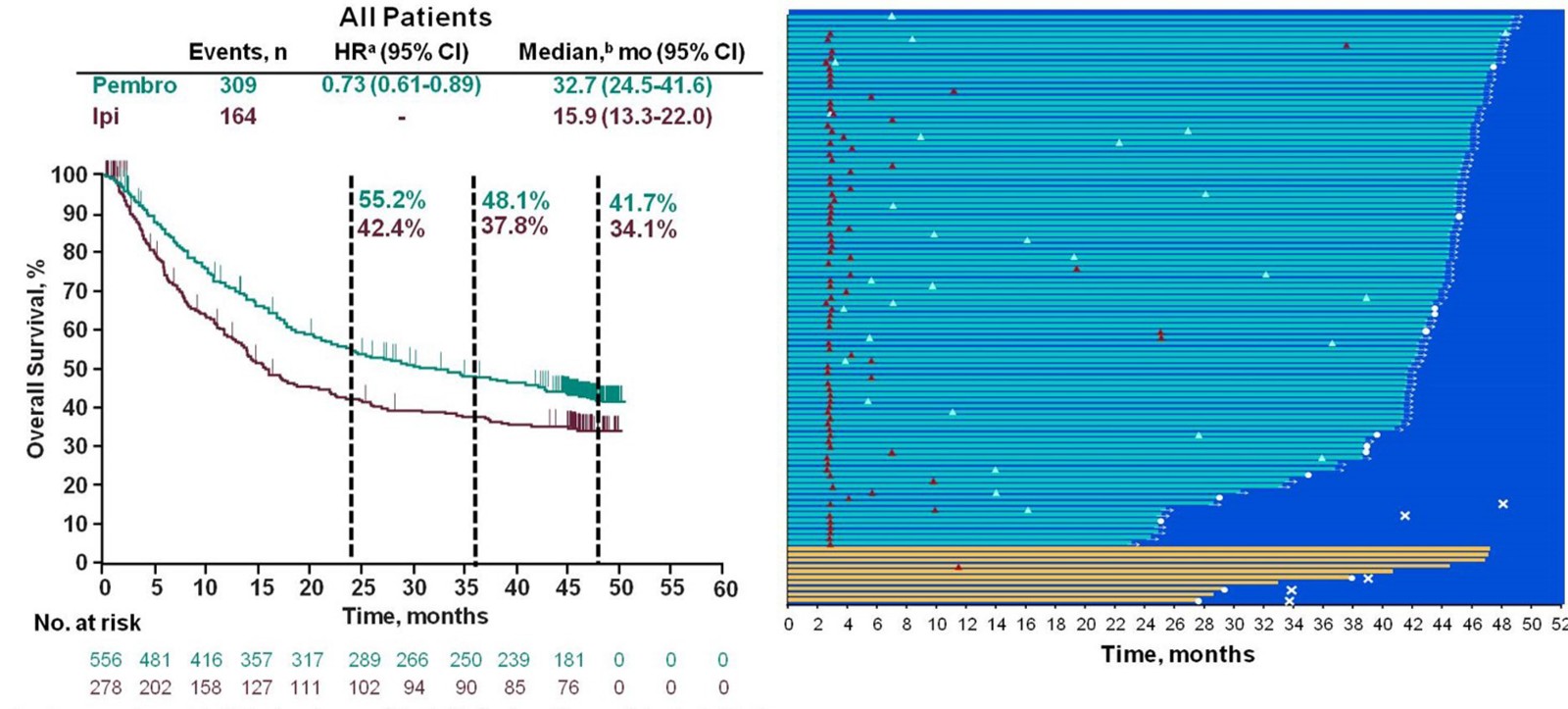
KEYNOTE-006
从免疫机制入手探寻提升PD-1抗体有效性的新途径
尽管PD-1抗体在部分晚期黑色素瘤患者中疗效显著, 但仍有不少病人使用后无法获得客观缓解, 因此, 改善PD-1有效性是现在研发的主要方向。
PD-1抗体的主要机制是松开免疫细胞刹车,让CTL、NK和巨噬细胞等抗肿瘤免疫效应细胞能够杀灭肿瘤细胞和肿瘤间质细胞。因此,PD-1抗体发挥作用需要2个条件:第一,肿瘤具有免疫原性,患者体内存在自发的抗肿瘤免疫应答。第二,肿瘤细胞和肿瘤间质细胞通过表达PD-L1来逃避免疫效应细胞杀伤。改善PD-1抗体疗效的研究思路也由此展开。一方面是筛选PD-1抗体治疗的优势人群,另一方面是设计以PD-1抗体为基础的联合免疫。联合免疫治疗的重点包括2个方面,一是联合增强肿瘤免疫原性的药物,二是联合调节免疫效应细胞功能的药物。

提高肿瘤的免疫原性是改善PD-1抗体有效性的首要前提。提高肿瘤免疫原性包括2个关键环节,一是诱导肿瘤细胞发生免疫原性死亡,目前可以采用的药物和技术包括溶瘤病毒、放疗、化疗和靶向治疗等。二是提高肿瘤抗原递呈效率,如CTLA-4抗体、干扰素诱导剂等。
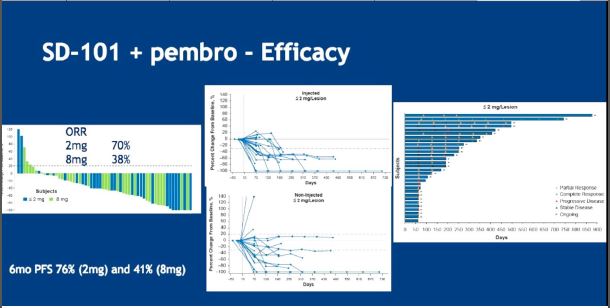
TLR9 激动剂SD-101促进肿瘤组织中不成熟的树突细胞表达干扰素,促进抗原递呈,触发抗肿瘤免疫应答。肿瘤抗原特异性T细胞浸润肿瘤组织后释放的干扰素γ,后者诱导肿瘤细胞表达PD-L1,使治疗前PD-L1阴性的肿瘤细胞转化为PD-L1阳性的肿瘤细胞。低剂量SD-101联合帕博利珠单抗一线治疗37例皮肤黑色素瘤,ORR为70%,优势人群为基线肿瘤细胞PD-L1阴性患者(摘要号9513)。
多靶点药物阿昔替尼可以抑制肿瘤血管生成、促进抗原递呈、促进淋巴细胞浸润肿瘤组织和改善免疫抑制微环境。此次ASCO的一项国产PD-1抗体JS001联合阿昔替尼治疗33例转移性粘膜黑色素瘤有效率达60%(摘要号9528)。
另一个引人注目的组合是PARP抑制剂联合PD-1抗体。PARP抑制剂Niraparib联合帕博利珠单抗在三阴乳腺癌和卵巢癌取得初步成功,其疗效与是否存在BRCA突变或双链重组修复基因缺陷无关。可能的机制是PARP抑制剂不仅加剧DNA损伤,产生更多新抗原,而且诱导肿瘤细胞表达干扰素(摘要号106)。皮肤黑色素瘤常常合并DNA损伤修复相关基因突变,值得深入研究PARP抑制剂联合PD-1抗体治疗黑色素瘤的价值。
CTLA-4抗体的主要功能为促进抗原递呈、促进淋巴细胞浸润肿瘤组织和抑制肿瘤微环境的调节性T细胞。CM067、CM069和KEYNOTE-029研究均证明PD-1抗体同期联合Ipilimumab一线治疗晚期皮肤黑色素瘤可以提高有效率、PFS和OS。如果PD-1抗体耐药后再用Ipilimumab改善肿瘤免疫原性还有效吗?在22例既往PD-1抗体或PD-L1抗体无效的皮肤黑色素瘤中,帕博利珠单抗(200mg)联合ipilimumab(1mg/kg)有效率为45%,稍低于初治患者的有效率(57%)(摘要号9514)。另一项研究也显示PD-1抗体失败后ipilimumab联合TLR9激动剂IMO-2125治疗21例黑色素瘤患者的有效率为38%(摘要号9515)。
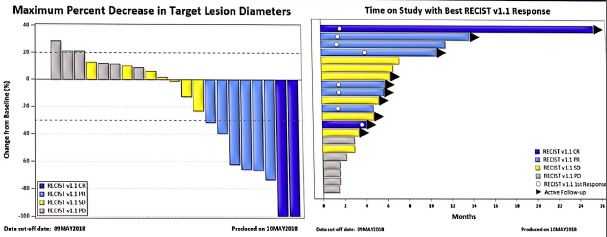
肿瘤负荷从正反两方面影响免疫治疗疗效。肿瘤负荷较大时免疫治疗有效性降低。但是,肿瘤负荷较大时存在更多的肿瘤细胞克隆,增加肿瘤抗原的多样性,所触发的免疫杀伤更加具有广泛性。因此,与辅助免疫治疗相比,新辅助免疫治疗更加有利于控制微小转移灶,改善总生存。例如,O1-I3方案(Nivolumab 1mg/kg,Ipilimumab 3mg/kg)新辅助治疗11例黑色素瘤,其有效率为73%,pCR达45%,优于Nivolumab单药,但伴随明显的免疫相关毒性(摘要号9511)。
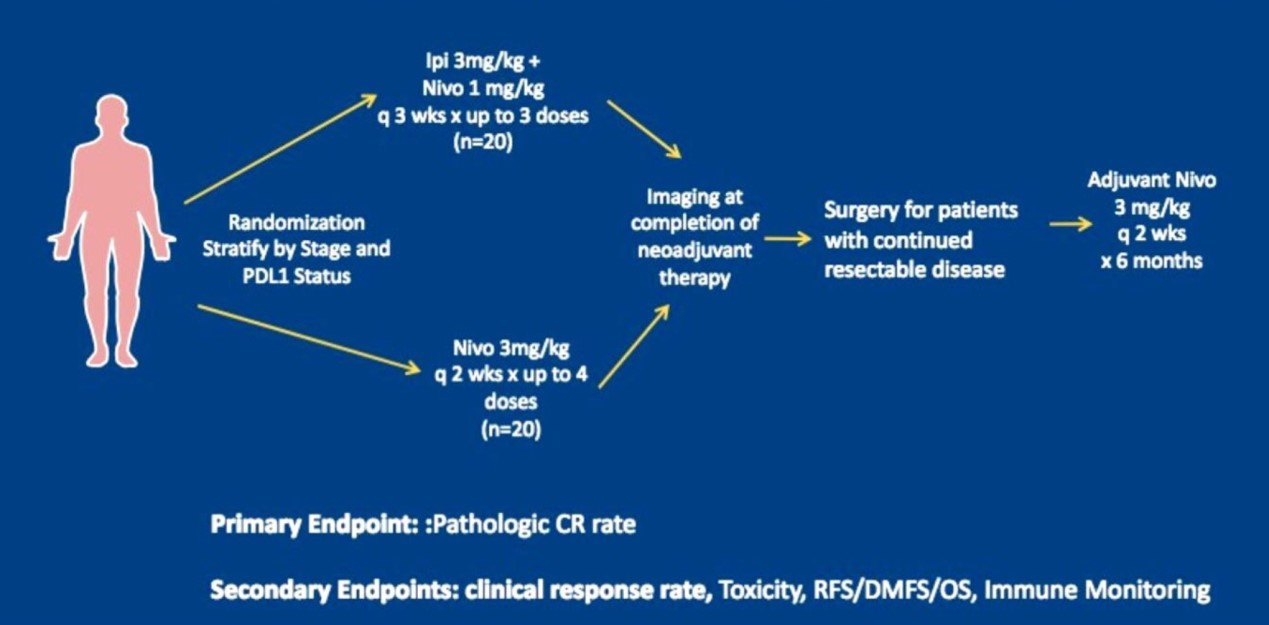
溶瘤病毒T-vec是转染GM-CSF的减毒单纯疱疹病毒。病毒复制导致肿瘤细胞裂解,释放肿瘤抗原。病毒骨架和GM-CSF作为免疫佐剂,使肿瘤病灶变成“原位疫苗”。如果新辅助治疗采用溶瘤病毒T-vec,57例患者中pCR 达21%,无明显毒性(摘要号9508)。由于随访时间短,目前尚不知新辅助免疫治疗对患者无复发生存和总生存的影响。新辅助免疫治疗的重心是调节机体的抗肿瘤免疫应答而不是降期,关键标志物为是否出现免疫效应细胞浸润肿瘤组织,不必强调临床“有效”。值得注意的是,新辅助免疫治疗存在贻误手术的风险,原因之一是免疫治疗期间肿瘤进展,二是早中期肿瘤患者的免疫抑制状态较轻,免疫相关副作用发生率和严重程度均高于晚期肿瘤患者。优化新辅助免疫治疗方案将是近年的研究热点。
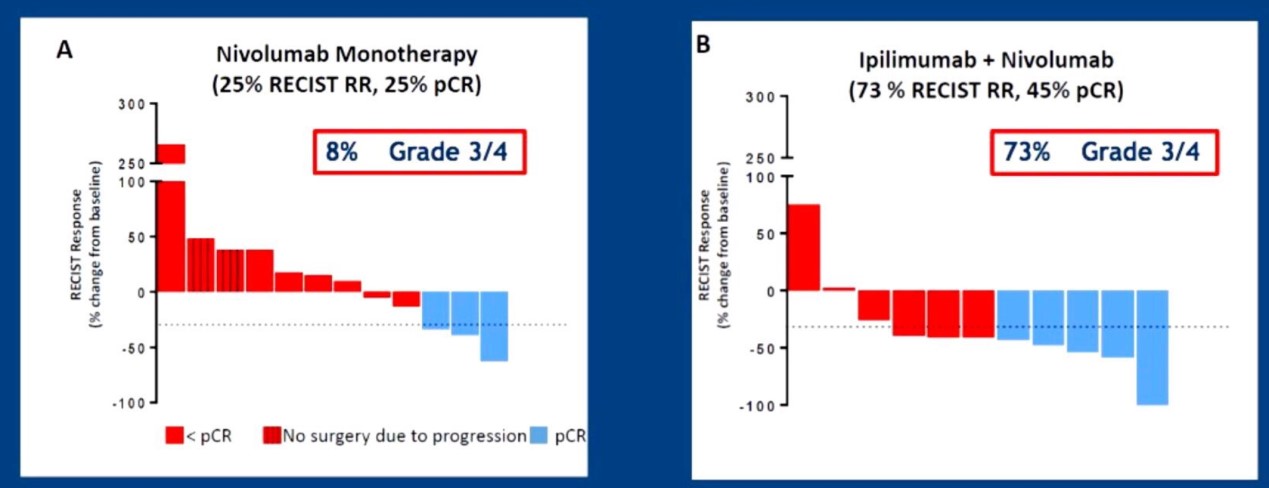
除提高肿瘤免疫原性外,调整T淋巴细胞、NK细胞和巨噬细胞等免疫效应细胞功能是另一个研究热点。例如,T淋巴细胞活化时释放干扰素γ,干扰素γ不仅诱导PD-L1表达,也诱导肿瘤细胞和肿瘤间质细胞表达IDO。IDO降解肿瘤微环境的色氨酸,抑制T细胞功能。II期临床研究显示IDO抑制剂联合PD-1抗体具有较高的有效率,遗憾的是III期临床研究(KN-252研究)未能证实联合治疗的叠加或协同作用,提示IDO表达不是干扰T细胞功能的主要因素(摘要号108、9511和9512)。
虽然IDO抑制剂受挫,其他免疫效应细胞功能调节剂联合PD-1抗体治疗实体瘤取得初步进展。例如,JTX-2011(ISCO激动性抗体,摘要号3000)、Varlilumab(CD27激动性抗体, 摘要号3001)、M7824(PD-L1和TGFβ双特异性抗体,摘要号3006)、NKTR-214(CD122激动剂,摘要号3006)、ALT-803(IL-15受体激动剂,摘要号3008))、MK-1248(GITR特异性抗体,摘要号3209)、Hu5F9-G4(CD47特异性抗体,摘要号3002)等。
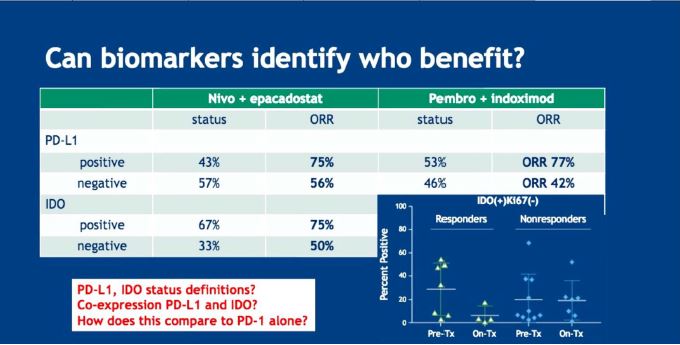
相对于热火朝天的联合免疫治疗研究,筛选PD-1抗体优势人群的研究进展缓慢。肿瘤突变负荷(TMB)、肿瘤细胞或肿瘤间质细胞PDL1表达水平、错配修复基因缺陷(dMMR)预测PD-1抗体有效性的敏感性和特异性均未获得进一步确认,更加复杂的免疫频谱分析等还在研究中(摘要号9518)。
停药, 不停药? 这是一个问题
PD-1抗体治疗后许多患者长期处于PR或SD状态,何时停药是一个难题。PD-1抗体治疗1年时的PET评价结果可能是一个有临床应用前景的指标。在118例经过PD-1抗体、CTLA-4抗体和溶瘤病毒治疗的黑色素瘤队列中,治疗1年时CT评价23%患者达CR,而PET评价68%患者达到CR,提示参考PET结果更多患者可以及时停药(摘要号9517)。KEYNOTE-006研究从另一方面证实了, 连续用PD-1抗体满2年是一个不错的时间长度。
总结: 强强联合, 君臣佐使
综上所述,若提高PD-1抗体的有效性,联合治疗是必由之路。参考抗肿瘤免疫应答原理,未来的以PD-1/PD-L1抗体为基础的联合免疫治疗将出现类似中医方剂的“君臣佐使”组合模式。
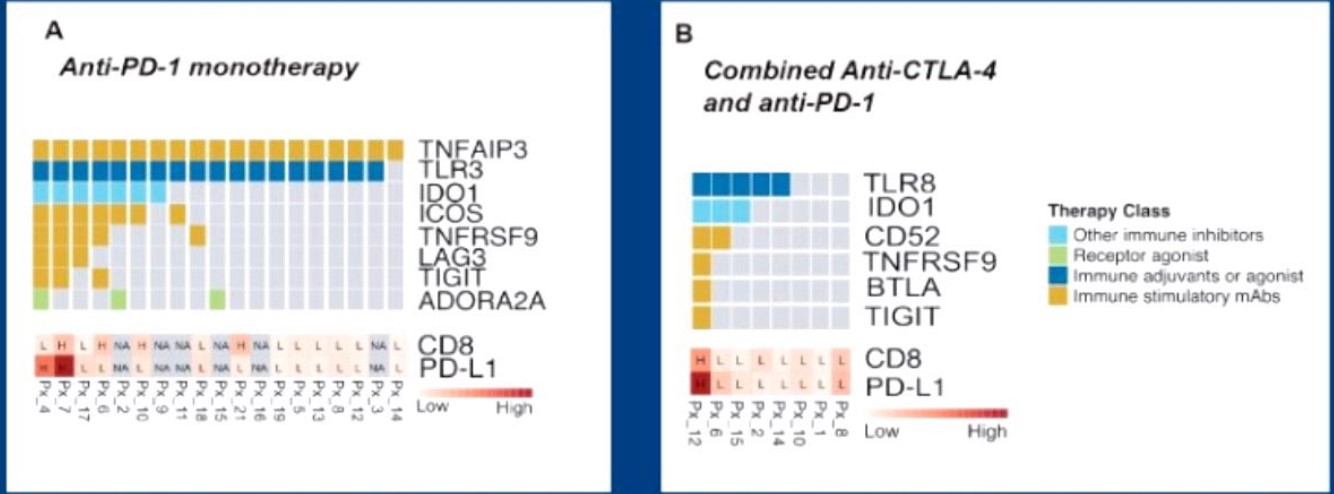 “君药”, 和英文所说的Back bonetreatment异曲同工, 在免疫联合中指PD-1抗体和/或PD-L1抗体。“臣药”为免疫效应细胞功能调节剂。这一类药物的特点是自身无显著的抗肿瘤效应和毒性,但能显著提高PD-1/PD-L1抗体疗效,如上述NKTR-214等。“佐药”为诱导肿瘤细胞免疫原性死亡和/或改善抗原递呈效率的药物和技术。这一类药物的特点是自身具有一定的抗肿瘤作用,联合PD-1/PD-L1抗体后可能出现“增效增毒”,如放疗、化疗、靶向治疗、溶瘤病毒、CTLA-4抗体和TLR9激动剂等。“使药”为促进T淋巴细胞浸润的药物。淋巴细胞释放的干扰素γ诱导PD-L1表达,使治疗前不表达PD-L1的肿瘤表达PD-L1,既确保存在PD-1/PD-L1抗体靶点,又免除基线评价PD-L1表达的种种困扰。除上述“臣药”和“佐药”可能具有“使药”功能外,贝伐单抗等血管生成抑制剂是另一类“使药”。
“君药”, 和英文所说的Back bonetreatment异曲同工, 在免疫联合中指PD-1抗体和/或PD-L1抗体。“臣药”为免疫效应细胞功能调节剂。这一类药物的特点是自身无显著的抗肿瘤效应和毒性,但能显著提高PD-1/PD-L1抗体疗效,如上述NKTR-214等。“佐药”为诱导肿瘤细胞免疫原性死亡和/或改善抗原递呈效率的药物和技术。这一类药物的特点是自身具有一定的抗肿瘤作用,联合PD-1/PD-L1抗体后可能出现“增效增毒”,如放疗、化疗、靶向治疗、溶瘤病毒、CTLA-4抗体和TLR9激动剂等。“使药”为促进T淋巴细胞浸润的药物。淋巴细胞释放的干扰素γ诱导PD-L1表达,使治疗前不表达PD-L1的肿瘤表达PD-L1,既确保存在PD-1/PD-L1抗体靶点,又免除基线评价PD-L1表达的种种困扰。除上述“臣药”和“佐药”可能具有“使药”功能外,贝伐单抗等血管生成抑制剂是另一类“使药”。
在临床实践中,联合免疫治疗应该在“君臣佐使”有机组合的基础上,结合患者个体肿瘤的遗传背景差异,“随症加减”调节免疫信号的小分子靶向药物,如JAK抑制剂等,使恶性肿瘤长期处于免疫监视之下。免疫编辑理论提示免疫监视不足以治愈肿瘤,还需要联合分化诱导策略,让肿瘤细胞“改邪归正”,治愈肿瘤。
IDO抑制剂的教训提醒我们要慎重看待II期临床研究结果。目前的大部分联合免疫治疗研究为小样本II期临床研究,期待III期临床研究能筛选出高效低毒的联合免疫治疗方案。











 苏公网安备32059002004080号
苏公网安备32059002004080号


