第54届美国肿瘤学年会(ASCO)于当地时间2018年6月1日—2018年6月5日在美国芝加哥麦考密克展览中心拉开帷幕。今年大会主题是“传递新知 延展精准医学版图”。在本次ASCO年会上将迎来多项肿瘤领域的重磅研究,免疫治疗依旧是今年的重头戏。各种免疫临床试验频传捷报,但是一线治疗该选择何种方案,众说纷纭,且听ASCO专家为您带来的现场解读。
蔡修宇教授:what's best?

副主任医师、硕士生导师
中山大学附属肿瘤医院肿瘤内科
广州市中青年肿瘤医师论坛 主席
广东省胸部疾病学会免疫治疗专业委员会 候副主任委员
广东省保健协会肿瘤防治专业委员会 秘书长
CSCO Young中国临床肿瘤青年委员会 常委
2016NCCN癌症生存者指南 主译
擅长常见肿瘤的靶向及免疫治疗

Tom Stinchcombe
Tom Stinchcombe就“免疫一线治疗决策:What's best?”主题进行点评
目前的临床试验已然涉及免疫治疗的方方面面,各大临床试验就像百米冲刺般希望能够率先公布阳性结果。但越在此时,临床医生对临床试验数据的解读越需谨慎。无论临床试验设计如何,总生存OS始终是首要评价指标。IMPOWER 131和CheckMate 227这两项研究的启动时间大致相同,且均涉及免疫治疗的联合方案,可比性较高。
因为肺鳞癌与吸烟密切相关,且多有较高的肿瘤突变负荷TMB。现有的III期临床试验已经证实,卡铂、白蛋白紫杉醇+/- 帕博利珠单抗(Pembrolizumab)的联合方案能够显著提高晚期肺鳞癌患者的ORR、PFS以及OS。IMPOWER 131研究纳入任何PD-L1表达水平的晚期肺鳞癌患者,将其随机分配至以下三组(见下图)。此次讨论主要集中于B组和C组的疗效和生存分析。
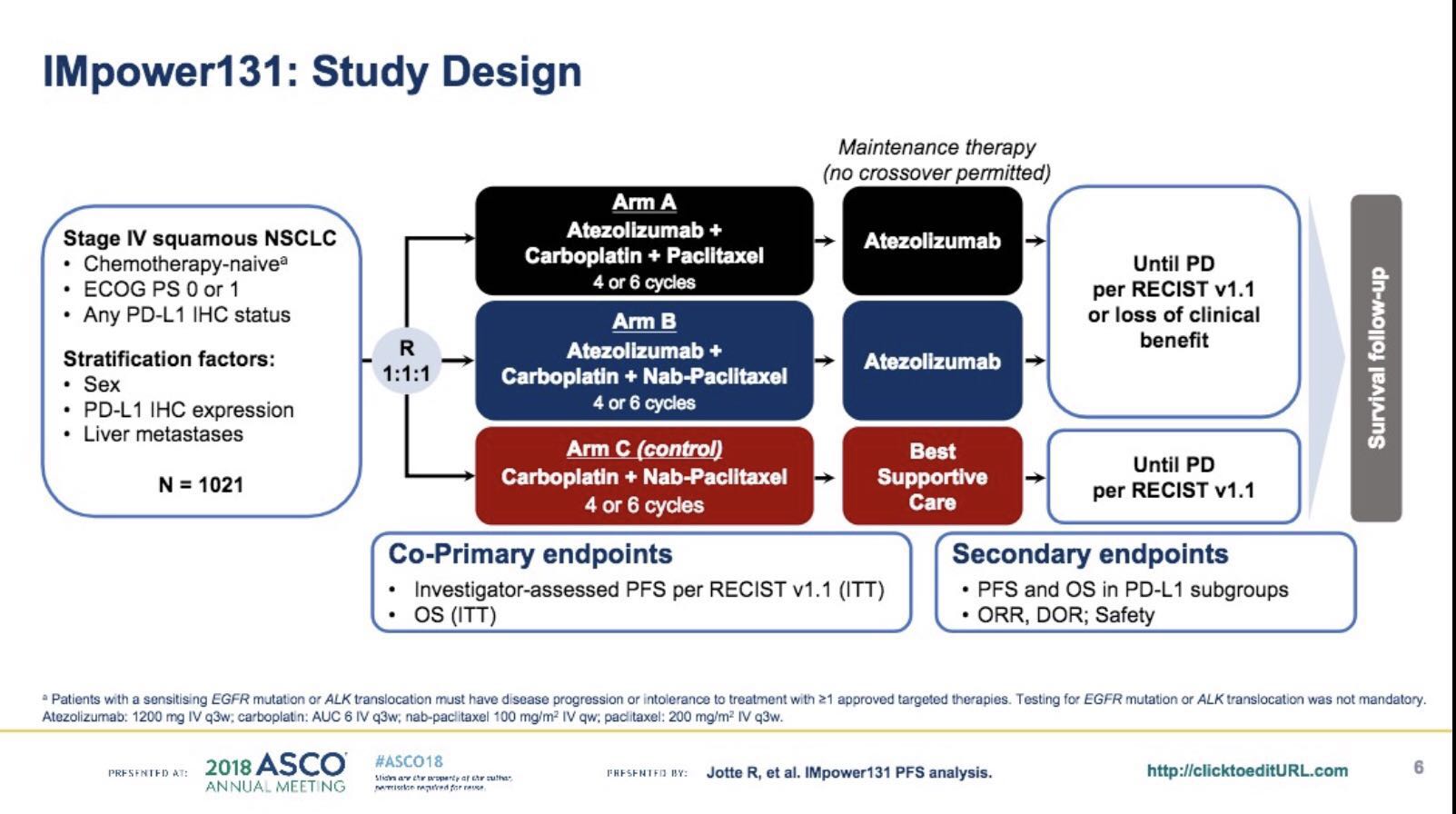
首先是两组的PFS数据。治疗的前6个月,两个治疗组的PFS曲线大致并行。但在接下来的6个月治疗中,两条曲线逐渐分开。由此提示,研究中的B组患者中可能存在某种亚组人群能够从Atezolizumab、卡铂和白蛋白结合型紫杉醇的联合用药方案中获益,但同时存在另一亚组人群并不能够从中获益。
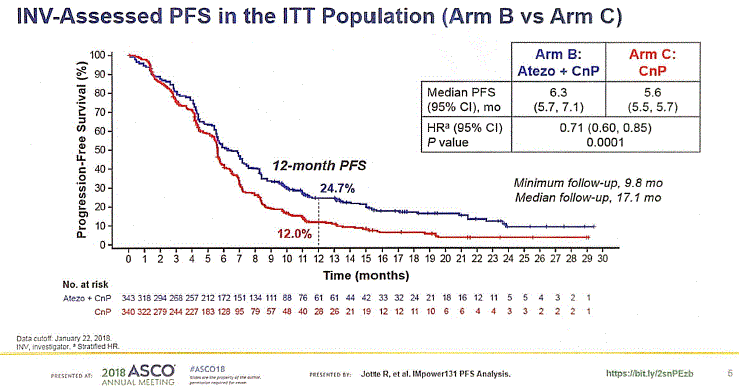
再看OS数据。在治疗的前15个月,两组的总生存曲线几乎完全重合;风险比为0.96,P值为0.69,暂无统计学意义。此次公布的结果为该研究的第一次中期生存分析,其总生存OS数据尚未成熟。根据目前的PFS和OS数据来看,该研究暂时未能证明免疫治疗联合卡铂/白蛋白结合型紫杉醇可以使晚期肺鳞癌患者OS获益。
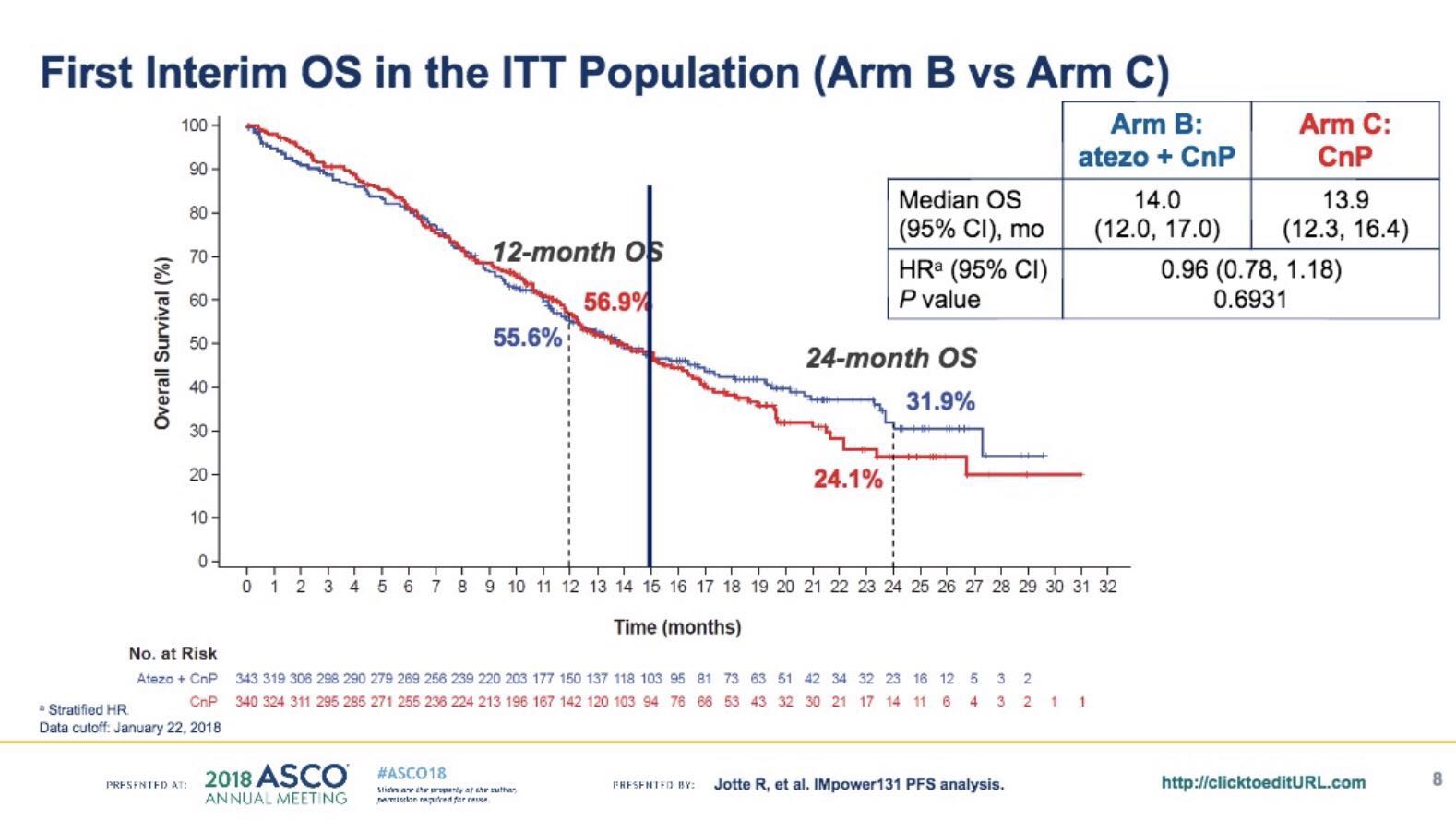
疗效分析方面,主要集中讨论以下两组数据。
首先,在PD-L1高表达(即TC或者IC评分3)的亚组人群中, ORR、DOR、PFS、甚至OS均有显著差异。两组的 OS分别为23.6个月和14.1个月。根据基线的临床数据来看,两组患者来自同一人群,且为帕博利珠单抗的适用人群。Atezolizumab、卡铂和白蛋白结合型紫杉醇可能使PD-L1高表达的肺鳞癌患者获益。
第二,在PD-L1低表达(即TC或者IC评分1/2)的亚组人群中,两组的OS无显著差异,风险比为1.34,并无统计学意义,说明对于PD-L1低水平表达的患者,目前的标准化疗方案仍是最佳选择。
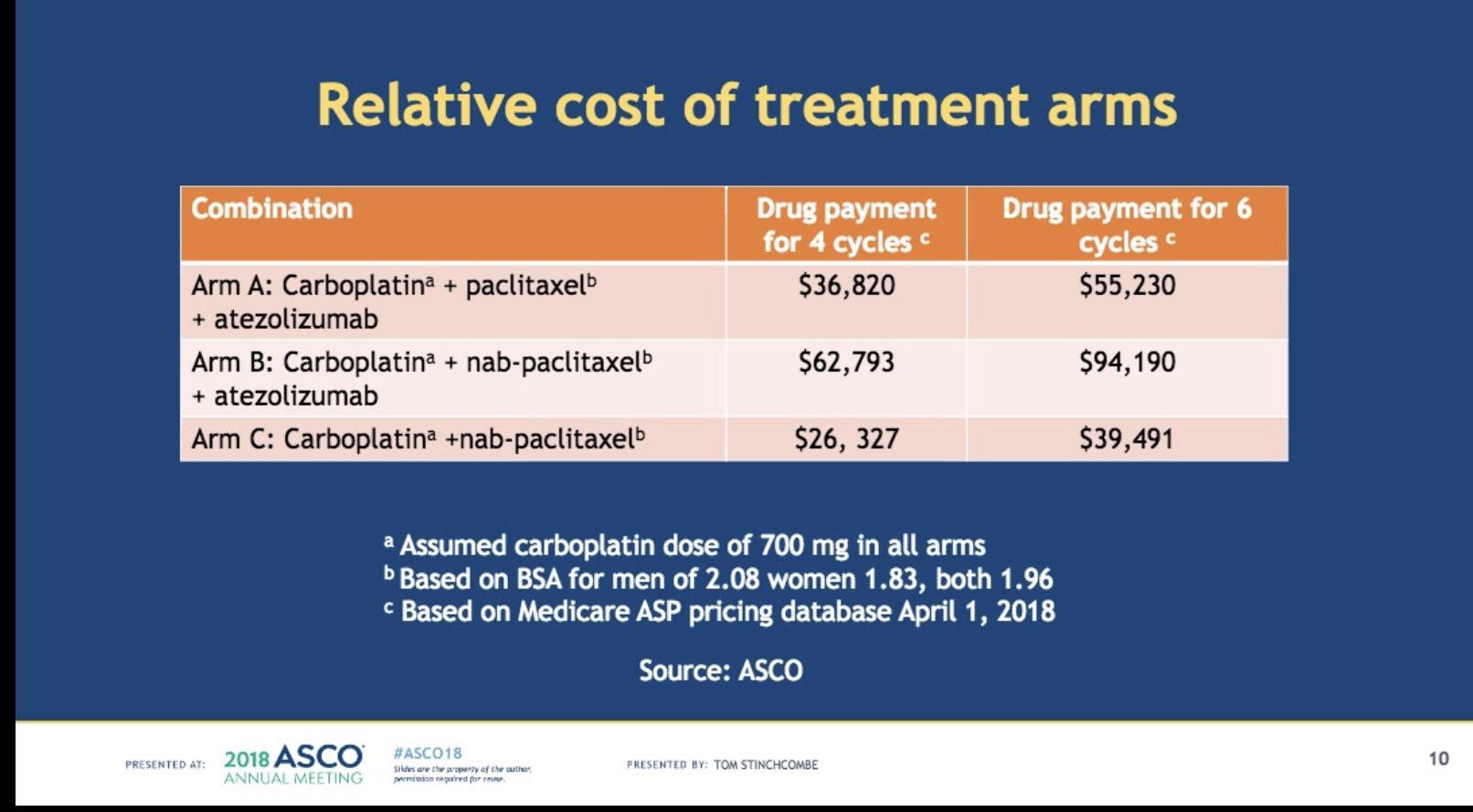
讲者列出了ASCO对于三组治疗方案的价格参考。通过对比三个研究组的治疗费用,联合Atezolizumab、卡铂和白蛋白结合型紫杉醇的B组方案最为昂贵,其次是卡铂和白蛋白结合型紫杉醇的C组;而标准治疗组的治疗费用最低。由此来看,增加白蛋白结合型紫杉醇,能够提高OS获益,但同时也增加了治疗费用和药物毒性,是值得斟酌的重要临床问题。
第二个点评的研究是CheckMate-227(NCT02477826)。这是一项针对晚期NSCLC一线治疗方案的随机、开放的III期临床研究,主要对比纳武利尤单抗联合伊匹木单抗(nivo+ipi)、纳武利尤单抗联合化疗、单纯化疗的疗效。
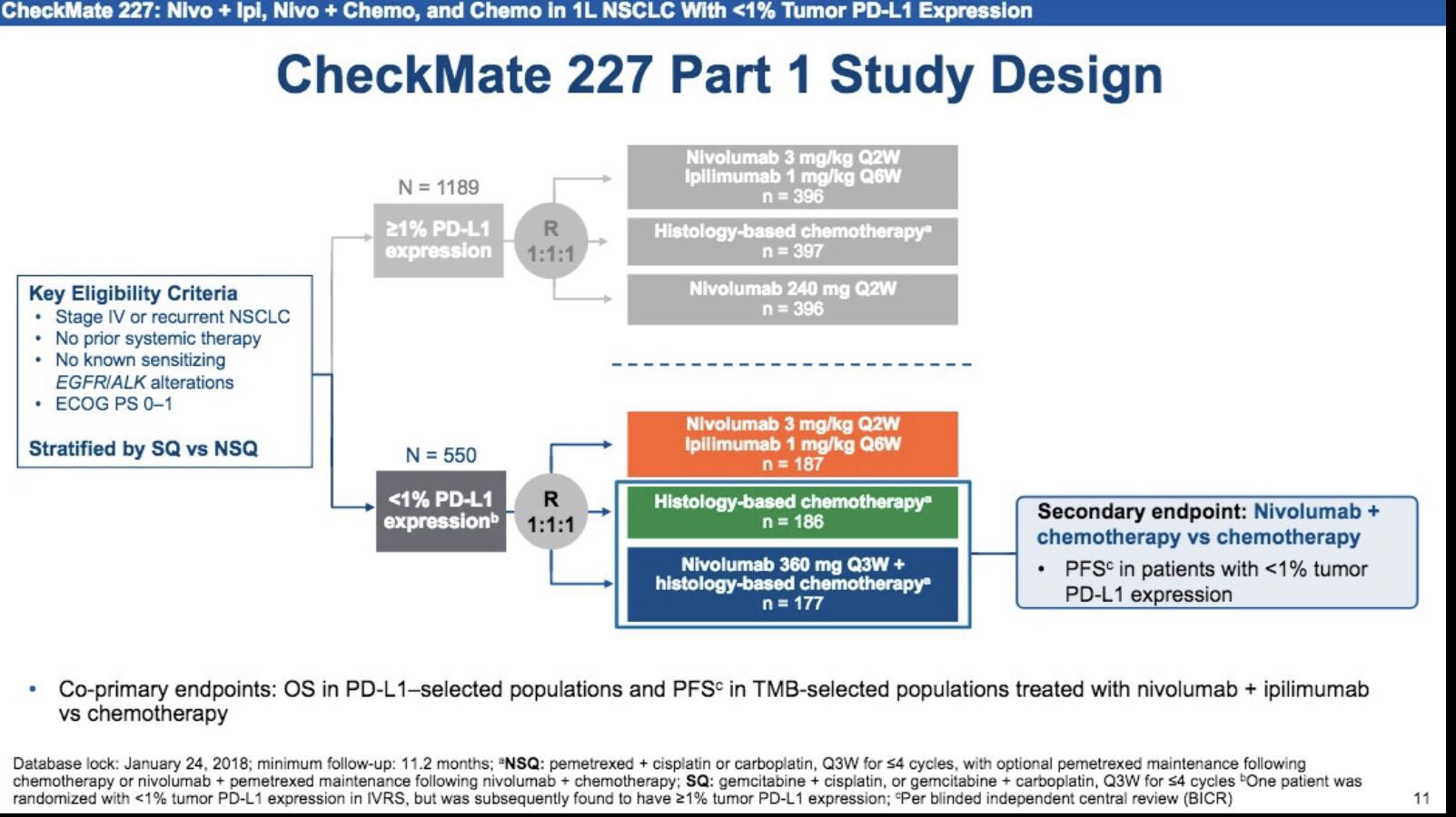 关于Checkmate-227研究我们将重点关注PD-L1表达小于1%的人群,接下来我将从以下两方面来进行分析。第一,三组治疗方案(纳武利尤单抗联合伊匹木单抗、纳武利尤单抗联合化疗、单纯化疗)在未经治疗的晚期NSCLC患者中的疗效对比。第二,根据肿瘤突变负荷(TMB)状态分层的亚组分析。
关于Checkmate-227研究我们将重点关注PD-L1表达小于1%的人群,接下来我将从以下两方面来进行分析。第一,三组治疗方案(纳武利尤单抗联合伊匹木单抗、纳武利尤单抗联合化疗、单纯化疗)在未经治疗的晚期NSCLC患者中的疗效对比。第二,根据肿瘤突变负荷(TMB)状态分层的亚组分析。

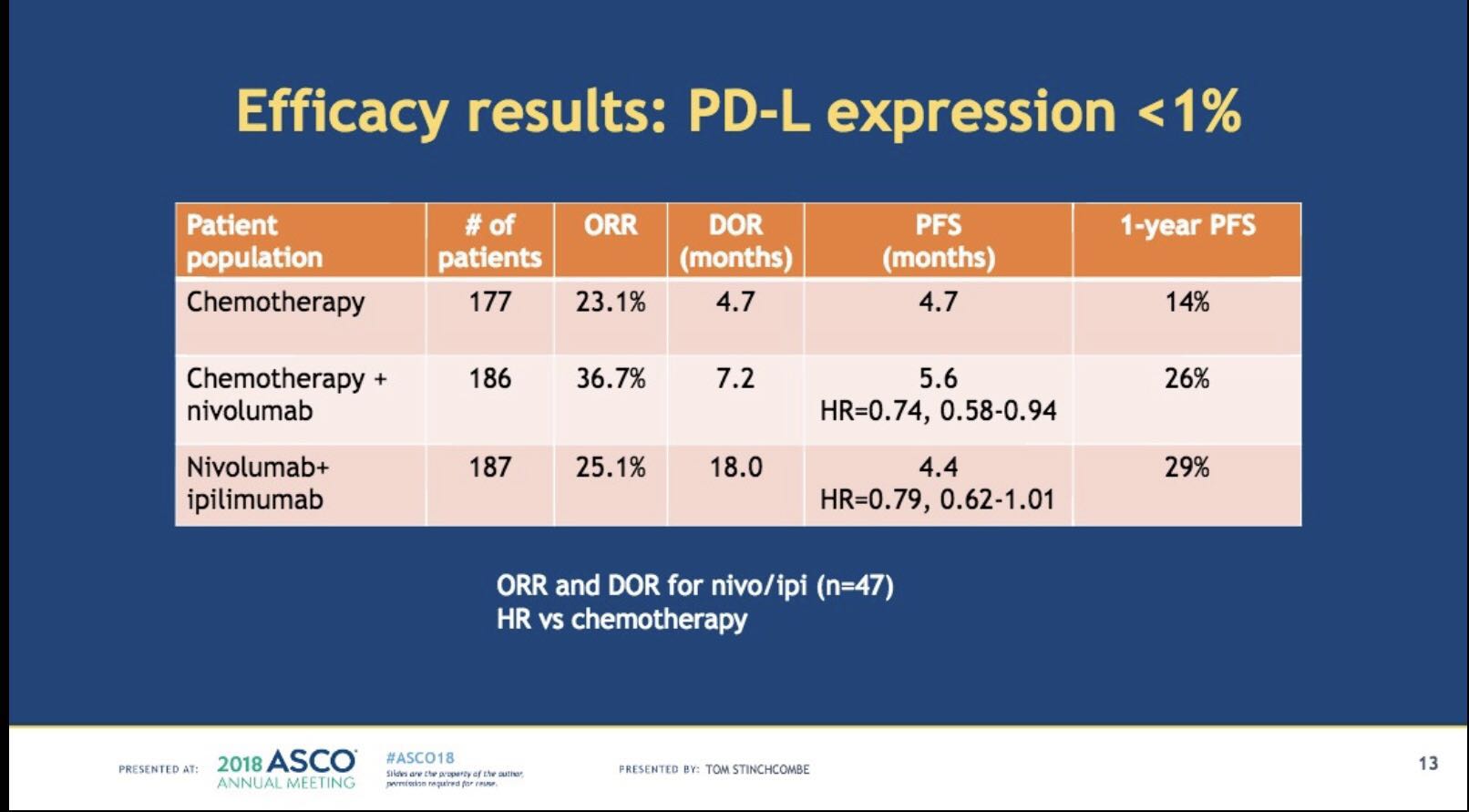
首先来看三组的疗效总结。与化疗组相比,化疗联合纳武利尤单抗组的ORR、DOR、PFS以及1年无疾病进展生存率较有优势。但纳武利尤单抗联合伊匹木单抗的ORR仅为25.1%,DOR为18.0个月,PFS为4.4个月,1年无疾病进展生存率为29%,并未优于化疗联合纳武利尤单抗组。造成三组疗效差异的原因可能在于入组人群的选择。
其次,关于肿瘤突变负荷,讲者根据TMB在肿瘤的诊疗应用中将其分为已知和未知这两大类。目前已知的是:第一,在回顾性研究中,TMB较高的患者能够从免疫单药、或联合治疗中获益;第二,在TMB较高的患者中,对比标准化疗,纳武利尤单抗联合伊匹木单抗能够显著延长ORR和PFS;第三,TMB和PD-L1均为独立的生物标记物;第四,根据现有的临床数据,TMB水平的高低足以指导临床治疗方案。但目前也尚存在较多未知。首先,不同实验室评估TMB的方法尚未统一,可重复性,以及>10 Mut/ Mb是否能够作为最佳cutoff值都不得而知。其次,除了入组临床试验的患者,临床实际中检测TMB的可行性如何?第三,TMB检测耗时,无法及时得出结果、指导治疗。最后,目前尚无前瞻性临床试验的证据提示TMB是否具备预测OS获益的价值。

我们来看CheckMate227研究基于TMB分层的生存数据分析。同样是PD-L1低表达,在TMB< 10 mut/Mb亚组中,纳武利尤单抗联合化疗与单纯化疗组在ORR、PFS上均无统计学差异;但在TMB> 10 mut/Mb亚组人群中,纳武利尤单抗联合化疗组的ORR达60.5%, 中位PFS达6.2个月,显著优于单纯化疗组。但是,我们需要警惕的是,纳武利尤单抗联合化疗组的优势,到底是来源于双药联合、抑或Nivolumab的独角胜利?

近期NEJM发表的CheckMate227研究PFS数据显示,在PD-L1表达阳性(> 1%)、TMB> 10 mut /Mb亚组人群中,纳武利尤单抗联合伊匹木单抗组、纳武利尤单抗单药组以及单纯化疗组的PFS获益趋势与上述相似,即免疫治疗单药或联合治疗,其PFS均优于单纯化疗。
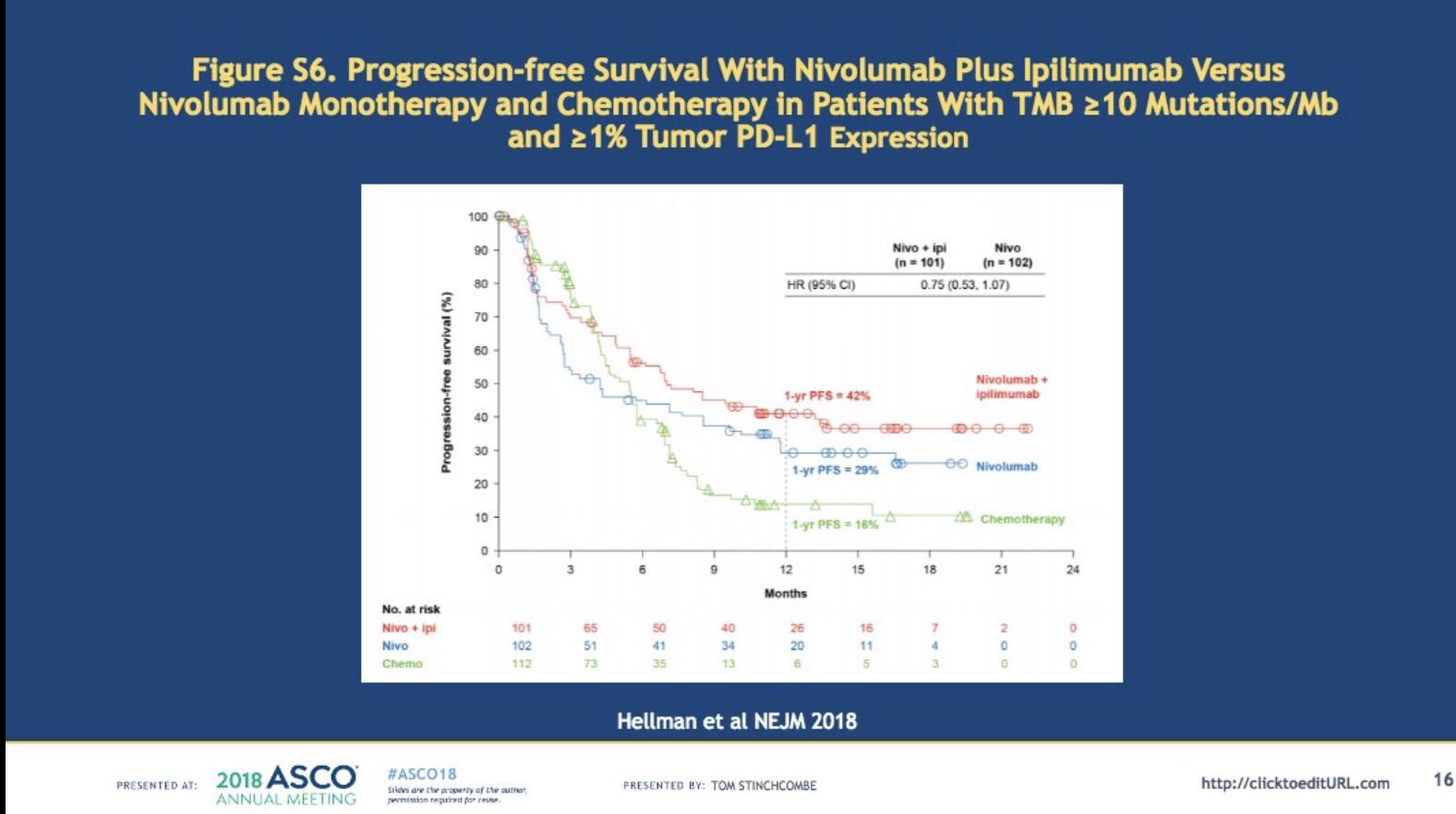
同样地,此次汇报的CheckMate227研究结果显示,三个治疗组在PD-L1低表达(< 1%)、TMB> 10 mut /Mb人群中的PFS获益分布与上述TMB< 10 mut /Mb人群中极为相似。应该注意到,此次分析仅纳入了129例PD-L1低表达(< 1%)、TMB> 10 mut /Mb的患者;对小样本的亚组人群的PFS数据得出“Nivolumab联合化疗优于单药化疗”的结论,我们仍需谨慎看待。
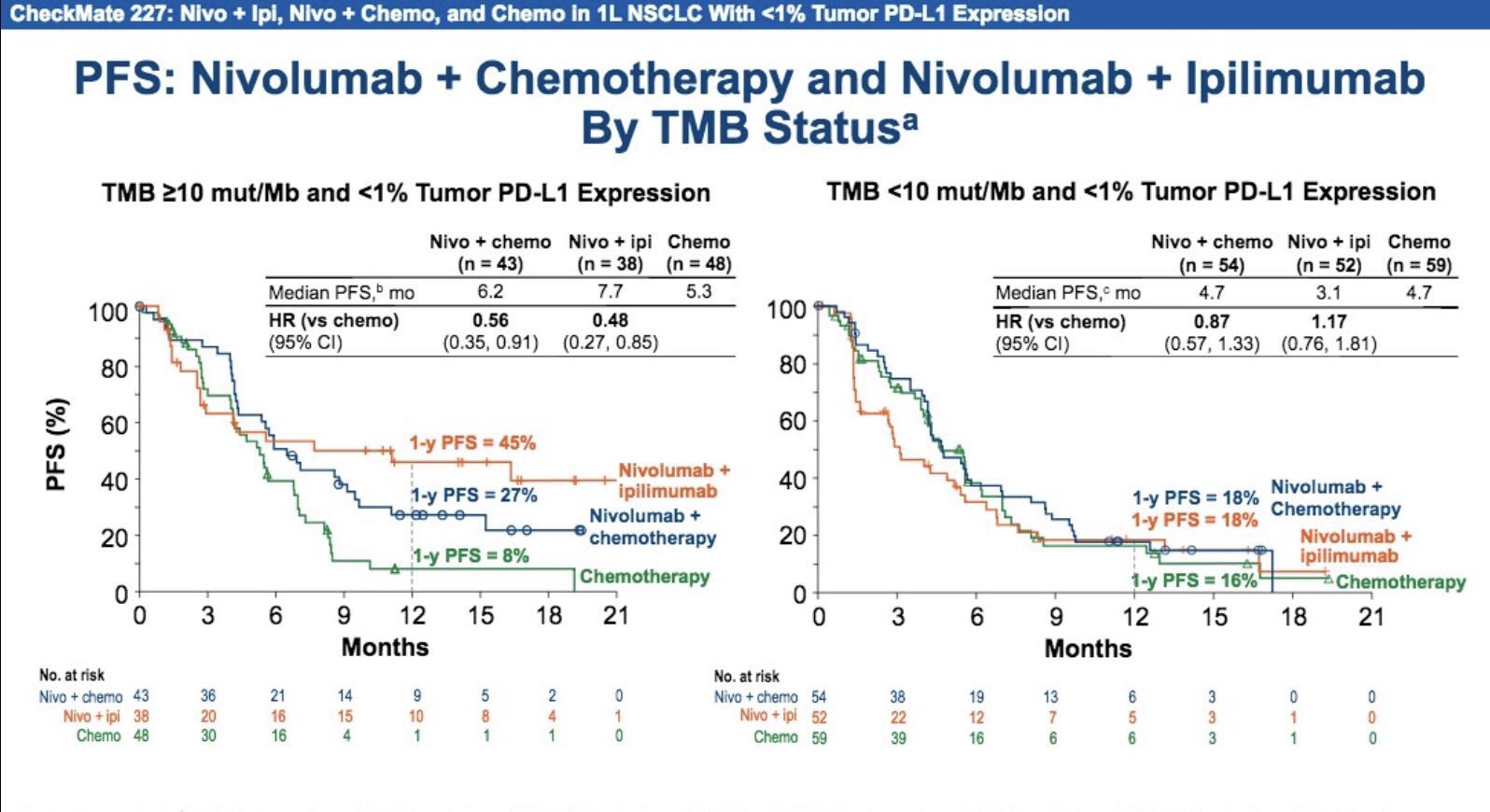
因此,仅凭目前公布的数据来看,这两项研究尚不足以撼动标准治疗方案的地位。IMPOWER 131研究仍需Atezolizumab联合卡铂和白蛋白结合型紫杉醇方案的最终OS获益数据。CheckMate 227研究的目前数据可以支持TMB> 10 mut /Mb作为生物标记物指导指导。但目前的问题在于,对于TMB> 10 mut /Mb的患者,选择化疗联合免疫治疗的数据支持不足,单药免疫或免疫联合治疗仍为较优选择。
 基于上述讨论,Tom Stinchcombe 教授不推荐帕博利珠单抗单药用于PD-L1表达低于50%的非鳞癌NSCLC患者。第二,TMB是较有前景的肿瘤标记物。对于PD-L1表达高于50%的患者,仍推荐使用帕博利珠单抗单药治疗;对于PD-L1表达水平在1 - 49%的患者,卡铂、培美曲塞、帕博利珠单抗仍是较优的选择。对于PD-L1低表达(< 1%)的患者,目前的标准治疗包括单药化疗、以及卡铂/培美曲塞或者帕博利珠单抗。我们尚未明确在高TMB的亚组患者中,化疗联合免疫治疗是否确实延长生存获益。但毫无疑问,在PD-L1低表达、TMB低的患者中,标准治疗仍为首选。目前,仍需期待III期临床试验的最终OS数据,为临床诊疗提供更多的证据支持。
基于上述讨论,Tom Stinchcombe 教授不推荐帕博利珠单抗单药用于PD-L1表达低于50%的非鳞癌NSCLC患者。第二,TMB是较有前景的肿瘤标记物。对于PD-L1表达高于50%的患者,仍推荐使用帕博利珠单抗单药治疗;对于PD-L1表达水平在1 - 49%的患者,卡铂、培美曲塞、帕博利珠单抗仍是较优的选择。对于PD-L1低表达(< 1%)的患者,目前的标准治疗包括单药化疗、以及卡铂/培美曲塞或者帕博利珠单抗。我们尚未明确在高TMB的亚组患者中,化疗联合免疫治疗是否确实延长生存获益。但毫无疑问,在PD-L1低表达、TMB低的患者中,标准治疗仍为首选。目前,仍需期待III期临床试验的最终OS数据,为临床诊疗提供更多的证据支持。


IMpower 131:Atezolizumab+卡铂+紫杉醇/白蛋白结合型紫杉醇一线治疗鳞状非小细胞肺癌随机III期研究的PFS及安全性初步数据分析(ABS:LBA9000)

背景
已经证实,与多西紫衫相比,Atezolizumab (atezo; anti–PD-L1) 二线治疗非小细胞肺癌可以获得OS优势,并且与PD-L1表达状态及肿瘤组织类型无关。由于细胞毒药物具有正向免疫调节作用,ATEZO联合化疗很有可能进一步改善临床结局。IMpower 131(NCT02266949)研究的目的是评价atezo + 卡铂(carbo) + 紫杉醇 (pac)或白蛋白结合型紫杉醇 (nab-pac) 一线治疗IV期鳞状非小细胞肺癌患者的疗效。
方法
患者按1:1:1随机分为A组(atezo 1200 mg q3w + carbo AUC 6 q3w + pac 200 mg/m2 q3w),B组(atezo + carbo + nab-pac 100 mg/m2 每周方案)或C组(carbo + nab-pac)。化疗4-6周期,atezo使用直到没有临床获益为止。本次公布研究者(INV)依据RECIST v1.1评估的B组及C组ITT人群初步PFS数据,数据截至2018年1月22日。
结果
A组338例,B组343例,C组340例患者纳入分析。最短随访时间9.8个月(mo)。INV评估的中位PFS,B组6.3mo,C组5.6mo(HR, 0.715; 95% CI: 0.603, 0.848; P = 0.0001)。所有免疫组化PD-L1阳性的患者均获益,尤其是TC3 或 IC3亚组。任何与治疗相关的不良反应(TRAEs)发生率,A组91.3%、B组94.6%、C组90.7%;3-4级TRAEs发生率,A组42.8%、B组68.0%、C组56.9%;严重TRAEs 发生率A组22.3%、B组20.4%、C组10.5%。初步OS数据将在会议公布。
结论
IMpower131经INV评估,在B组及C组的ITT人群中达到了的PFS初步研究终点。atezo + carbo + nab-pac / pac方案的安全性与方案中各药物的安全风险相一致,没有出现新的不良反应。临床研究信息:NCT 02367794
Nivolumab+含铂化疗对比化疗在PD-L1表达<1%晚期NSCLC一线治疗结果-CheckMate 227 (ABS 9001)

背景
CheckMate 227研究(NCT02477826)是一项针对晚期NSCLC一线治疗的大型、开放标签的III期临床研究,对比纳武利尤单抗nivolumab +伊匹木单抗ipilimumab (nivo+ipi),nivo或nivo+化疗对比化疗(chemo)的疗效。CheckMate 227研究达到了其共同的主要研究终点,即nivo + ipi对比化疗一线治疗显著延长了TMB ≥10 mut/Mb的NSCLC患者的PFS。但对于无预测生物标志物的人群受益的评价仍至关重要,前期研究证实在免疫基础上联合化疗可显著提高PD-L1高表达的未经选择人群的生存获益。本次报道该研究中PD-L1表达<1%的人群中nivo + chemo对比chemo的结果。
方法
既往没有接受过化疗、PD-L1 <1%、没有已知的EGFR/ALK敏感突变且组织学证实为IV期或复发的NSCLC患者(N=550)按1:1:1比例随机分配至nivo+ipi, nivo+chemo或chemo组。治疗方案为:nivo 3 mg/kg Q2W+ipi 1 mg/kg Q6W;nivo 240 mg Q2W;或nivo 360 mg Q3W+chemo。患者接受2年的治疗直至疾病进展或毒性不可耐受。探索性次要研究终点为PD-L1<1%人群中nivo+chemo对比chemo的PFS。此次分析不涉及检验水准(α)的分配。
结果
有基线特征在nivo+chemo(n = 177)和chemo(n = 186)两组中均衡分布。中位随访时间为11.5个月。在患者的最短随访时间达到11.2个月时,对比单纯chemo,nivo+chemo组的PFS有提升(HR = 0.74 [95% CI: 0.58, 0.94])。nivo+chemo治疗的各亚组也均观察到PFS的获益。尤其在以组织学分层的亚组中,接受nivo+chemo治疗非鳞癌患者的HR=0.68,而鳞癌患者的HR=0.92。由于任何相关不良事件引起的终止治疗比例在nivo+chemo组和chemo组分别为13%和14%。
结论
相比于单纯chemo,nivo + chemo的一线治疗可延长PD-L1表达<1%的NSCLC患者的PFS,且耐受良好。此次分析仅在PD-L1 <1%的人群中进行,结果令人鼓舞。CheckMate 227的第二部分:无论PD-L1表达状态,评价nivo + chemo 相对于chemo的疗效正在进行中。临床试验编号:NCT02477826。











 苏公网安备32059002004080号
苏公网安备32059002004080号


