今年ASCO的主题为“传递新知,拓展精准治疗版图”-“Delivering Discoveries: Expanding the Reach of Precision Medicine”。ASCO作为众多改变临床实践的重要研究成果的首发学术舞台,一直备受瞩目。【肿瘤资讯】带您一起聚焦6月3日的“晚期乳腺癌”专场,预先看下今年早期乳腺癌领域的热点研究。

Ribciclib与氟维司群联合使用显著延长患者PFS(ABS:1000)
背景
对于晚期内分泌患者,在内分泌“加法”时代,CDK4/6联合内分泌治疗的临床试验层出不穷。绝经后HR+HER2-晚期乳腺癌一线使用ribociclib联合来曲唑能显著延长患者的PFS。MONALEESA-3(NCT02422615)是一项随机、双盲、安慰剂对照的三期临床试验,入组患者确诊晚期乳腺癌后未行内分泌治疗或仅行一线内分泌治疗。
方法
入组HR+HER2-患者按2:1比例随机分为治疗组与安慰剂组,治疗组给予ribiciclib(600 mg/天;每三周停一周)联合氟维司群(500 mg),对照组给予安慰剂和氟维司群(500 mg)。主要研究终点为研究者评估的PFS,次要研究终点包括OS、ORR、CBR与安全指标。
共726名患者纳入研究,中位随访时间为20.4个月,已达到主要研究终点,PFS较对照组显著延长(HR: 0.593; 95% CI: 0.480–0.732; p = 4.10×10–7)。治疗组中位PFS为20.5个月(95% CI: 18.5–23.5个月),对照组中位PFS为12.8个月( 95% CI: 10.9–16.3个月)。在确诊后未行内分泌治疗亚组(HR: 0.577; 95% CI: 0.415–0.802)与已进行一线内分泌治疗亚组(HR 0.565; 95% CI: 0.428–0.744)中结果类似。在临床病灶可测量的患者中,ORR率从29%提高至41%( p = 0.003),CBR从60%提高至69% (p = 0.015)。不良反应整体发生率在30%以上,主要包括粒细胞缺乏症(70% vs 2%)、恶心(45% vs 28%)与疲劳(31% vs 33%)。尤其是3级/4级粒缺,治疗组发生率为47%/7%,对照组为0%/0%。粒缺导致的ALT升高及AST升高在治疗组与对照组中分别为7%/2% vs < 1%/0%与5%/1% vs 1%/0%。治疗后QTcF> 480 ms在治疗组中发生6%而对照组仅为3%。
Ribciclib与氟维司群的联合使用较安慰剂联合氟维司群显著延长患者的PFS,并且该联合用法的安全性在可控范围内。因此,Ribciclib联合氟维司群的治疗方案,不失为绝经后HR+HER2-晚期乳腺癌的一种选择。
CDK4/6抑制剂耐药的ctDNA基因图谱(ABS:1001)
背景
CDK4/6抑制剂联合内分泌治疗已逐渐成为晚期HR+HER2-晚期乳腺癌的标准治疗,CDK4/6抑制剂的耐药机制尽管临床数据有限,但在临床前的模型已有描述。研究者对PALOMA3研究中患者的ctDNA进行分析,以探究CDK4/6抑制剂方法的耐药机制
方法
PALOMA3研究是一项全球性大型临床研究,共纳入521例HR+/HER2-晚期乳腺癌患者,治疗组给予palbociclib联合氟维司群(P+F),对照组给予安慰剂联合氟维司群(F)。利用突变测序对193例治疗结束患者的血浆ctDNA进行配对纵向分析,同时在16例患者的高度纯化样本进行外显子ctDNA测序。
结果
共125例P+F治疗组与F对照组进行配对ctDNA分析,并以此分析整体研究人群了。RB1突变在P+F组治疗结束的患者中较F对照组的发生率极低(6/125, 4.8%, p = 0.041)。PI3KCA (p = 0.00018)和ESR1在治疗结束人群中出现了新的驱动性突变,特别是ESR1 Y537S突变(P=0.006),组间并没有突变频率的差异。驱动性基因突变在P+F治疗早期并不常见,但在治疗后期发生频率增高。16例外显子分析显示,P+F治疗组中克隆演化越频繁,治疗前后拷贝数分布保持一致。
结论
乳腺癌患者在P+F治疗组与F对照组治疗后的ctDNA基因图谱基本保持一致。治疗获得的PI3KCA及ESR1 Y537S突变可能是导致氟维司群耐药的原因。RB1突变在P+F组较少发生。这些发现可能为解决CDK4/6抑制剂联合氟维司群治疗的耐药机制提供重要依据。
Abemaciclib用于治疗绝经前/后HR+HER2-转移性乳腺癌的有效性及安全性(ABS:1002)
背景
Abemaciclib是CDK4/6抑制剂三剑客之一,被批准单药或联合氟维司群用于治疗HR+/HER2-转移性乳腺癌。在MONARCH-2研究的ITT人群中,abemaciclib联合氟维司群显著延长患者的PFS (16.4 vs 9.3 个月; HR,0.553;95% CI: 0.449- 0.681; p < 0.0000001)并显著提高了患者的ORR(48.1% vs 21.3%; p <0.001)。而本研究旨在比较abemaciclib联合氟维司群较安慰剂联合氟维司群在绝经前/后人群中的安全性及有效性。
方法
MONARCH-2是一项随机双盲安慰剂对照的III期临床研究,纳入HR+/HER2-内分泌耐药的转移性乳腺癌。该研究的纳入标准为:绝经前/围绝经/绝经后乳腺癌(绝经前/围绝经期患者使用GnRHa);HR+HER2-转移性乳腺癌;ECOG PS1; 内分泌辅助/新辅助治疗中进展,内分泌治疗结束后12个月内进展,或晚期乳腺癌仅使用一线内分泌治疗;内分泌治疗仅为一线治疗;确诊晚期乳腺癌后未行化疗。Abemaciclib口服给药,150mg bid,氟维司群 500mg,对照组给予安慰剂与氟维司群 500mg。主要研究终点为PFS,次要研究终点为ORR、CBR、疾病控制、安全性等。
结果
共114例患者按2:1随机化分为联合治疗组(N=72)与安慰剂组(N=42),随访观察到57例PFS事件,abemaciclib联合治疗组的中位PFS还未达到,对照组仅为10.5个月(HR, 0.446; 95% CI: 0.264, 0.754; p =0.002)。共79例病人有可测量病灶,ORR显著提高(p = .006),联合治疗组为60.8% (3.9% CR) ,对照组为28.6% (0% CR) 。不良事件主要为腹泻(87.3% vs 23.8%),粒缺(59.2% vs 7.1%)和白细胞减少(43.7% vs 4.8%)。
结论
Abemaciclib联合氟维司群(绝经前/围绝经联合GnRHa卵巢抑制)可令患者获得PFS及ORR的显著获益,且不良事件在可控范围内。因此,Abemaciclib联合氟维司群可作为绝经前/绝经后HR+HER-乳腺癌内分泌耐药后的治疗选择。
卡培他滨联合Utidelone治疗转移性乳腺癌的有效性及安全性(ABS:1003)
背景
埃博霉素类似物——Utidelone在II期及III期临床试验中均显示出优异的疗效,在此多中心III期临床试验中,比较了Utidelone联合卡培他滨对照卡培他滨单药化疗在曾接受紫衫类及蒽环类药物的转移性乳腺癌的疗效。
方法
本研究纳入405例患者,按2:1随机分为治疗组与对照组,治疗组(Utidelone 30 mg/m2/d d1~5 +卡培他滨 1000 mg/m2 bid d1~14),对照组(1250 mg/m2 bid d1~14)。共给药3周。ITT人群的OS、2年生存率和95%CI均使用Kaplan-Meier 进行双侧log-rank检验。
结果
随访至2018年3月9日,治疗组281例病人中180死亡(66.7%),对照组病人101例死亡(74.8%)。在ITT人群中,治疗组的总生存OS为14.75个月(95%CI 13.08-16.69),对照组的总生存OS为12.22个月(95%CI 11.14-14.26)。Utidelone联合用药显著提高了患者的总生存(HR 0.63;95% CI 0.45-0.88;p = 0.0047)。2年生存率联合组为39.0% (95% CI 33.2%, 45.1%),对照组为26.6% (19.4%, 35.0%),获得了约12.4% (1.9%- 22.4%;p = 0.015)的提高。周围神经病变是仅报告的3级不良事件,在Utidelone联合组发生率为25%,且该不良事件是可控且可逆的。值得注意的是,Utidelone引起非常轻微的骨髓抑制和肝脏毒性。Utidelone是第一个骨髓抑制不明显的微管抑制剂。
结论
该研究证明了Utidelone联合卡培他滨在曾接受紫衫类及蒽环类药物的转移性乳腺癌中的有效性及安全性。因此,其可作为转移性乳腺癌的一个临床选择。
Sacituzumab govitecan单药治疗HR+HER2-转移性乳腺癌的有效性及安全性(ABS:1004)
背景
Sacituzumab govitecan是一种单抗耦联药物,它是伊立替康的活性代谢产物SN-38与Trop-2(滋养层抗原-2,在上皮来源癌症中高表达)单抗耦合而组成的一种新药。I/II期篮式研究(NCT01631552)研究了该药物在晚期癌症患者中的活性,并已在晚期三阴性乳腺癌中有报道。
方法
入组患者给予Sacituzumab govitecan,10mg/kg,d1&8,21天一疗程,直至出现进展或严重不良事件。入组标准包括:给予一线及以上标准治疗的转移性乳腺癌,有 CT或MRI可评估的病灶。根据RECIST 1.1标准进行局部疗效评估,不良事件根据CTCAE V4.0标准进行评估。
54例病人入组此项临床试验,均为2015年2月~2017年6月的HR+HER2-转移性乳腺癌女性患者,平均年龄为54岁(33-79岁)。对于转移性疾病, 所有病人均接受2种以上治疗,这54例患者中位先后接受3种内分泌方案且中位接受过2种化疗方案。这其中包括了紫衫类药物治疗史(93%)、蒽环类药物治疗史(69%)、CDK4/6抑制剂(69%),其中,16例死亡,11例仍在治疗,所有患者均密切随访。中位给药次数为11次(1-74)。治疗多能耐受,无治疗相关性死亡。根据AE分级,3级以上不良事件发生率10%,多为粒缺和白细胞减少,另腹泻与粒缺性发热各一例。截止2017年12月31日,ORR率为31%(17/54),CBR率(疗效评价PR及SD>6个月)为48%。在接受过CDK4/6抑制剂的患者中,ORR为24%(9/37)。缓解时间及PFS等次要研究终点将在会议中汇报。
结论
Sacituzumab govitecan单药在HR+HER2-转移性乳腺癌能够诱导肿瘤客观缓解,同时安全性与耐受性较良好,具有进一步研究与应用的前景。
依维莫司联合依西美坦治疗ER+HER2-晚期乳腺癌有效性高于单药治疗(ABS:1005)
BOLERO-6 (NCT01783444)研究比较了依维莫司(EVE)联合依西美坦(EXE)较EVE单药治疗或卡培他滨单药化疗对ER+HER2-晚期乳腺癌的疗效。
方法
入组病人1:1:1随机化后分入EVE+EXE组,EVE组及卡培他滨组,依维莫司的用法为10 mg/day,依西美坦25 mg/day,卡培他滨1250 mg/m2 bid。主要研究终点为EVE+EXE组vs EVE组的PFS。次要研究终点为EVE+EXE组vs 卡培他滨组的PFS、初此外还有总生存OS及安全性评价。这并不是一个验证性研究因此不建立检验假设。
结果
309例患者入组BOLERO-6,EVE+EXE组104例,EVE组103例,卡培他滨组102例。基线水平基本保持一致。但卡培他滨组的患者较EVE+EXE组更年轻(68% vs 63% 年龄<65 岁),仅骨转移更多(24% vs 13%),更多高加索人种(89% vs 75%),同时内脏转移较少(62% vs 66%),3处以上转移灶者较少(44% vs 50%)。中位随访时间为37.6个月。EVE+EXE组的PFS较EVE组有所延长(HR,0.74;90% CI,0.57–0.97),而EVE+EXE组的PFS较卡培他滨组略缩短,未形成显著差异(HR,1.26,90% CI,0.96–1.66)。在进行基线因素匹配后cox回归现实EVE+EXE组较卡培他滨组的HR接近为1(HR,1.15,90% CI,0.86–1.52)。卡培他滨组患者的删失较多,约有20%的病人在治疗中选择更换治疗方案。EVB+EXE组的中位OS为23.1个月,EVE组为29.3个月(HR 1.27; 90% CI 0.95–1.70),卡培他滨组25.6个月(HR 1.33; 90% CI 0.99–1.79)。3/4级不良事件以卡培他滨组最为常见,严重的不良事件多见于EVE+EXE组。
结论
依维莫司与依西美坦联合用药较单药依维莫司可使患者的PFS显著获益。另外,虽然在依维莫司在与卡培他滨相比时未具备优势,但这与基线失衡与信息删失有关。该联合用法在有效性及安全性上均应获得认可。
AZD5363联合紫杉一线治疗转移性三阴性乳腺癌的可能性(ABS:1007)
背景
PI3K/AKT信号通路在三阴性乳腺癌中常常被激活,AZD5363是一类高度选择性的口服小分子AKT抑制剂,PAKT研究试验了将AZD5363联合紫杉醇作为三阴性乳腺癌一线化疗方案的可能性。
方法
这项随机双盲安慰剂对照的II期研究,招募了来自6个国家42个地区的未经治疗的晚期乳腺癌患者。患者随机化后按1:1分入AZD5363联合紫杉醇组与安慰剂联合紫杉醇组,紫杉醇90mg/m2 (d1, 8, & 15),AZD5363 (400mg BD),安慰剂(d 2-5, 9-12, 16-19),28天为一疗程,直至出现进展或不可耐受的毒性。主要研究终点为PFS, 次要研究终点包括OS,PI3KCA/AKT1/PTEN突变亚组的PFS,缓解率和安全性。
结果
本研究纳入2015年5月-2017年6月晚期乳腺癌患者共140名,AZD5363联合组70例,对照组70例。中位随访时间为18.2个月(95% CI, 13.6 to 24.0)。在ITT人群中,AZD5363联合组中位PFS为5.9个月,安慰剂组为4.2个月(HR, 0.75; 95% CI, 0.52 - 1.08;单侧检验 p = 0.06; 双侧检验 p = 0.11)。AZD5363联合组中位OS为19.1个月,安慰剂组为12.6个月(HR, 0.64; 95% CI, 0.40- 1.01; 单侧检验p = 0.02; 双侧检验p = 0.04)。PI3KCA/AKT1/PTEN亚组分析将于会议上进行展示。在不良反应方面,较常见的3级及以上不良反应包括腹泻(AZD5363联合组12% [8/68] vs 安慰剂组1% [1/70])、感染(4% vs 1%)、粒缺(3% vs 3%)、皮疹(4% vs 0)、疲劳(4% vs 0)。
该PAKT研究达到主要临床终点,AZD5363联合紫杉醇可较紫杉醇单药达到更长的PFS和OS,其有效性及安全性在II期试验得到认可,但仍需进一步研究。
ipatasertib联合紫杉醇一线治疗局部晚期/晚期三阴性乳腺癌的LOTUS研究OS数据更新(ABS:1008)
背景
LOTUS (NCT02162719)研究是一项多中心、随机、双盲、安慰剂对照的2期研究,将口服AKT抑制剂IPAT联合紫杉醇作为转移性三阴性乳腺癌的一线治疗,已发表的PFS显示出该药物的显著优势,ITT人群中,ipatasertib组中为PFS为6.2个月、安慰剂组4.9个月(HR,0.60;95% CI,0.37–0.98; p = 0.037)。z在PIK3CA/AKT1/PTEN突变的患者中,ipatasertib组的中位PFS为9.0个月、安慰剂组中位PFS为4.9个月(HR,0.44 ;95% CI, 0.20–0.99)。现发表OS随访结果。
方法
本研究纳入患者为肿瘤病灶可测量的未经手术及全身治疗的转移性三阴性乳腺癌患者,分层因素包括辅助/新辅助化疗、距前次化疗的间隔时间(6-12个月vs 12个月 vs 未行化疗)、肿瘤免疫组化PTEN表达,并随机区组1:1入联合治疗组与安慰剂组,联合治疗组给予紫杉醇80 mg/m2 (d1, 8, & 15)联合IPAT 400 mg,安慰剂组给予紫杉醇80 mg/m2 (d1, 8, & 15)联合PBO (d1–21)直到肿瘤进展或产生不可耐受的毒性。OS为预先设定的次要研究终点。
结果
具体如下图所示。IPAT+PAC联合组中位OS 23.1个月(18.6-28.1),安慰剂组中位OS 18.4个月(15.1-29.1)。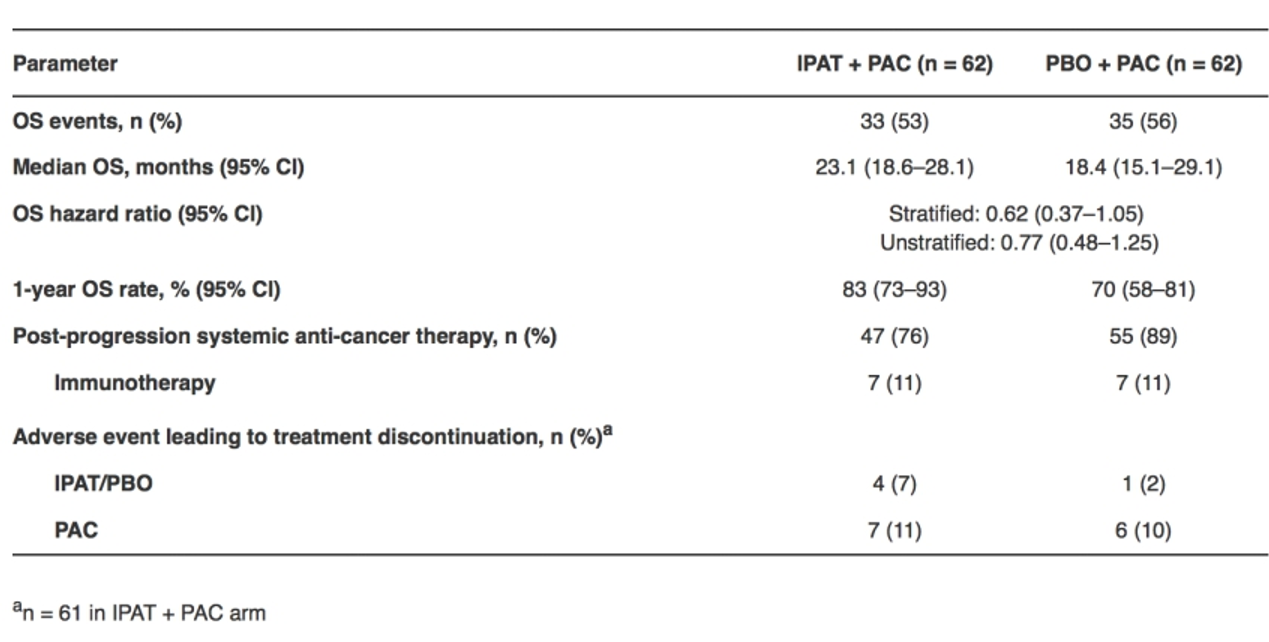
结论
在PFS达到终点后的OS随访进一步说明了IPAT对转移性三阴性乳腺癌的整体获益,这些研究进一步支持一线IPAT联合紫杉醇在IPATunity130 (NCT03337724)III期临床试验的开展。
LBA(Late-Breaking Abstract)摘要将在会议期间公布,【肿瘤资讯】记者会亲赴会议现场,第一时间为您传递现场之声,敬请期待!
LBA1006
Phase III study of taselisib (GDC-0032) + fulvestrant (FULV) v FULV in patients (pts) with estrogen receptor (ER)-positive, PIK3CA-mutant (MUT), locally advanced or metastatic breast cancer (MBC): Primary analysis from SANDPIPER.
温馨提示
晚期乳腺癌专场
时间:当地时间 6月3日 8:00 AM - 11:00 AM
地点:Hall D2
http://abstracts.asco.org/214/AbstView_214_218409.html
http://abstracts.asco.org/214/AbstView_214_218315.html
http://abstracts.asco.org/214/AbstView_214_213753.html
http://abstracts.asco.org/214/AbstView_214_223479.html
http://abstracts.asco.org/214/AbstView_214_221663.html
http://abstracts.asco.org/214/AbstView_214_212871.html
http://abstracts.asco.org/214/AbstView_214_217073.html
http://abstracts.asco.org/214/AbstView_214_217105.html
版权声明











 苏公网安备32059002004080号
苏公网安备32059002004080号


