2018年Association of American Cancer Research(AACR)一改往日教育和基础研究的主题会议,引入临床研究的元素并加重了其分量,2018年4月16号不断公布热点免疫研究的重磅数据,同时,多篇研究当日online发表于New England Journal of Medicine,彰显其对癌症临床诊疗的重视。


医学科学院肿瘤医院肿瘤内科
主任医师,教授,博士生导师
国家杰出青年基金获得者
中国抗癌协会肺癌专业委员会常委
北京医学会肿瘤分会副主任委员
中华结核与呼吸杂志、中国肺癌杂志Lung Cancer、Clin. Lung Cancer编委
国家百千万人才工程入选者、获中国突出贡献中青年专家称号
国务院政府特殊津贴获得者
一线免疫联合治疗 免疫联合化疗:Keyn
免疫联合化疗:Keynote 189
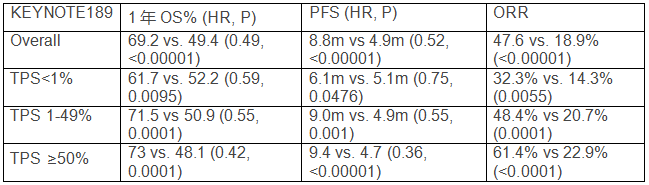
基于Keynote 021G研究一线亚组的研究数据,即pembrolizumab联合培美曲塞+铂类化疗对比化疗组显著胜出的PFS(13.0 vs. 8.9 个月)和1年OS率(77% vs. 69%, HR=0.59)。默沙东开展了III期前瞻性验证研究Keynote189,入组人群为初治的IV期无驱动基因变异的非鳞非小细胞肺癌,2:1随机分为两组:A (410例):帕博利珠单抗(Pembrolizumab)+培美曲塞+卡铂/顺铂4周期后,帕博利珠单抗维持最多至31周期,培美曲塞维持至疾病进展;B (206例):安慰剂+培美曲塞+卡铂/顺铂4周期后,安慰剂维持最多至31周期,培美曲塞维持至疾病进展。主要研究终点为OS及PFS。目前帕博利珠单抗组中位OS仍未达到,对照组为11.3个月;无论从1年OS率,PFS及ORR,联合组均显著胜出。根据TPS评分的分层可以看到TPS ≥50%数据最佳(表1),与Keynote 021G研究的结果相比, 1年OS率均达到了预期结果(69.2% vs. 77%)而PFS却明显缩短(8.8m vs. 13.0m),但由于021G研究为2期小样本研究20%左右的差异并不足以为奇,这正是需要III期临床研究验证的原因。针对TPS ≥50%人群,对比Keynote 024研究,二者ORR (61.4% VS. 44.8%)和1年OS率(73.0% vs. 70.3%)具有可比性。
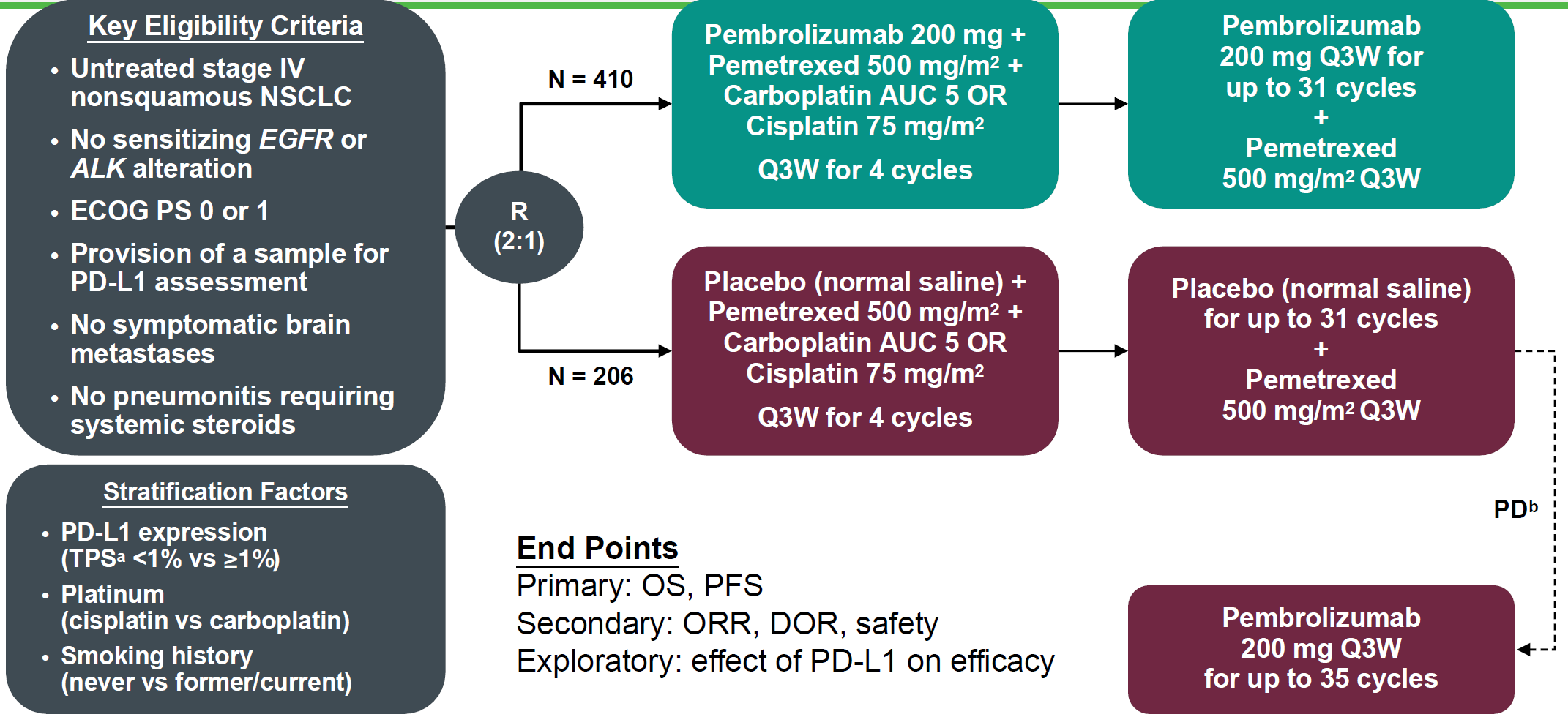
图1:Keynote189实验设计
重要提示
1. 一线帕博利珠单抗联合培美曲塞+铂类方案应为无驱动基因变异的非鳞NSCLC新的标准治疗方案
2. PD-L1仍为目前临床可参考的分子标志物,TPS 1-49%部分患者应为帕博利珠单抗联合化疗的首选获益人群
3. PD-L1 PS ≥50%的患者或许单药帕博利珠单抗一线治疗或许应优选
不足之处
1. 未考虑其他可能的分子标志物如TMB
2. 联合的方式应不止于免疫治疗与化疗的同时应用,未来免疫与化疗的序贯方式仍是可探索的方向。
免疫联合免疫:CheckMate 227
CheckMate 227为nivolumab联合低剂量ipilimumab一线 治疗晚期非小细胞肺癌(NSCLC)的免疫联合免疫的临床研究。
该研究共分为下列3个部分:
1a部分:在PD-L1表达的肿瘤患者中,评估与化疗相比,nivolumab联合低剂量ipilimumab以及nivolumab单药治疗的疗效和安全性
1b部分:在不表达PD-L1状态的肿瘤患者中,评估与化疗相比,nivolumab联合低剂量ipilimumab,以及nivolumab联合化疗的疗效和安全性
第2部分:在不考虑PD-L1或TMB状态的广泛患者群中比较nivolumab联合化疗对比化疗的疗效和安全性
第一部分主要研究终点:1、具有PD-L1表达的肿瘤患者的OS(在1a部分评估),2、高TMB(TMB ≥10个突变/mb,无论PD-L1表达情况如何)患者的PFS(在1a和1b部分评估)。第二部分的主要终点是OS。
在研究第一部分,患者被随机(1:1:1)分为三组:nivolumab(3 mg/kg每2周给药)联合低剂量ipilimumab(1 mg/kg,每6周给药)组;含铂双药化疗组(每3周,总共不超过4个周期);nivolumab 240 mg (每2周,1a部分)或nivolumab 360 mg联合含铂双药化疗(每3周,总共不超过4个周期)加nivolumab单药维持治疗组(1b部分)。
在第一部分所有随机的患者(N=1,739)中,1,004例(58%)具有有效的TMB数据可供疗效分析。其中约有44%为TMB高表达(≥10个突变/mb)。TMB表达与PD-L1表达相互独立。在299名TMB高表达的患者中,139人接受nivolumab + ipilimumab联合治疗,160人接受化疗。TMB采用Foundation Medicine的FoundationOne CDx进行检测,高表达定义为TMB≥10个突变/mb。
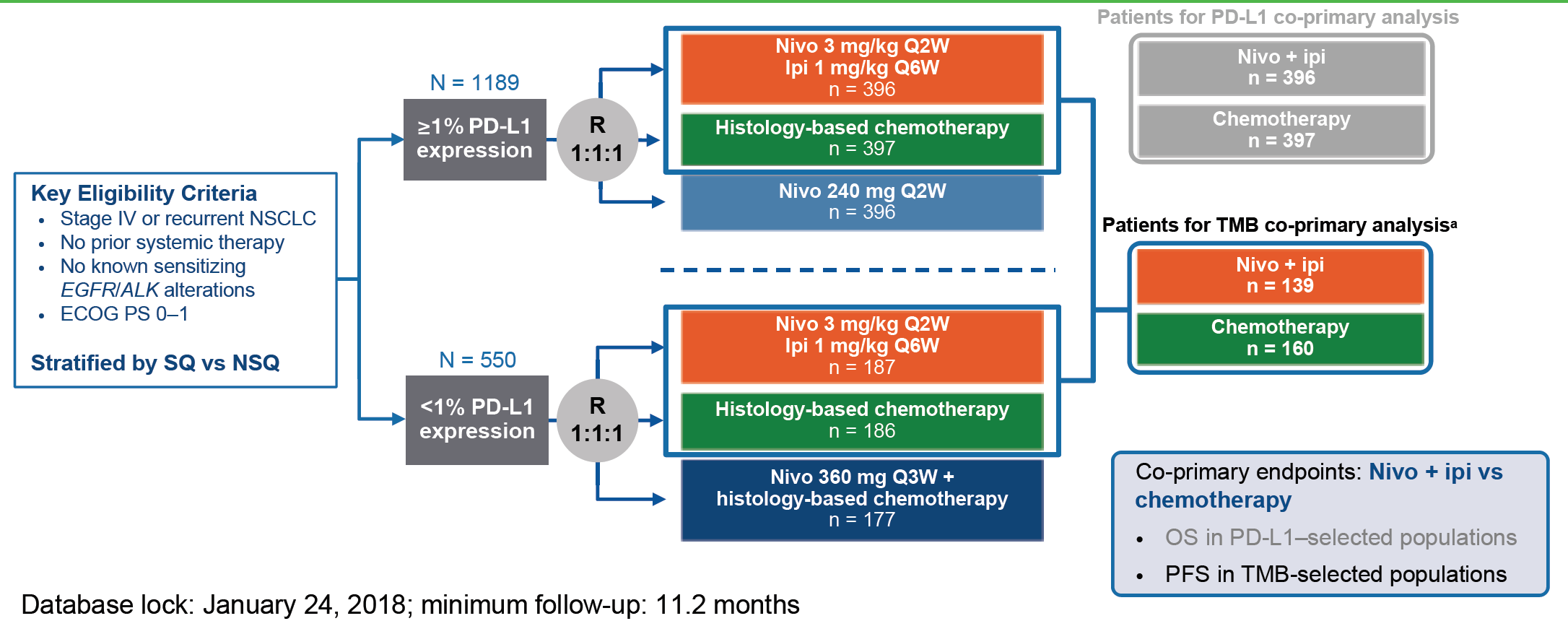
图2:CheckMate 227实验设计
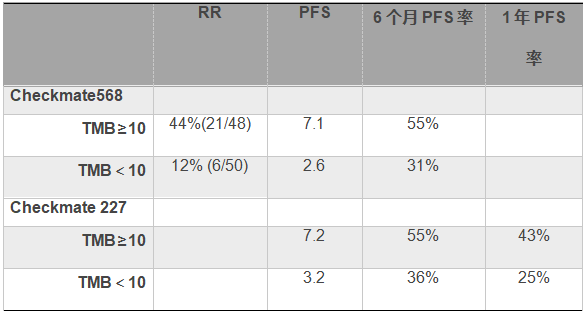
基于CheckMate 026和CheckMate 568研究的数据,肿瘤突变负荷(TMB)被认为是独立于免疫表型之外的有潜力的分子标志物,鉴于此,CheckMate 227的最大亮点在于评估了TMB在免疫联合治疗中的分子标志物作用。在谈及227的研究结果之前,我们应该首先了解与该研究同场汇报的CheckMate 568的II期临床研究,纳入的亦为初治IV期或IIIB期复发的NSCLC,无驱动基因变异,无PD-L1表达要求。单臂给予联合方案nivolumab (3 mg/kg,每2周)+低剂量ipilimumab (1 mg/kg,每6周)。主要研究终点为PD-1≥1%或<1%的ORR。该研究首先采用FoundationOne CDxTM二代测序技术,选择324基因的panel评估TMB(去除胚系突变后≥5%等位基因频率的同义及非同义变异)。采用受试者工作特征曲线(ROC)曲线来确定TMB的界值为 10 个突变/mb,当TMB<10个突变/mb时随着TMB的升高ORR随之升高,当TMB≥10个突变/mb之后ORR进入平台期(AUC=0.73)。该研究分析结果同时发现PD-L1表达与TMB值之间无相关性。进一步的结果提示TMB≥10个突变/mb的患者无论RR,PFS及6个月和1年PFS率均优于TMB<10个突变/mb的患者。并在CheckMate 227中得到了证实。
CheckMate 227研究免疫联合组和化疗组的1年PFS分别为43%和13%,ORR分别45.3%和26.9%,且免疫联合治疗的CR率达3.6%。同时,TMB≥10个突变/mb的患者无论RR(45.3% vs. 26.9%),DOR (NR vs. 5.4m),PFS (PD-L1 ≥1% 7.1 vs. 5.5m; PD-L1<1% 7.7 vs. 5.3) 或OS (23.0 vs. 16.4)均优于化疗组。
表2:CheckMate 568和CheckMate 227的研究结果
重要提示
1. 进一步验证TMB可能是独立于PD-L1表达之外成为一个补充的预测免疫治疗疗效的分子标志物
2. nivolumab和ipillimumab联合在高TMB EGFR/ALK阴性的NSCLC患者中可作为一线治疗选择
3. nivolumab和ipillimumab低剂量联合的毒副反应可耐受
不足之处
1. TMB作为分子标志物并非是该研究设计的分层因素,尚需前瞻性研究的证实
2. CheckMate 026研究中对比Foundation One Panel与全外显子组检测的不一致性仍有9%
3. TMB检测需要普通分子检测10倍的DNA含量,增加临床实践中的检测难度
4. OS数据不成熟
IMpower150研究是一项随机对照III期临床试验,纳入初治非鳞癌晚期NSCLC,研究主要终点为ITT-WT(EGFR或ALK野生型患者)人群中的PFS,次要研究终点为在肿瘤细胞(TC)和具有SP142的肿瘤浸润免疫细胞(IC)上通过PD-L1表达定义的亚组中的PFS,对SP263预设了探索性回顾性分析。
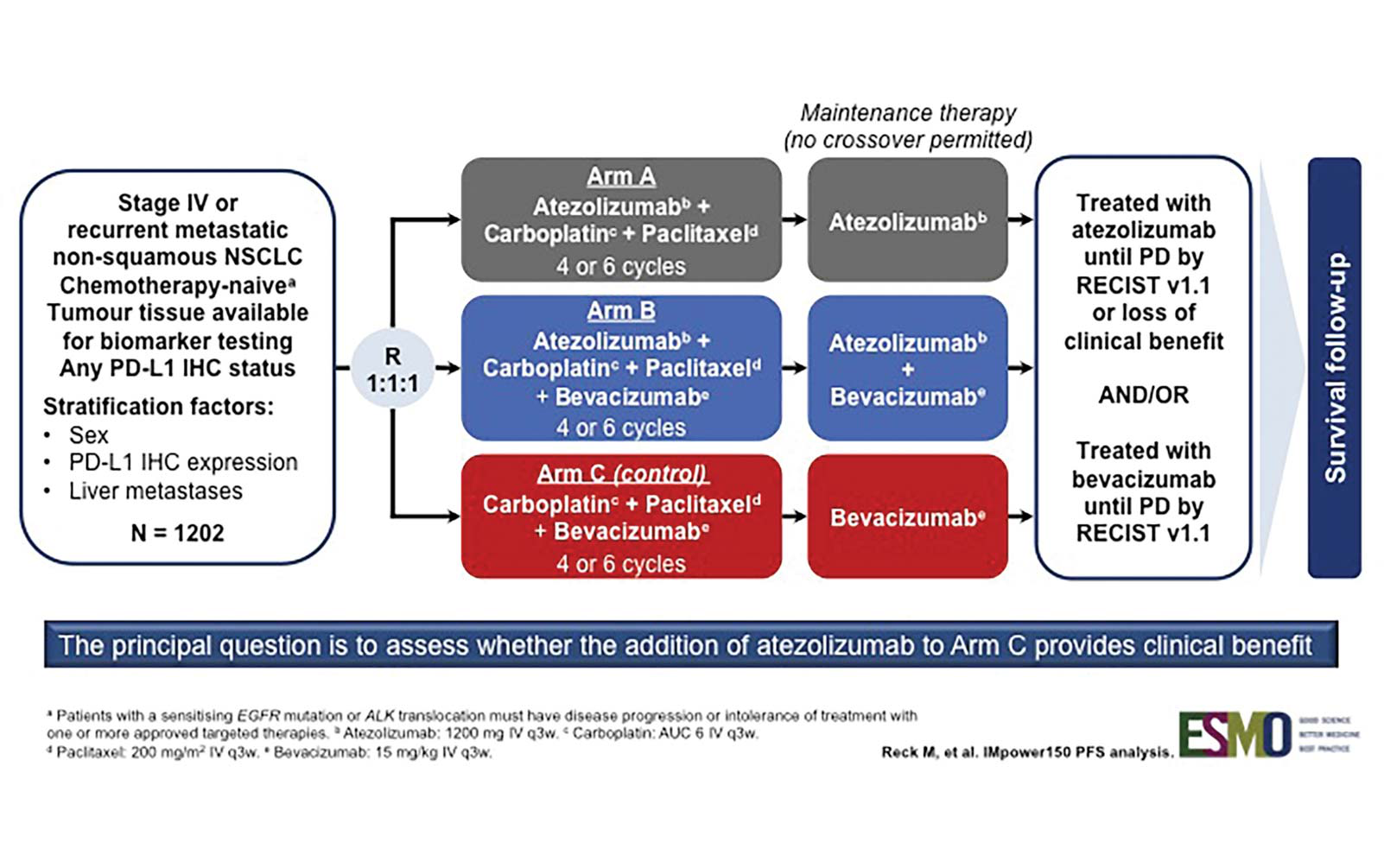
图3:IMPOWER150研究设计
结果显示与化疗联合贝伐珠单抗相比(ARM C),Atezolizumab与化疗和贝伐珠单抗(ARM B) 显著延长PFS(8.3 vs. 6.8m HR0.62, p<0.0001);该研究本次汇报最重要的数据为四药联合中关键亚组的疗效:EGFR/ALK基因变异患者,基线肝转移患者,及SP142和SP263 IHC分别检测PD-L1表达的亚组。
在ITT-WT的B组和C组(n=692)中,503名患者有可用于SP263检测(BEP)的肿瘤切片。ITT-WT和BEP中的患者特征相似。整体ITT人群中PFS联合组较对照组显著延长(8.3 vs. 6.8m, HR 0.62)。在两种检测法定义的所有PD-L1表达亚组中,均观察到B组对C组PFS获益相似,包括PD-L1阴性和PD-L1-低表达的患者。同时EGFR或ALK驱动基因阳性的患者中也观察到B组对比C组的PFS获益(9.7 vs. 6.1m, HR 0.59) ,甚至EGFR19/21突变的患者获益更多(10.2 vs 6.1, HR 0.41)。另外,基线肝转移的患者亦可从四药联合中得到PFS获益(8.2 vs. 5.4m,HR 0.40)。
重要提示
1. 初治非鳞晚期NSCLC无论PD-L1的表达均可从atezolizumab联合贝伐珠单抗及化疗中获益
2. EGFR及ALK驱动基因阳性的非鳞NSCLC亦可从免疫治疗的一线中获益
3. 基线肝转移的患者亦可从atezolizumab一线联合化疗中获益
不足之处
1. A组无数据提供;
2. 6例患者同时EGFR突变及ALK融合基因;26例EGFR敏感突变同时伴有其它EGFR突变,是否有假阳性之疑;
3. 有限的PFS获益加上经济效益及毒副反应的权重是否得不偿失?
二线免疫数据:CheckMate 078
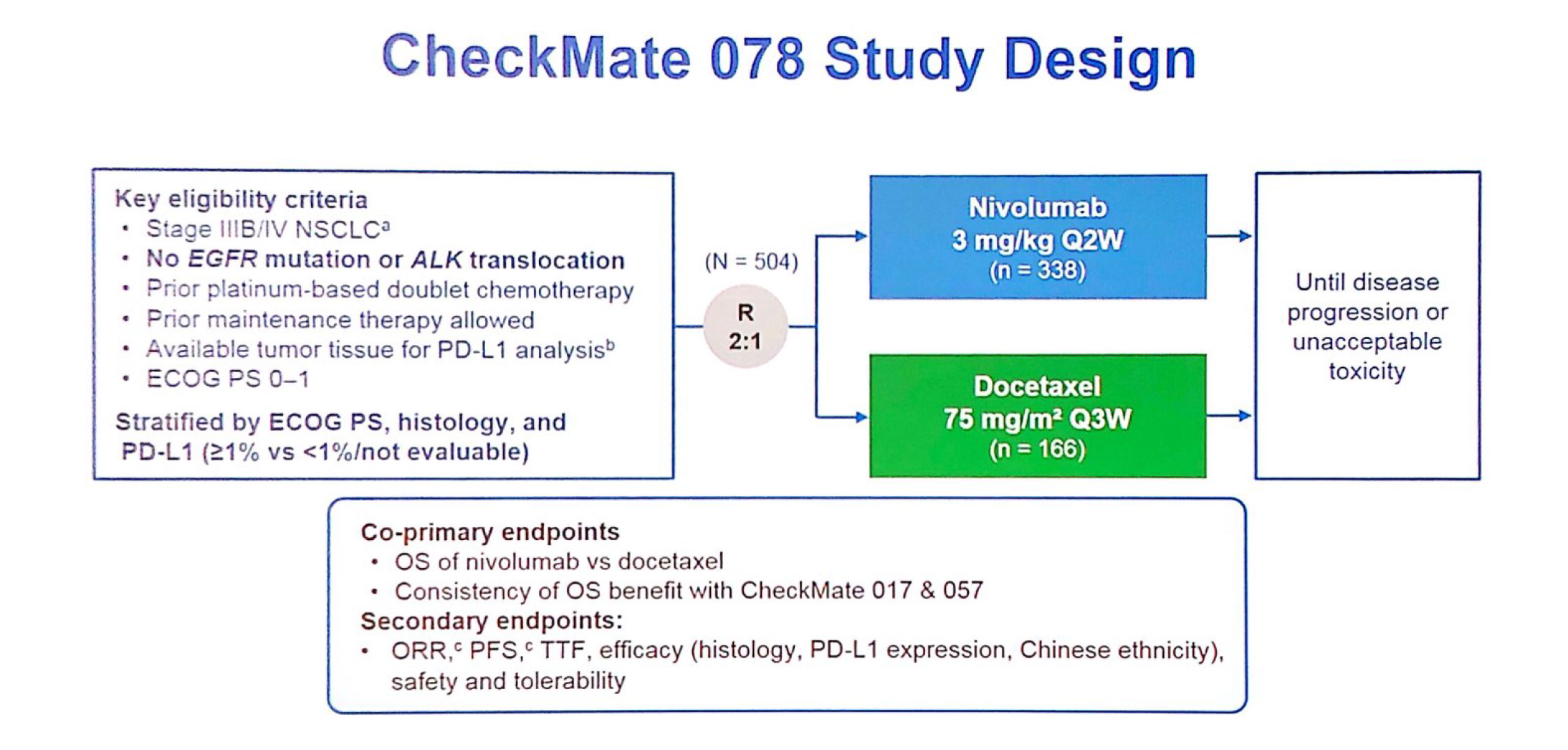
图4:CheckMate 078研究设计
CheckMate 078是第一个针对东亚人群的多中心、随机III期研究,旨在评估含铂双药化疗治疗后疾病进展的IIIb/IV期非小细胞肺癌(NSCLC)患者中比较nivolumab与多西他赛的疗效和安全性。该研究主要选择在中国(n=451)进行,同时入组少量俄罗斯(n=45)和新加坡(n=8)患者。共入组504例,2:1随机分入nivolumab组或多西他赛组。分层因素包括PD-L1表达(<1% 或≥1%)及病理学类型。主要终点总生存期(OS)。次要终点ORR及PFS等。
结果提示,与多西他赛相比nivolumab显著延长了患者的OS(HR 0.68;97.7% CI:0.52-0.90;p=0.0006)。不同PD-L1表达水平及肿瘤组织学类型的患者均观察到OS获益。同样,nivolumab组的PFS对比化疗也显著获益(HR 0.77;95% CI:0.62~ 0.95;p=0.0147)。这种获益在鳞癌和非鳞癌中均可观察到。与既往西方人群中的CheckMate 017和057结果一致。
重要提示
1. CheckMate 078研究和CheckMate 017/057研究的数据基本一致;
2. 前瞻性的把PD-L1表达作为分层因素,减少了统计学上的偏倚;
3. nivolumab可作为驱动基因阴性的中国NSCLC患者中二线标准治疗;
4. 在中国人群中nivolumab对鳞癌的治疗效果更佳。











 苏公网安备32059002004080号
苏公网安备32059002004080号


