沈志祥教授MDS会诊直播至今播出2期,好评如潮。11月15日早上8:30,我们将再次携手血液系统肿瘤大咖专家沈志祥教授,为各地的医生进行MDS疑难病例的会诊,解决患者心中疑虑!
骨髓增生异常综合征(MDS)在我国非常普遍,但其诊治目前仍在发展阶段,尚未形成成熟的标准。来看沈志祥教授如何指导疑难病例!精彩的病例会诊直播回放,精彩不容错过!

上海交通大学附属瑞金医院血液内科临床医学中心主任医师;
中华医学会血液分会前任主委;
担任《中华血液学杂志》、《中国新药与临床》、《肿瘤杂志》、《中华内科杂志(英文版)》等杂志编委;
享受国务院特殊津贴;
主编《血液肿瘤学》、《血液病学研究进展》、《恶性淋巴瘤》。
多次获得国家自然科学基金和卫生部科研基金。
会议日程安排
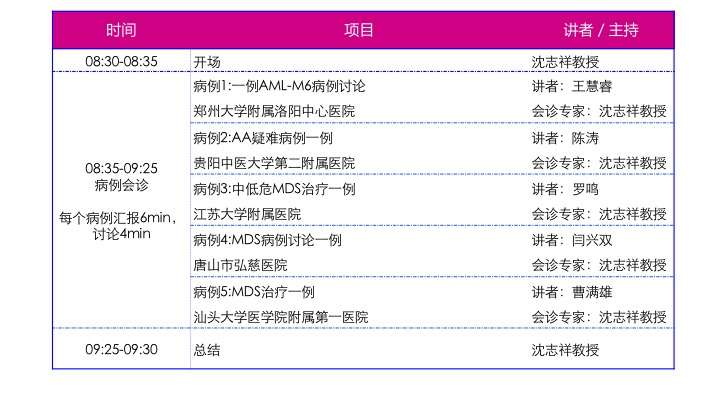
会诊病例1
病例提供:王慧睿 郑州大学附属洛阳中心医院
病例描述:
患者:男,70岁。
入院情况:因乏力、胸闷以“冠心病”入心内科,查血常规:WBC 2.22×10^9/L,HGB 67g/L,PLT 21×10^9/L,转入血液科。
查体:贫血貌,余未见明显阳性体征。
骨髓涂片:原始粒细胞占10.8%,早幼粒细胞2.4%,偶见巨样变和巨大单、双核或多核原始早幼粒细胞;红系增生异常,占50.8%,原+早幼红细胞占20.8%,幼红可见巨样变,可见巨大双核、多核幼红细胞,部分中红胞浆量少,边缘可见瘤状或长棘突状突起。
流式细胞学检查:原幼细胞(B门)占全部红系有核细胞15.3%,高表达CD34、CD117、CD34、CD38、HLA-DR、CD36、CD58、CD71、cMPO,部分表达CD13、CD33,提示为异常早期髓系细胞;粒细胞(C门)占41.3%,21.8%细胞表达CD34,16.1%细胞表达CD117,19.1%细胞表达HLA-DR,表型异常。
染色体:复杂核型。
基因筛查:髓系16项融合基因筛查全阴性。
专家诊断:
患者诊断为AML-M6没有问题,主要依据为:一是患者有少量原始细胞;二是患者红系发育异常。地西他滨治疗后效果很好,原始细胞下降了,三系减少慢慢好转。但问题是,地西他滨进行到第9个疗程以后,患者无法承受。地西他滨做临床研究时也规定免费送药9-11个疗程,到第11个疗程以后,能承受的患者很少。
检查中发现WT1数值升高,但WT1数值升高意义不大。为什么?理论上WT1升高要有两个对数级,但患者WT1数值的升高在同一水平上。需要注意的是原始细胞达到9%,说明病情复发了。
我院地西他滨的临床研究治疗到第11个疗程,暂且有2个患者获得不错的效果,但一年后病情都复发了。此患者年纪大,不但骨髓异常复发,而且无法承受继续治疗,这种情况下步建议继续用地西他滨。
治疗方案:
对于这个患者的治疗,我目前有2个治疗方案:
第一:更改其它小剂量的预激治疗,并且需要非常谨慎!骨髓已经4度抑制,即使是小剂量的预激也需要谨慎,一定要提前与患者家属沟通,避免造成无可挽回的情况;
第二:患者目前原始细胞数值是9%,还未达到百分之十几,此时需要评估化疗的必要性。化疗可能对患者有好处,也有可能会对骨髓进一步抑制,导致感染死亡,血小板减少也会导致死亡。但如果不用化疗,也会产生问题,建议换成喜滴克加上砷剂来治疗。之前患者是用阿糖胞苷,喜滴克针对低中危的病人。患者目前原始细胞是9%,下次可能就是12%了。目前最主要的问题是患者能否忍受化疗,如果不能,建议可以联用小剂量的砷剂加喜滴克,观察效果。
另外,建议患者用药一个疗程后,再做骨穿观察原始细胞数值是否上升。如果上升,会很难治疗。什么原因呢?患者一来年龄大、二来发生骨髓抑制、再者原始细胞增多,这3个因素互相制衡,影响治疗效果。
那么,用阿扎胞苷是否可以?阿扎胞苷明年年初就会上市。但其会产生骨髓抑制,所以在剂量上需要特别注意。该患者化疗半年以后,出现4度骨髓抑制,说明患者的骨髓功能是非常差。可先用小剂量的砷剂、沙利度胺加上喜滴克综合治疗,但不保证一定会有效果。小剂量砷剂5mg、喜滴克200ml联用,连续打14天;或者先用喜滴克再用砷剂,半个月;再次先用喜滴克后用砷剂,半个月,两者的副作用都比较轻。
会诊病例2
陈涛,贵阳中医大学第二附属医院
病例描述:
患者:女,31岁
主诉:反复乏力9+月,加重2天
现病史:9+月前患者无明显诱因出现乏力,阴道出血,就诊于“贵州省人民医院”
查血常规示:血小板低(12×10^9/L)
治疗经过:
1.经过多部位骨髓穿刺+骨髓活检(均提示造血增生低下),考虑为“再生障碍性贫血”,予输血、输注血小板等相关治疗后症状好转出院。
2.后患者就诊于“重庆西南医院”,骨髓常规示:骨髓增生低下,全片未见巨核细胞;骨髓活检示:骨质较多,少量造血组织,建议多部位穿刺。再次明确诊断为“再生障碍性贫血”。
3.予 “白介素-11 皮下注射、环孢素A 75mg po bid、司坦唑醇1# po tid”,治疗后症状未见明显改善
4.4+月前患者再次出现上述症状加重,乏力,时感头晕,阴道出血,量多,再次就诊于“重庆西南医院”,予输注血小板等对症治疗后,症状改善。
5.3+月前患者于“贵州省中草药医院”口服中药治疗,自行停用“环孢素、司坦唑醇”治疗。此后患者病情呈进行性加重,先后六次于我院住院输血、输注血小板治疗。
6.基因检测:RUNX1基因突变
专家诊断:
患者做了多次骨穿,同时也做了活检。西南医院的活检报告显示有非造血细胞、肥大细胞和浆细胞,而涂片无其他非造血细胞。鉴别骨髓增生异常和再障的两个不同诊断,一是造血的成分是否有明显下降;二是是否有其他的非造血细胞。
从后面做的骨穿结果来看形态异常并不是非常明显。目前患者骨髓增生低下,基因检测RUNX1表达阳性。从MDS角度来诊断,三系减少其他原因无法解释,患者也不存在病态造血,但患者RUNX1基因表达阳性。是否有基因表达就可以否定患者再障呢?答案是不一定的。从目前来看,也不能完全排除低增生性的MDS。但这两者早期的治疗方案差不多,都可用免疫抑制治疗。
患者用了环孢素,但是环孢素的疗效由于规范化等问题,疗效还未体现出来。如果可以的话,也可以用ATG,因为还有一个染色体的报告未出,除非有新的像 5q-、7q-、20号染色体异常、+8等典型MDS异常,可以做低增生性的MDS诊断。
治疗方案:
由于这个病人的免疫调节没有5q-,所以用来那度胺也不是很合适,并且来那度胺对早期的细胞是有抑制的。个人意见是除了环孢素和ATG外,也可以考虑使用喜滴克。喜滴克相对比较安全,没有其它副反应,如若患者是低危的、包括再障或MDS类型,喜滴克也无反指症。
所以这个病人我觉得可以考虑用喜滴克,环孢素再坚持使用,观察患者的反应对症处理,直到新的检查结果出来。患者的突变若有典型的MDS改变,会更倾向于MDS;如若没有,再障和MDS早期表现也不是很典型,但是MDS的发病率要比再障高。
目前为止,患者治疗未得到好转。患者还很年轻,所以不管是MDS还是再障,都可以考虑骨髓移植。因为药物治疗是有限的,病人缓解的不彻底,所以年轻的病人做移植是最合适的。另外喜滴克和环孢素也可以启用了。
会诊病例3
罗鸣,江苏大学附属医院
病例描述:
患者:女,54岁
治疗经过:
1.患者30余年前出现反复头昏乏力,感染,双下肢皮肤瘀点,我科住院查血常规示三系减少,骨穿提示再生障碍性贫血,诊为“再生障碍性贫血”,予十一酸睾酮(安雄),间断输血治疗,病情控制基本稳定。
2.2016-05-30:查血常规:血红蛋白:70g/L,血小板计数:24*10^9/L,白细胞计数:4.3*10^9/L,复查骨髓穿刺检查示粒系成熟障碍伴中毒性改变,红系增生,可见病态造血,染色体检查显示45X,-X(4)/46XX(16),后给予雄激素治疗逐渐效果降低,血象三系持续减低,给予环孢素A治疗,但患者恶心不能耐受遂停药。
3.2016-09-01:行骨髓检查示:骨髓增生异常综合征(MDS-RCMD)之骨髓象不能除外。骨髓活检提示骨髓造血组织增生略减低,未见异常定位,染色体检查显示45X,-X(4)/46XX(16),之后间断给予EPO,安雄,叶酸,维生素B12治疗,血象上升不明显, 长期输血支持治疗,曾查铁蛋白明显升高,诊断为继发性血色病,一度用去铁胺治疗,近一周乏力,胸闷气喘加重,无皮肤出血
4.2017-8-30:给予骨穿检查示WHO2016年MDS分型:骨髓增生异常综合征(MDS-U)之骨髓象,骨髓活检示MDS样变,染色体检查显示45X,-X(4)/46XX(16),基因检测示BRAF基因突变,后给予输血,安雄等对症治疗,血红蛋白和血小板始终未见好转。
专家诊断:
患者病程分为两段,患者多年前就出现贫血症状,当时诊断是再障,三十多年前基因和染色体检测还不普遍。
第一,患者多年前的治疗是非常有效的,但近两年开始发生变化。从去年5月份开始出现血红蛋白、血小板、白细胞的下降。尽管白细胞下降得并不明显,但患者的分类里中性粒细胞变少了(还不到1/3),白细胞总数又处在边缘,综合以上患者实际上是三系下降。
第二,患者染色体检查始终都是45X,-X(4)。
第三,患者今年的涂片和活检结果明确地指向MDS。
也就是说,患者三十多年前的情况不同于和近两年的情况。从染色体检测、骨髓活检、骨髓涂片和三系减少都可以诊断病人为低中危MDS,同时患者还查出BRAF基因的改变。尽管BRAF在MDS的表达不是很多,发病率也比较低。
治疗方案:
患者目前最主要的问题是低中危MDS三系减少,可以考虑用小剂量的地西他滨。最后一次看到巨核细胞是15个,但成熟血小板却比较少。为什么要讲这个问题呢?因为患者如果有巨核细胞的话,用小剂量的地西他滨,患者的血小板也会升高,对血红蛋白输血的依赖也就减少。
除了小剂量的地西他滨以外,这个患者完全可以考虑用喜滴克治疗。虽然目前全国还没有喜滴克加上小剂量地西他滨的研究,但是我认为两者可以联合看看疗效怎样。
对于低中危患者,用地西他滨可以改善输血程度,还可以升高血小板计数,这是地西他滨的适应症。相对来说,喜滴克就还处于临床研究阶段,这个需要医生和患者家属沟通清楚。喜滴克相副作用很少,尤其是在骨髓的抑制上。而地西他滨有时小剂量也会对骨髓产生抑制。另外,是否需要去铁呢?理论上一般是在大于1500 ug/L以上才去铁,而且是连续两次。这个病人11月7号检查在1100 ug/L左右,这个时候去铁肯定有效。但因为去铁胺的半衰期很短,所以要持续用。患者要从早上8点钟输注到下午5点钟,从周一输注到周日,患者会很辛苦。如果患者经济条件好,可以服用恩瑞格。一方面是因为输血,另一方面是红细胞无效造血也会引起铁蛋白的增高。
会诊病例4
闫兴双,唐山市弘慈医院
病例描述:
患者:女,52岁。患者20多年前无明显诱因出现乏力,当时就诊于当地医院,查血常规、骨穿,诊断为慢性再生障碍性贫血,口服“司坦唑醇”后乏力症状减轻,后患者未坚持服药。
治疗经过:
1.4年前(2013年5月10日):患者再次出现乏力,伴头晕、头痛,活动后心悸、气短,就诊于唐山市工人医院,复查骨穿示:考虑低增生性骨髓增生异常综合征。
2.后于天津医科大学总医院查骨髓象示:髋骨增生减低,胸骨增生活跃,原粒占0.5%,早幼粒占3.5%,骨髓活检:增生极度低下,主要为脂肪组织,染色体核型:47,XX,+8,确诊为骨髓增生异常综合征。血常规:白细胞 4.16x10^9/L,血红蛋白 68.2 g/L,血小板 48x10^9/L。
3.2014年2月26日复查:血常规:白细3.05x10^9/L,血红蛋白 74.0g/L,血小板 63x10^9/L,中性粒细胞 1.72x10^9/L。骨髓细胞形态学:增生活跃,原8.0%,幼稚细胞4.5%。修正诊断为MDS-RAEB,给予CAG小剂量化疗方案,化疗后骨髓抑制。
4.2014年12月17日患者血细胞再次进行性下降,复查血常规:白细胞 1.43x10^9/L,血红蛋白 63.0 g/L,血小板 44x10^9/L。间断输血支持治疗。
5.2017年8月2日复查:血常规:白细胞0.63x10^9/L,血红蛋白 40.0 g/L,血小板 15x10^9/L,中性粒细胞 0.15x10^9/L。骨髓细胞形态学:增生极度低下,粒系比例偏低,红系未见,淋巴细胞比例正常。全片未见巨核细胞,血小板少见。
6.2017年8月14日:给予地西他滨去甲基化治疗(具体方案为地西他滨25 mg 1/Wx4次),期间给予重组人粒细胞刺激因子升白,输注血细胞支持治疗。
7.2017年9月6日复查:血常规:白细胞0.95x10^9/L,血红蛋白 32 g/L,血小板 8.0x10^9/L。患者拒绝继续应用地西他滨治疗,间断输血支持治疗。
专家诊断:
患者诊断为MDS有明确的依据:一是三系减少;二是骨髓原始细胞达到8%;三是染色体是典型的MDS染色体改变。
至于患者为什么血造不出来?有两个原因:
第一,MDS本身会造成无效造血;
第二,患者打了CAG,效果是有的。但有一点,打CAG之后骨髓抑制是非常严重的。
再看看地西他滨的使用。现在每周剂量给少了(25mg),间距变长,但是坏细胞始终没有减少。尽管患者只有五十多岁,但患者可能对这种药物的反应相对比较敏感。无论是药物治疗还是其它治疗,除非进行骨髓移植,否则MDS是不可能根治的。所以这种情况诊断就是MDS-RAEB,不用考虑再障了。
患者在14年是MDS-RAEB,理论上RAEB的平均寿命只有1-2年。MDS的死亡原因可以是朝白血病转化,也可以是全血减少死亡,所以现在全血减少也是MDS的一个表现。
治疗方案:
如果病人愿意做干细胞移植是最好,而且患者年龄也适合做干细胞移植。如果不做干细胞移植,我们还有多少手段呢?
第一,患者是否可以用免疫抑制呢?有点危险!为什么呢?14年时患者的坏细胞达到8%,如果用环孢素3个月后,坏细胞更多,医生或者病人家属可能会觉得这个跟环孢素有关,所以谨慎点的医生环孢素是不敢用的。
第二,患者没有可用来那度胺的指征,两个原因:一是没有5q-,二是全血太少。
第三,地西他滨就更不敢用了,为什么?地西他滨的剂量那么少,患者还是起反应了。
所以针对这个患者,唯一的治疗方法是看看能不能用喜滴克。第一喜滴克比较安全,骨髓抑制的副反应小;第二喜滴克没有其它不良反应。患者除了干细胞移植外都不太合适,用喜滴克的话,还是比较有指征的,喜滴克打14天,观察两个疗程,再观察疗效。
会诊病例5
曹满雄,汕头大学医学院附属第一医院
病例描述:
患者:男,53岁。
主诉:反复头晕乏力6年余,加重伴气促3天。
现病史: 缘患者于2011年1月因“头晕乏力1月余”在我院住院治疗,查骨髓细胞示“骨髓增生活跃,原粒1%,早幼粒2%,红系及巨核系偶见巨幼样变,内铁63%,外铁:++”,染色体核型分析:+8阳性,诊断为“骨髓增生异常综合征”,予沙利度胺、刺激因子等治疗效果不佳。
治疗经过:
1. 2011年至广东省人民医院诊治,查FISH:-5阳性,原始粒细胞5%,诊断为MDS-RAEB-1,予地西他滨(40 mg qd d1-d5)治疗4疗程,好转出院。此期间患者间断输注红细胞、血小板,不规律我科随诊,予维A酸、沙利度胺及中药等治疗。2014-06-18因“头晕乏力”等再次入院,复查骨髓细胞学示骨髓有核细胞增生明显减低,2014年8月改服“来那度胺(10 mg/qd)”治疗,服用至2015年5月份,复查血常规示血象未见改善,考虑“来那度胺”治疗失败。
2.2015年5月改为"新山地明"治疗,复查血常规示血红蛋白较前升高, 2015年9月份查肾功能示肌酐稍升高(145 umol/L),查环孢素浓度维持在97-257 ng/ml之间;2017年5月患者头晕乏力等症状明显加重,复查血常规示血红蛋白约30 g/L,环孢素浓度约90 ng/ml,多次住院输注浓缩红细胞。
3.2017年10月患者头晕乏力加重,现为进一步诊治收住我科,近期患者胃纳睡眠一般,大小便正常,体重无减轻。精神一般,重度贫血貌,全身皮肤粘膜无黄染及出血点。
既往病史:MDS,慢性肾功能不全,贝切特氏(白塞氏)综合征,痔疮。
专家诊断:
患者的诊断不会有错。从三系减少,再加上骨髓涂片和活检都有发育异常,而且还有1次原始细胞在5%左右,完全可以肯定是MDS-RAEB-1。而且加上染色体结果有一个+8,再到广东省人民医院FISH发现5q-,所以这个诊断绝对没有问题。
治疗方案:
患者治疗早期使用地西他滨相对好转,有两个原因:
第一当时有少量原始细胞,地西他滨对原始细胞是有作用的;
第二地西他滨对红系的依赖输血以及血小板轻度升高有一定的作用,所以当时地西他滨用了四个疗程好转出院。
但MDS除了骨髓移植外其它都不能根治。目前患者原始细胞不多,三系减少很明显,使用环孢素是正确的,但患者肾功能不支持。而且因为MDS诊断为RAEB,之所以诊断为RAEB是因为有恶性克隆的出现、有潜伏的可能性,用环孢素可能会导致克隆长大、原始细胞增多,同时也存在肾功能的问题。
患者属于MDS低中危病人,但目前治疗难度很大。患者三系低,再用地西他滨患者可能无法承受。那如何治疗呢?
第一,用免疫抑制剂现在肾功能不好,也不支持。
第二,用免疫调节剂来那度胺,尽管剂量没有到位,但用药一年左右了也没有改善。
所以建议考虑用喜滴克试试。一是因为喜滴克相对其他治疗副反应比较少;二是因为喜滴克有两个作用,一是减少三系细胞的凋亡,恢复三系;二是它能否对早期的恶性克隆也有一定的作用,以前马军教授做的全国临床研究当中也证实了有这方面的作用。
关键是患者用过来那度胺,环孢素肾功能不好,地西他滨以前用过有一定效果,但现在三系那么低也不敢用。这个患者是完全适合用喜滴克来治疗的。
至于去铁,如果铁蛋白超过1500 ug/L是可以用的。如果患者铁蛋白高,用了恩瑞格或者去铁胺会不会影响细胞的恢复?患者目前铁蛋白还没有达到2000 ug/L以上,可以首先用喜滴克治疗两个疗程。如果情况得到改善,输血减少了、无效造血也少了,那铁蛋白就是在这个水平也不会增高。等到三系恢复到一定程度,如果铁蛋白还是高,再用去铁治疗。
了解2017 ASH第一手信息,参加医生讨论群,添加小助手黛安娜微信,注明“ASH 2017”













 苏公网安备32059002004080号
苏公网安备32059002004080号


