癌症是严重威胁人类健康的疾病之一,我国每年癌症的发病率和死亡率居高不下。健康人体的免疫系统是一个稳态系统,T细胞表面的受体(TCR)能够特异性识别抗原呈递细胞(antigen-presenting cell,APC)所提呈的抗原肽以及与抗原肽形成复合物的MHC分子;
同时,免疫应答还需要T细胞表面免疫调节分子的参与,包括:1、免疫共刺激受体,包括表达在T细胞表面的TNFR超家族成员CD28、OX40等; 2、免疫负调控分子,例如CTLA-4、PD-1等,能够有效抑制 T 细胞增殖;3、可溶性免疫抑制因子,如TGFβ1。其中,PD-1、CTLA-4又被称为“免疫检查点分子”(Checkpoint)。
PD-1蛋白全称Programmed Cell Death 1(细胞程序性死亡受体1),又称为PDCD1,是一种免疫球蛋白超家族Ⅰ型跨膜糖蛋白,属于T细胞共抑制受体,1992年首次被Honjo团队分离和鉴定[EMBOJ.1992 Nov;11(11):3887-95.]。
90年代后期,以华人科学家陈列平团队为代表的研究者们进行了大量工作,逐步揭示了肿瘤生长过程中免疫抑制反应的主要机制并鉴定了关键分子PD-L1 受体,从而为抗PD-1/PD-L1 药物的研发打下坚实的基础[Nat Immunol. 2001 Mar;2(3):269-74.]。
在生理条件下,PD-1可以被诱导性地表达在活化的T、B细胞、NK细胞、单核细胞和树突状细胞表面,与其配体、处于抗原呈递细胞(antigen-presenting cell,APC)APC细胞表面的PD-L1(即B7-H1)、PD-L2(即B7-DC)相互作用,抑制T细胞的活化,维持T细胞免疫稳态;而在许多肿瘤环境中,肿瘤细胞高表达PD-L1分子,与肿瘤部位浸润T淋巴细胞表面的PD-1分子结合后,抑制T细胞活性,实现肿瘤的免疫逃避。
在明确了PD-1/PD-L1的抑制机制后,科学家们便尝试寻找阻断癌细胞抑制免疫系统的方法,例如疫苗、免疫激活剂等,但是没有一种方法能够持续地发挥良好的作用。2008年,BMS公司开发的抗CTLA-4单抗ipilimumab(商标名Yervoy)在黑色素瘤病人中的安全和有效性引起关注[JClinOncol.2008Dec20;26(36):5950-6.]。
2011年Ipilimumab被FDA批准上市,用于治疗晚期黑色素瘤;此后,抗PD-1抗体的疗效也逐渐被证实。2010年,抗PD-1抗体MDX-1106(后来的Nivolumab,商品名Opdivo,亦称BMS-936558)的临床I期数据被公开,39名患有晚期黑素瘤、结肠癌、肺癌或肾癌的患者中,1名完全应答、2名部分应答、另有2名肿瘤明显缩小[J Clin Oncol. 2010 Jul 1;28(19):3167-75.]。
抗PD-1或PD-L1抗体能够阻断肿瘤部位PD-1和PD-L1的结合,逆转抑制效应,激活免疫细胞并重新识别、杀伤癌细胞(图1)[International Immunology, 2015, 27(1): 39–46.] [Expert Opinion on Investigational Drugs, 2015, 24(2): 253–260.] [Curr Opin Immunol 2012; 24:207-212.]。
同时,在肿瘤部位,抗PD-1抗体还可以结合浸润巨噬细胞表面的Fcγ受体,介导调节性T细胞的消耗,从而上调T细胞的比例,增强抗肿瘤能力[Curr Opin Oncol. 2014;26(2):204-14.]。
目前,多个用于肿瘤免疫治疗的抗PD-1或PD-L1治疗性抗体先后被FDA批准上市,其中有代表性的产品有默沙东公司的首个抗PD-1抗体pembrolizumab(商品名Keytruda)、BMS研发的抗PD-1抗体nivolumab(商品名Opdivo)以及罗氏公司开发的抗PD-L1抗体atezolizumab(商品名Tecentriq)、辉瑞/德国默克的抗PD-L1抗体avelumab(商品名Bavencio)和阿斯利康开发的抗PD-L1抗体Durvalumab (商品名Imfinzi)等。
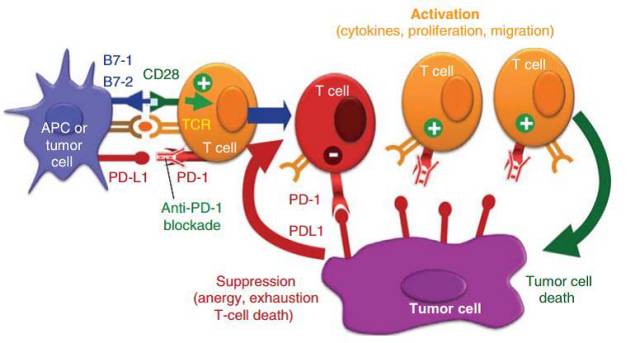
图1 PD-1维持免疫稳态以及肿瘤利用PD-L1实现免疫抑制示意图 抗PD-1/PD-L1抗体可以阻断肿瘤细胞的免疫抑制效应,重新活化T细胞杀伤肿瘤。
1抗PD-1抗体
2014年9月4日,FDA批准了首个抗PD-1抗体,即默沙东公司的Keytruda(通用名:pembrolizumab,曾用名Lambrolizumab、MK-3475),用于在ipilimumab治疗后无效的、不可手术/转移性黑色素瘤的二线治疗[Clin Cancer Res.2017.Feb.24. pii: clincanres. 0663. 2016.]。
它和后来被批准上市的抗PD-1抗体Opdivo/nivolumab都曾获得FDA突破性药物称号[CancerDiscov. 2013Jul; 3(7) : OF14.] [Oncologist. 2017. May; 22(5) : 585-591. ]。187例ipilimumab治疗后病情复发/进展的患者接受了pembrolizumab治疗,患者的总体反应率为为26%,治疗耐受性良好,无药物相关死亡[Lancet. 2014 Sep20; 384(9948): 1109-17.];
临床II期数据显示,540名ipilimumab治疗后病情复发的黑色素瘤患者分别接受了2mg/kg、10mg/kg pembrolizumab或者化疗,单抗治疗6个月无进展生存期为34%、38%,化疗组则为16%,且单抗治疗的副作用较低(11%、14%,化疗组为26%) [Lancet Oncol. 2015 Aug; 16(8): 908-18. ];
在临床III期试验中,811名晚期黑色素瘤患者分为3组,随机分配每2周静脉注射pembrolizumab,每3周静脉注射pembrolizumab或抗CTLA-4单抗ipilimumab。中位随访22.9个月,其中383例死亡。pembrolizumab24个月总体生存率为55%(每2周给药),每3周给药组为55%,而ipilimumab组为43%,提示pembrolizumab疗效略好于ipilimumab [Pembrolizumab versus ipilimumab for advanced melanoma: final overall survival results of a multicentre, randomised, open-label phase 3 study (KEYNOTE-006).Lancet. 2017 Aug 16.]。
之后,鉴于良好的临床表现,2015年12月18日,FDA加速审批通过了pembrolizumab 作为不可手术/转移性黑色素瘤一线用药的申请。在晚期黑色素瘤患者中,pembrolizumab的起效率为33%,一年无进展生存率为35%,中位总生存期23个月;3级或4治疗相关的不良事件发生率14%[JAMA.2016.Apr 19;315(15):1600-9.];
Pembrolizumab的临床疗效似乎优于之前获批的抗CTLA-4抗体ipilimumab,能够将晚期黑色素瘤患者的预期寿命提高1.14岁[J Manag Care Spec Pharm. 2017 Feb;23(2):184-194.];在日本患者中利用2mg/kg pembrolizumab进行临床Ib试验,数据显示,表皮黑色素瘤、粘膜黑色素瘤患者的应答率分别为24.1%和25.0%,12个月存活率为82.7%和51.4%[Cancer Chemother. Pharmacol. 2017. Apr; 79(4) : 651-660. ]。
在最新发表的两抗体联用的临床Ib期数据中,110例晚期黑色素瘤患者接受了pembrolizumab合并ipilimumab治疗。69例患者发生110次3-4级治疗相关不良事件,但是为此停药的患者数量仅为12例(停用ipilimumab)、14例(停用pembrolizumab)。
92例患者发生了158次免疫介导的不良事件,42例患者发生了3-4次免疫介导的3-4级不良事件。最常见的副作用是甲状腺功能减退和甲状腺机能亢进,但是没有发生与治疗有关的死亡事件。高达61%的患者对治疗有应答,1年无进展生存期约为69%,1年总生存率为89% [Lancet Oncol. 2017 Jul 17. pii: S1470-2045(17) 30428-X. doi: 10.1016/ S1470-2045(17) 30428-X.]。
2015年10月2日,pembrolizumab被FDA批准用于晚期非小细胞肺癌(NSCLC)治疗[Ann Oncol. 2017 Apr1;28(4):874-881.];2017年5月10日,pembrolizumab被批准作为NSCLC患者的一线用药,且并不需要患者PD-L1高表达;2016年8月5日被批准用于复发性和转移性头颈癌(HNSCC) [Oncologist. 2017 Jul; 22(7): 873-878. ]。
此后,pembrolizumab的适应症扩大到局部晚期或转移性尿路上皮癌(2017年5月18日) [Med Oncol. 2017 Sep 1;34(10):170.]、霍奇金淋巴瘤(cHL)(2017年3月15日)[Eur J Haematol. 2016 Sep; 97(3): 219-27. ]等;
2017年5月23日,FDA更是加速批准了pembrolizumab用于成人和儿童中采用其它治疗后发生进展的、没有其它可用治疗方案、不可手术或转移的、且存在MSI-H (microsatellite instability-high)或dMMR (mismatch repair deficient) 的实体瘤,表明pembrolizumab的适应症正式跨越了组织的限制,可以用于多种实体瘤的治疗。
同时,pembrolizumab还被批准用于氟嘧啶/奥沙利铂/伊立替康治疗后发生进展的、且存在MSI-H或dMMR的结直肠癌患者的治疗。这次批准是基于149名MSI-H或dMMR癌症患者的治疗数据,其中90例为结直肠癌(CRC),其余59例患者为14种其他肿瘤。
单抗的客观缓解率(ORR)为39.6%,其中11例完全缓解、48例部分缓解。 结直肠癌患者的ORR为36%,其他肿瘤类型为46%。78%单抗治疗的患者反应持续至少6个月。
百时美施贵宝(BMS公司)开发的全人IgG4抗PD-1抗体nivolumab(商品名:Opdivo)在美国市场被批准的虽然较晚,但是进展迅速,已经陆续被FDA批准用于晚期黑色素瘤(2014年11月22日批准)、难治性晚期鳞状非小细胞肺癌(2015年3月4日批准)[Lancet Oncol. 2015 Mar;16(3):257-65.]、肾细胞癌(2015年11月23日批准)[Eur Urol. 2017 Mar 3. pii: S0302-2838(17)30099-4.] [Lancet Oncol. 2016 Jul;17(7):994-1003.] [J Clin Oncol. 2015 May 1;33(13):1430-7.]、霍奇金淋巴瘤(2016年5月17日批准) [N Engl J Med. 2015 Jan 22;372(4):311-9.] 的临床治疗、头颈癌(2016年11月10日批准)[Lancet Oncol. 2017 Aug;18(8):1104-1115.]、尿路上皮癌(2017年2月2日批准)、既往治疗后复发的且具有MSI-H或dMMR的转移性结直肠癌(2017年8月1日批准)。
在食管鳞状细胞癌[Lancet Oncol. 2017 May;18(5):631-639.] 等其它癌症患者中进行的临床II/III期试验也已经完成。目前BMS还在利用nivolumab单药或者联合其它药物进行多项临床试验,针对头颈部鳞状细胞癌、胶质母细胞瘤等多个适应症 [SPAIN L, LARKIN J. Combination immune checkpoint blockade with ipilimumab and nivolumab in the management of advanced melanoma. Expert Opinion on Biological Therapy, 2016, 16(3): 389–396.] [CHEN S, LEE L-F, FISHER T S. Combination of 4-1BB agonist and PD-1 antagonist promotes antitumor effector/memory CD8 T cells in a poorly immunogenic tumor model. Cancer Immunology Research, 2015, 3(2): 149–160.] [RAJANI K, PARRISH C, KOTTKE T等. Combination Therapy With Reovirus and Anti-PD-1 Blockade Controls Tumor Growth Through Innate and Adaptive Immune Responses. Molecular Therapy: The Journal of the American Society of Gene Therapy, 2016, 24(1): 166–174.]。
其实,在pembrolizumab之前,2014年7月,nivolumab就已经获得了日本卫生署的优先评审资格并被批上市。临床III期数据显示,在ipilimumab治疗失败的晚期黑色素瘤患者中给予nivolumab或化疗药ICC,患者接受治疗的中位时间为5.3个月,化疗组为2个月。82%接受化疗的患者由于疾病进展停止治疗,而抗体组只有52%。 [Lancet Oncol. 2015 Apr; 16(4): 375-84.];
在另外一项在526例晚期黑色素瘤患者中进行的临床III期试验中,疾病进展306例,抗体治疗组85例,非治疗组221例。治疗组无进展生存期为4.7月(抗体反应弱组)、7.6个月(抗体反应强,肿瘤缩小>30%组),数据统计截止时(>1年),分别有76%、87%的患者依然生存,治疗相关不良事件发生率仅为4%[JAMA Oncol. 2017 Jun 29.]。
2抗PD-L1抗体
2016年5月18日,罗氏公司开发的atezolizumab(商品名:Tecentriq)被FDA加速审批批准上市,成为第一个抗PD-L1治疗性抗体,用于接受含铂化疗失败的局部晚期/转移性尿路上皮癌的治疗;2016年10月18日,atezolizumab的适应症又被扩大至转移性非小細胞肺癌[J Clin Oncol. 2017 Aug 20; 35(24) : 2781-2789. ] [ Lancet. 2016 Apr 30; 387(10030) : 1837-46. ];
2017年4月17日,FDA进一步加速审批通过了atezolizumab用于不能采用顺铂化疗的、局部晚期或转移性尿路上皮癌(mUC)的患者的初始治疗。在310例铂类化疗失败的转移性尿路上皮癌的患者中进行的临床II期试验显示,接受了atezolizumab治疗后,肿瘤部位浸润性免疫细胞(IC)反应率显着改善:IC2 / 3组的客观反应率分别为26%,IC1/2/3组为18%,全部310例患者的总体反应率为15%。
中位随访11.7个月,45例应答者中有38例(84%)持续反应。整个治疗过程中出现了3-4例治疗相关的不良事件如疲劳;3-4级免疫相关不良事件发生了15例,包括肺炎、天冬氨酸氨基转移酶、丙氨酸氨基转移酶升高、皮疹和呼吸困难等。在研究期间没有发生治疗相关的死亡[Lancet. 2016 May 7; 387(10031) : 1909-20. ]。
2017年3月23日,FDA批准辉瑞和德国默克的PD-L1抗体avelumab (商品名Bavencio)上市,作为治疗默克細胞癌(Merkel cell cancer,MCC,一种罕见皮肤癌)的孤儿药。
这次批准的依据是在化疗复发的MCC病人中进行的一项II期临床试验结果。在这个88人参与的临床试验中,中位随访期10.4个月。avelumab的客观应答率为31.8%(28例),其中8例为完全缓解,20例部分应答。仅四例(5%)患者发生五次3级治疗相关不良事件,包括淋巴细胞减少、血液肌酸磷酸激酶、氨基转移酶或血胆固醇升高等。
没有治疗相关的4级不良事件或死亡病例。五例患者(6%)报告严重的治疗相关不良事件,包括小肠结肠炎、输液相关反应、氨基转移酶升高、软骨炎、滑膜炎和间质性肾炎。截止试验结束(>1年),28例患者中23例依然存在应答 [Lancet Oncol. 2016 Oct; 17(10) : 1374-1385. ];2017年5月9日,avelumab又被批准用于尿路上皮癌[Cancer Discov. 2017 Jul; 7(7) : 659-660.] [ J Clin Oncol. 2017 Jul 1; 35 (19): 2117-2124. ]
2017年5月1日,阿斯利康开发的PD-L1抗体Durvalumab(商品名:Imfinzi)上市,用于治疗接受含铂化疗药无效的局部晚期或转移性尿路上皮癌患者的二线治疗方案。同时被批准的还有PD-L1检测试剂盒,用于检测PD-L1的表达以筛选患者。
Durvalumab成为继atezolizumab (商品名:Tecentriq)和nivolumab (商品名:Opdivo)之后又一获批治疗尿路上皮癌的免疫疗法。小样本临床I/II期数据显示,10名其他治疗手段无效的晚期疾病患者接受放疗和Durvalumab联合治疗后,持续中位数为5.2个月,抗体耐受性较好[Eur J Cancer. 2016 Nov; 68: 156-162. ]。
而Durvalumab此次获批主要是基于一项临床I/II期试验,在既往治疗失败的4期尿路上皮癌患者中进行,纳入了9个国家60个试验点的数据。191个局部晚期或转移性尿路上皮癌患者,接受Durvalumab 10mg/kg、2周一次的治疗,用药最多一年,期间发生疾病进展或发生严重不良反应即中止。
中位随访为5.78个月,客观回应率为17.8%(34人),其中7例完全应答。Durvalumab引起患者反应的响应时间早(中位数为1.41个月)且持久,PD-L1表达高的患者应答率为27.6%(27例),表达低/无的患者仅率为5.1%(4例)。
中位无进展生存期和总生存期分别为1.5个月和18.2个月,估计1年总体生存率为55%。13例(6.8%)发生3/4级治疗相关不良事件,另有4例患者发生3/4级免疫介导不良事件(2.1%),导致3名患者停止治疗,其中2名死于免疫介导的自身免疫性肝炎和肺炎[Efficacy and Safety of Durvalumab in Locally Advanced or Metastatic Urothelial Carcinoma: Updated Results From a Phase 1/2 Open-label Study. JAMA Oncol. 2017 Aug 17:e172411. doi: 10.1001/ jamaoncol.2017.2411.]。
值得一提的是,抗PD-1/PD-L1抗体的疗效与患者PD-L1表达水平密切相关,即使FDA批准pembrolizumab用于NSCLC患者治疗并不需要患者PD-L1高表达,但是,大多数抗体的临床试验数据均提示,高表达PD-L1的患者获益率愈高。
在PD-L1阳性的黑色素瘤和非小细胞肺癌患者中,Nivolumab总应答率为34.1%,而PD-L1阴性的患者仅为19.9% [PLoS One. 2015 Jun 18; 10(6) : e0130142. ],在转移性膀胱癌中的数据也显示了相似的结论[Ann Pharmacother. 2017 Aug 1: 1060028017727546]。此外,单抗治疗的疗效似乎不如组合疗法,特别是多个抗体联合的鸡尾酒疗法更具前景[JAMA. 2016 Apr 19; 315(15) : 1600-9. ]。
2015年10月,FDA批准了PD-1抗体Nivolumab联合CTLA-4抗体Ipilimumab一线治疗不可手术或转移性黑色素瘤,其中95名采用抗体联合治疗,47名单用Ipilimumab。双抗体治疗组2年生存率为63.8%,单个抗体治疗组则为53.6%。
不过,抗体联用引起不良事件的几率也相应提高(54%),单用组则为20%。主要不良事件包括结肠炎、丙氨酸氨基转移酶升高、垂体炎等,需要严密的临床监控[Lancet Oncol. 2016 Nov;17(11):1558-1568.];2017年8月,BMS启动了一项III期临床试验,考察 Nivolumab联合Ipilimumab继以Nivolumab给药疗法作为一线治疗晚期黑色素瘤的疗效(CheckMate 401,ClinicalTrials.gov临床试验号: NCT02599402)。
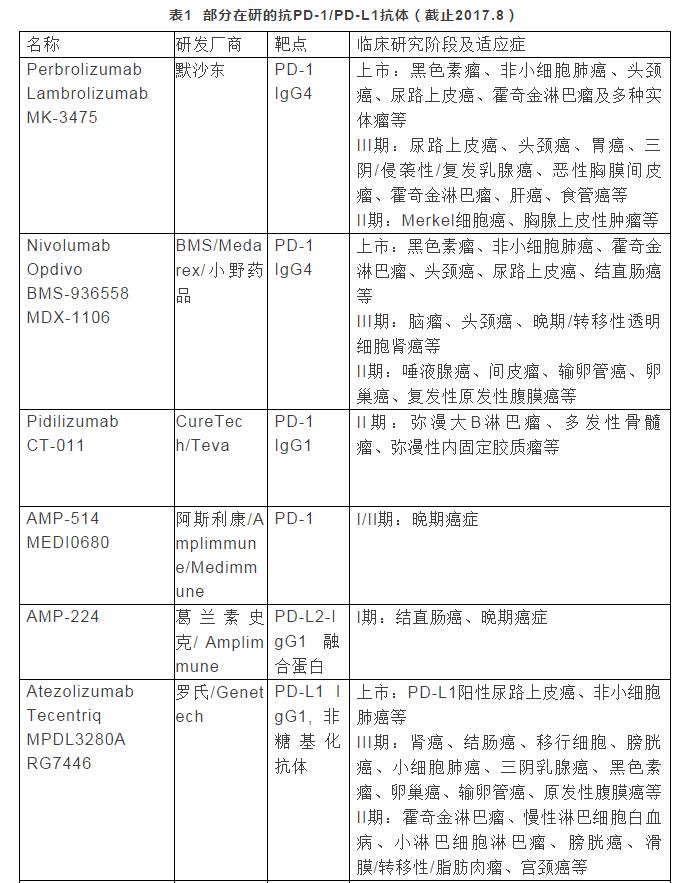
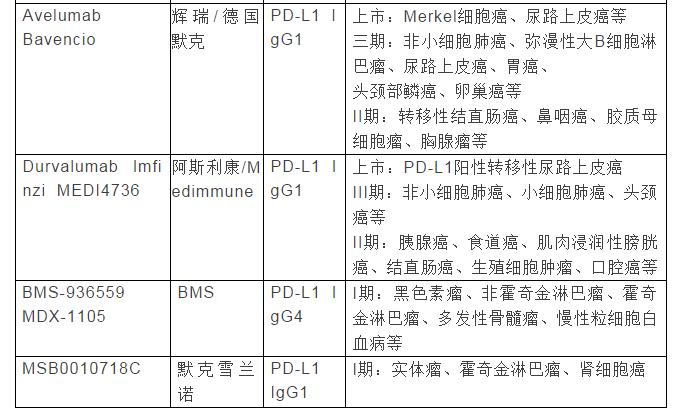
表1列举了部分在研的抗PD-1/PD-L1抗体概况,包括名称/曾用名、研发厂商、靶点、临床研究阶段及适应症等信息(数据主要来自https://www.ncbi.nlm.nih.gov/pubmed/和https://clinicaltrials. gov/)。















 苏公网安备32059002004080号
苏公网安备32059002004080号


