前几天,一例肺癌食管转移的病例引起了省内同道的广泛关注,讨论加深了我们对于癌症转移及罕见转移的认识。
这次讨论我认为有必要将两年前的一例ALK阳性的肺癌克唑替尼治疗中出现子宫内膜转移的病例对各位同仁进行一次分享。
肺腺癌子宫内膜转移一例
病情介绍
2015年2年27日
患者女,50岁,因出现食欲减退,间断性右上腹针刺样疼痛、腹胀,至河南省军区医院查彩超示:
1.肝脏多发实性占位性病变;
2.肝门部多发淋巴结肿大;
3.腹水(少-中等量);
4.胸腔积液(左侧少-中等量,右侧中-大量)。
2015年3月2日
郑大一附院门诊以肝占位为诊断收入,PET-CT:
右肺下叶近肺门处软组织肿块影代谢活跃,其远侧不张肺组织及周围斑片状高密度影代谢活跃,考虑肺癌伴阻塞性肺不张、阻塞性肺炎;肝内多发代谢活跃灶,颈部、纵膈、双肺门、隔上前群、腹腔后及双侧髂血管旁多发淋巴结肿大代谢活跃,考虑转移;双侧胸腔积液;腹盆腔积液。
双肺下叶条索状高密度影代谢未见异常,考虑炎症;右肺多发钙化灶;双侧胸膜增厚局部代谢活跃。
甲状腺切除术后改变。
双侧扁桃体代谢活跃,考虑炎症。
子宫节育环。
行支气管镜取活检,病理结果回示:
(右肺中叶支气管)低分化癌,考虑低分化腺癌。免疫组化:CK5/6(-),P40(-),CK7(+),TTF-1(+),NapsinA(+),Ki-67(70%+)。EGFR基因未见突变,ALK融合蛋白免疫组化阳性。
给予口服“克唑替尼”靶向治疗,腹痛、腹胀逐渐缓解。
2015年7月6日
自觉胸闷,至河南省中医院复查彩超示:
肝右叶多发实性结节(较前比无明显变化);
肝门处可见一淋巴结。
右侧胸腔积液(大-中量)
腹膜后大血管周围未见明显增大淋巴结。
2015年7月13日
至郑大一附院胸腔置管引流。
2015年7月18日
给予“顺铂60mg+恩度30mg+地塞米松5mg”胸腔灌注。
2015年9月1日
出现腹胀并进行性加重。
2015年9月21日
至河南省肿瘤医院就诊。既往体健,无吸烟及饮酒史。无肿瘤家族史ECOG:1分。
入院查体:T:36.5℃,P:80次/分,Bp:115/76mmHg,R:20次/分。浅表淋巴结未触及肿大。双下肺呼吸音消失。腹部膨隆,无压痛、反跳痛,肝脾肋下未触及,未扪及肿块。
入院后检查:血常规: WBC 10.48×109/L,RBC 3.52×1012/L,CEA 5.29 ng/mL,NSE 46.53 ng/mL,CYFA211 121.4 ng/mL,ALT 17U/L,AST 18U/L, BUN 10.8mmol/L, Cr 99μmol/L ,超声(2015.9.21)示:左侧胸腔大量积液:右侧胸腔中-大量积液。
初步诊断:原发性右肺腺癌肝转移T3N3M1 IV期 EGFR野生型 ALK阳性
诊疗经过:行超声引导下腹腔积液置管引流术。腹水沉渣包埋,病理(B1513496 )示:(腹水)发现腺癌细胞团。
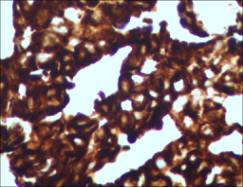
图示:腹水沉渣包埋发现腺癌细胞团TTF-1灶+,ALK融合蛋白阳性
因患者肌酐偏高,请泌尿外科会诊,建议查腹部MRI明确诊断,是否为肿瘤压迫引起,但患者带有节育环,请妇科会诊,取出节育环,并同时子宫内膜活检。
2015年9月26日
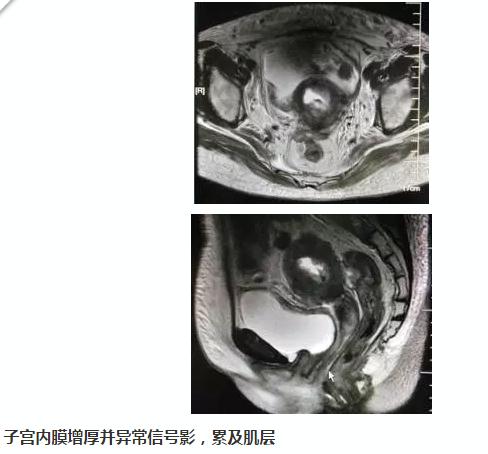
查MRI(下腹,平扫+增强盆腔,平扫+增强 )示:
子宫内膜增厚并异常信号影,累及肌层,请结合临床。
子宫多发肌瘤。
双侧髂血管旁及腹股沟区、腹膜后散在淋巴结。
所示盆腔腹膜增厚并结节,考虑转移,腹盆腔积液。
双侧肾盂及输尿管扩张积水,请结合临床。
两侧胸腔积液。
腹壁、腰背部皮下水肿。
2015年9月29日
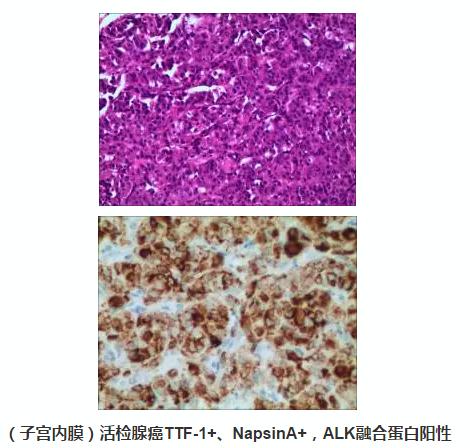
病理活检(B1513618)示:(子宫内膜)形态及免疫组化符合:低分化腺癌伴局灶性鳞状分化,免疫组化TTF-1+、NapsinA+提示:肺癌转移而来。免疫组化:CK+,Vim-,P63灶+,CK5/6灶+,CK7+,CK18,CEA+,CA125+,Ki-67+80%,TTF-1+,NapsinA+,ER-,PR-,P53+70%。
2015年9月30日
患者因双侧肾盂及输尿管扩张积水,行输尿管支架植入术。
2015年10月4日
复查血常规,肝肾功等检查,提示:
低钾血症;
低蛋白血症;
急性肾衰。
2015年10月5日
请肾内科会诊后给予纠正低钾血症、低蛋白血症及肾康注射液改善肾功能等对症治疗。
2015年10月7日
夜间患者突诉胸闷加重,测血氧饱和度83%,给予引流胸腔积液300ml,未明显缓解。
2015年10月8日
引流1000ml后患者诉呼吸困难,急查血气分析:PCO2 28.7mmHg;PO2 39.4mmHg。转入ICU无创呼吸机支持治疗,拟患者病情好转后转回我科继续治疗。患者子宫内膜腺癌诊断明确,但来源有争议,考虑:
原发性子宫内膜癌。
肺癌子宫内膜转移。
查子宫内膜癌ALK融合蛋白阳性,ALK基因检测亦为阳性;
肺癌进展诊断明确,治疗方案考虑:
调整为化疗,紫杉类+铂首选。
换用靶向药物。
为明确腹水来源,根据免疫组化,考虑肺来源可能,但不能完全排除子宫内膜来源,再查腹水沉渣ALK融合蛋白为阳性,则支持肺来源的证据更多一些。
另外,如果子宫内膜癌为原发,ALK阳性,可试用ALK TKI,如果子宫内膜为转移灶,在治疗方案应该按照肺癌;但患者病情危重,进展迅速,体质不宜化疗,与患者及家属深入沟通。
2015年10月9日
给予AP26113(120mg qd)靶向治疗。
患者症状在1周明显缓解,从ICU转入普通病房,2周后可下床活动,出院,复查CT,评价疗效为部分缓解。
2016年8月3日
返院复查CT,疗效评价进展。
重要提示
1.腹水来源问题,腹水沉渣病理,根据免疫组化,考虑肺来源可能,但不能完全排除子宫内膜来源,再查腹水沉渣ALK融合蛋白为阳性,则支持肺来源的证据更多一些。
2.50岁女性患者,无阴道出血等子宫内膜癌临床症状,因需要检查盆腔MRI,取节育环时留取子宫内膜送检病理发现子宫内膜腺癌,且MRI亦支持子宫内膜增厚,为偶然发现,免疫组化查TTF-1+、NapsinA+,提示肺癌转移而来,查ALK融合蛋白阳性,ALK基因检测亦为阳性,即在基因水平和蛋白水平均有ALK表达,为ALK-TKI靶向治疗找到了依据。
3.综合分析认为,肺腺癌ALK-TKI靶向治疗后进展广泛转移,转移部位包括胸腔、腹膜、子宫内膜等,克唑替尼靶向治疗后进展,换用新一代TKI AP26113病情在短时间内得到有效控制,患者转危为安。
讨论
肺癌发生胸膜、骨骼、肝脏及脑转移较为常见,肺腺癌患病率女性高于男性,青年高于老年。特别是在非吸烟,女性和亚洲患者中是最常见的肺肿瘤。因其较多为周围型且倾向于管外生长,富有血管和淋巴,较早出现局部浸润和血行转移及淋巴道转移。非生殖道来源的肿瘤转移至女性生殖道者少见,卵巢是最常见的转移部位,一般为种植转移。
关于肺腺癌发生子宫内膜转移,国内外报道甚少。张洁等[1]Hibi S, Miyazaki K [2] Marcello Tiseo1, Melissa Bersanelli[3]曾报道3例肺癌子宫内膜转移。
TTF-l也称为NKX2,主要存在于肺泡Ⅱ型上皮细胞以及Clara细胞中,参与调控SPA、SPB的表达,在甲状腺、肺、前脑的发育过程中发挥重要作用。
目前,在临床上已将其作为肺腺癌组织特异性标志蛋白,用于鉴别肺腺癌与鳞癌,以及原发性与转移性肺癌,大部分(70%~100%)原发性肺腺癌中TTF-1表达阳性[4] 。NapsinA是表达于肺泡Ⅱ型上皮细胞和肾小管上皮细胞的天冬氨酸蛋白酶,在76%-91%的原发性肺腺癌病人中表达阳性,65%-80%的敏感性和88%-100%的特异性[5-9。]NapsinA也表达于原发性肺腺癌以外的肿瘤,包括72%到88%的乳头状肾细胞癌[10,11]。和5%到50%的甲状腺癌[9,12],对于于转移性肺腺癌是一项非常可靠的免疫组化标志[13]。本例患者初始考虑双源癌:原发性肺腺癌、原发性子宫内膜癌,但病理免疫组化检查TTF-1+和NapsinA+,提示子宫内膜癌来源于肺癌可能。最终临床诊断为原发性肺腺癌转移到子宫内膜。
ALK阳性主要出现在年轻的、吸烟或非吸烟的肺腺癌患者中,且其在肺癌中的发生率和性别、种族无明显关系。
但在病理方面,ALK 阳性与腺癌的发生相关,目前的研究发现其更常见于以实性腺癌或印戒细胞癌为主的肿瘤组织中[14]。克唑替尼是治疗ALK阳性的非小细胞肺癌的分子靶向药物。
本例患者发生多处转移,为IV期,且ALK融合蛋白阳性,根据美国国家癌症综合网络NCCN非小细胞肺癌指南给予克唑替尼靶向药物治疗[15]。FDA 授予其酪氨酸激酶抑制剂 (TKI) 试验药物 AP26113 孤儿药资格,用于治疗对克唑替尼耐药的间变性淋巴瘤激酶阳性 (ALK+) 转移性非小细胞肺癌 (NSCLC) 患者。FDA 的孤儿药资格基于正在进行的 AP26113 的 1/2 期 ALTA 研究结果,这项研究总共有 137 名克唑替尼治疗后疾病又恶化的 ALK+ NSCLC 患者参与。试验数据最近在欧洲内科肿瘤学会 (ECC) 年会上得到发布,数据证明 72 名可评价患者中有 52 人获得客观缓解。此外,平均反应时间是 49 周,而平均无进展生存期为 56 周。我们这例患者明确克唑替尼耐药进展后及时给予 AP26113解救治疗[16],无进展生存期时间为40周,获得了较好的疗效。
美国国家癌症综合网络(NCCN)、美国胸科医生学会(ACCP)、美国临床肿瘤协会(ASCO)等检查亦未包括生殖道检查,这使我们难以早期发现生殖道的异常,待患者出现阴道流血、疼痛等症状时往往为时已晚,提示我们在生存时间较长患者,也应注意少见部位转移,争取做到早发现、早治疗。
[1] 张洁 刘磊 于佩瑶.老年女性肺癌完全缓解后宫颈及子宫内膜转移一例.中国医药,2013,8(2):263.
[2] Hibi S, Miyazaki K A case of lung cancer with endometrial metastasis Nihon Kokyuki Gakkai Zasshi2011 Jul;49(7):501-5.
[3] Marcello Tiseo, Melissa BersanelliEndometrial metastasis of lung adenocarcinoma:a case report Tumori, 97: 411-414, 2011
[4] 吕昕 王悦红 周建英. TTF一1\SPA表达与Il期肺腺癌
患者术后复发及生存关系的研究.2015,37(2):117-119
[5] Kim MJ, Shin HC, Shin KC, Ro JY. Best immunohistochemical panel in distinguishing adenocarcinoma from squamous cell carcinoma of lung: tissue microarray assay in resected lung cancer specimens. Ann Diagn Pathol 2013;17:85-90.
[6] Hirano T, Auer G, Maeda M, et al. Human tissue distribution of TA02,which is homologous with a new type of aspartic proteinase, napsin A.Jpn J Cancer Res 2000;91:1015-21.
[7] Hirano T, Gong Y, Yoshida K, et al. Usefulness of TA02 (napsin A) to distinguish primary lung adenocarcinoma from metastatic lung adenocarcinoma. Lung Cancer 2003;41:155-62.
[8] Stoll LM, Johnson MW, Gabrielson E, Askin F, Clark DP, Li QK. The utility of napsin-A in the identification of primary and metastatic lung adenocarcinoma among cytologically poorly differentiated carcinomas.Cancer Cytopathol 2010;118:441-9.
[9] Mukhopadhyay S, Katzenstein AL. Comparison of monoclonal napsinA, polyclonal napsin A, and TTF-1 for determining lung origin inmetastatic adenocarcinomas. Am J Clin Pathol 2012;138:703-11.
[10] Turner BM, Cagle PT, Sainz IM, Fukuoka J, Shen SS, Jagirdar J. Napsin A,a new marker for lung adenocarcinoma, is complementary and more sensitive and specific than thyroid transcription factor 1 in the differential diagnosis of primary pulmonary carcinoma: evaluation of 1674 cases by tissue microarray. Arch Pathol Lab Med 2012;136:163-71.
[11] Kadivar M, Boozari B. Applications and limitations of immunohistochemical expression of “Napsin-A” in distinguishing lung adenocarcinoma from adenocarcinomas of other organs. Appl Immunohistochem Mol Morphol 2013;21:191-5.
[12] Bishop JA, Sharma R, Illei PB. Napsin A and thyroid transcription factor-1 expression in carcinomas of the lung, breast, pancreas, colon, kidney,thyroid, and malignant mesothelioma. HUM PATHOL 2010;41:20-5.
[13] Moon-Young Kim, Heounjeong Go Napsin A is a useful marker for metastatic adenocarcinomas from the lungs.Histopathology2014 Aug;65(2):195-206.
[14] 郑明英 张力 克唑替尼治疗 ALK 融合基因阳性的晚期非小细胞肺癌患者的疗效分析.2015,13(1):83-86
[15] Ivana Sullivan David Planchard ALK inhibitors in non-small cell lung cancer:the latest evidence and developments Ther Adv Med Oncol2016 Jan;8(1):32-47.
[16] Iragavarapu C, Mustafa M, Akinleye A, etal.Novel ALK inhibitors in clinical use and development.J Hematol Oncol. 2015 Feb 27;8:17. doi: 10.1186/s13045-015-0122-8.













 苏公网安备32059002004080号
苏公网安备32059002004080号


