近日,全球肿瘤学领域影响因子最高的顶级期刊CA: A Cancer Journal for Clinicians(IF 232.4)发表了一篇题为“介入肿瘤学:实体瘤消融和栓塞作用的临床实用指南”的重磅综述。该文由美国德克萨斯大学MD安德森癌症中心介入放射科Mohamed E. Abdelsalam教授团队主导撰写,系统梳理了以微创、影像引导下的局部区域介入治疗(消融与栓塞)在肿瘤多学科管理中的发展脉络与现状。文章重点总结了上述介入治疗手段在肝细胞癌、肾细胞癌、肝内胆管癌及结直肠癌肝转移等多种实体瘤中的临床应用、关键疗效数据及在指南中的定位,为临床实践提供了重要参考。鉴于介入治疗在肿瘤综合治疗中的地位不断提升,为帮助临床医生更好地理解和把握当前介入治疗的最新进展与策略,【肿瘤资讯】特对该综述中肝细胞癌相关内容进行重点编译,以飨读者。

肝细胞癌(HCC)是全球癌症相关死亡的第三大原因,也是肝硬化患者的主要死亡原因。总体而言,对于无肝外转移的原发性肝脏恶性肿瘤患者,应优先考虑肝脏定向治疗。
热消融(TA)
对于BCLC A期HCC患者,采用热消融(TA)治疗时,其完全缓解率为70%~90%,中位总生存期(OS)约为60个月。这些良好的治疗结局使热消融成为小肝癌(<3 cm)的一种根治性治疗选择。
多项前瞻性随机对照试验(RCT),如SURF-RCT研究,显示在小肝癌患者中,射频消融(RFA)与外科切除(SR)的疗效相当。该研究纳入的患者定义为结节数≤3个,且每个结节最大直径≤3 cm。结果显示,外科切除组与射频消融组的5年OS率分别为74.6%和70.4%(p=0.84),5年无复发生存(RFS)率分别为42.9%和42.7%(p=0.84)。严重不良事件在3.3%的外科切除患者中发生,而射频消融组未观察到严重不良事件。
在一项纳入8项RCT、比较射频消融与外科切除的系统评价和Meta分析中,Jia等人报告两种治疗方式在OS和无病生存期(DFS)方面无统计学显著差异。然而,射频消融的并发症发生率显著更低(OR=0.65;95%CI,0.44~0.80;p<0.05),同时在缩短住院时间、降低术后死亡率及减少医疗成本方面具有明显优势。
近年来,微波消融(MWA)因具备多项优势而在多个中心逐渐取代射频消融,包括能够形成更大的消融范围,从而更容易获得充分的消融安全边界,而这对实现有效的局部肿瘤控制至关重要。此外,诸如评估消融边界充分性的专用软件等技术进步,已降低了局部肿瘤进展率,而局部肿瘤进展是影响临床结局的关键预后因素。
一项纳入16项研究(共2622例患者)的Meta分析比较了微波消融与外科切除在HCC及肝转移瘤患者中的疗效,结果显示两种治疗方式的OS相当。同时,微波消融在并发症发生率、术中失血量、手术时间及住院时间方面均表现出明显优势。尽管这些结果令人鼓舞,但仍需进一步的随机对照研究,以在早期HCC患者中比较外科切除与当前热消融技术的疗效。
动脉内疗法:TARE、TACE和TAE
对于早期至中期HCC患者,若不适合肝移植、外科切除或热消融,经动脉治疗,如经动脉放射性栓塞(TARE)、经动脉化疗栓塞(TACE)及经动脉栓塞(TAE)是重要的治疗选择。介入放射学领域普遍认为,相较TACE和TAE,TARE可带来更优的治疗结局,这一共识基于多项RCT结果,包括PREMIER和TRACE试验。PREMIERE试验将不可切除、不可消融的HCC患者随机分配接受TARE或传统TACE治疗,结果显示TARE显著延长了疾病进展时间(>26个月 vs 6.8个月),但在对肝移植进行删失分析后,两组的OS相似。TRACE试验主要纳入中期HCC患者,比较TARE与载药微球TACE,结果显示TARE在疾病进展时间(17.1个月 vs 9.5个月)和OS(30.2个月 vs 15.6个月)方面均优于TACE,且两组的安全性相当。
总之,这些研究表明,TARE在肿瘤控制持久性方面优于TACE,并在部分患者中显示出生存获益。此外,也有随机研究提示TACE与TAE的疗效相近。例如,一项单中心随机试验比较了多柔比星载药微球TACE与单纯微球栓塞(TAE)在不可切除HCC患者中的疗效,结果显示两组在无进展生存期(PFS)和OS方面均无显著差异。具体而言,中位PFS分别为6.1个月和5.4个月(HR=1.02;95%CI,0.69~1.51),中位OS分别为15.1个月和14.6个月(HR=1.05;95%CI,0.71~1.55)。这些结果提示,在栓塞治疗中加入化疗药物并未较单纯栓塞带来明确的临床获益。
TARE在早期与中期HCC中的应用
在早期HCC患者中,采用TARE的近期研究显示,客观缓解率超过80%,且平均缓解持续时间达6个月以上。回顾性LEGACY研究纳入162例单发、直径<8 cm的HCC患者,接受TARE治疗后,客观缓解率为88%,中位缓解持续时间为11.8个月,2年局部无进展生存率为93.9%。3级不良事件发生率为19%,但多数在研究期间得到缓解。尽管结果令人鼓舞,该研究仍存在回顾性设计及3年以上随访患者数量有限等局限性。在一项纳入30例肿瘤数≤3个患者的前瞻性研究中,Kokabi等人报道,TARE治疗6个月时的客观缓解率为81%,中位缓解持续时间为32.7个月。
近期,多中心前瞻性Doorway临床试验已完成患者入组,该研究评估了钇-90(90Y)放射性栓塞在BCLC 0-B期HCC患者中的疗效,其结果预计将在未来数月公布,有望以前瞻性、独立的方式验证LEGACY研究的发现。图1为一例接受选择性⁹⁰Y治疗的HCC患者在2年随访中维持完全缓解的影像。
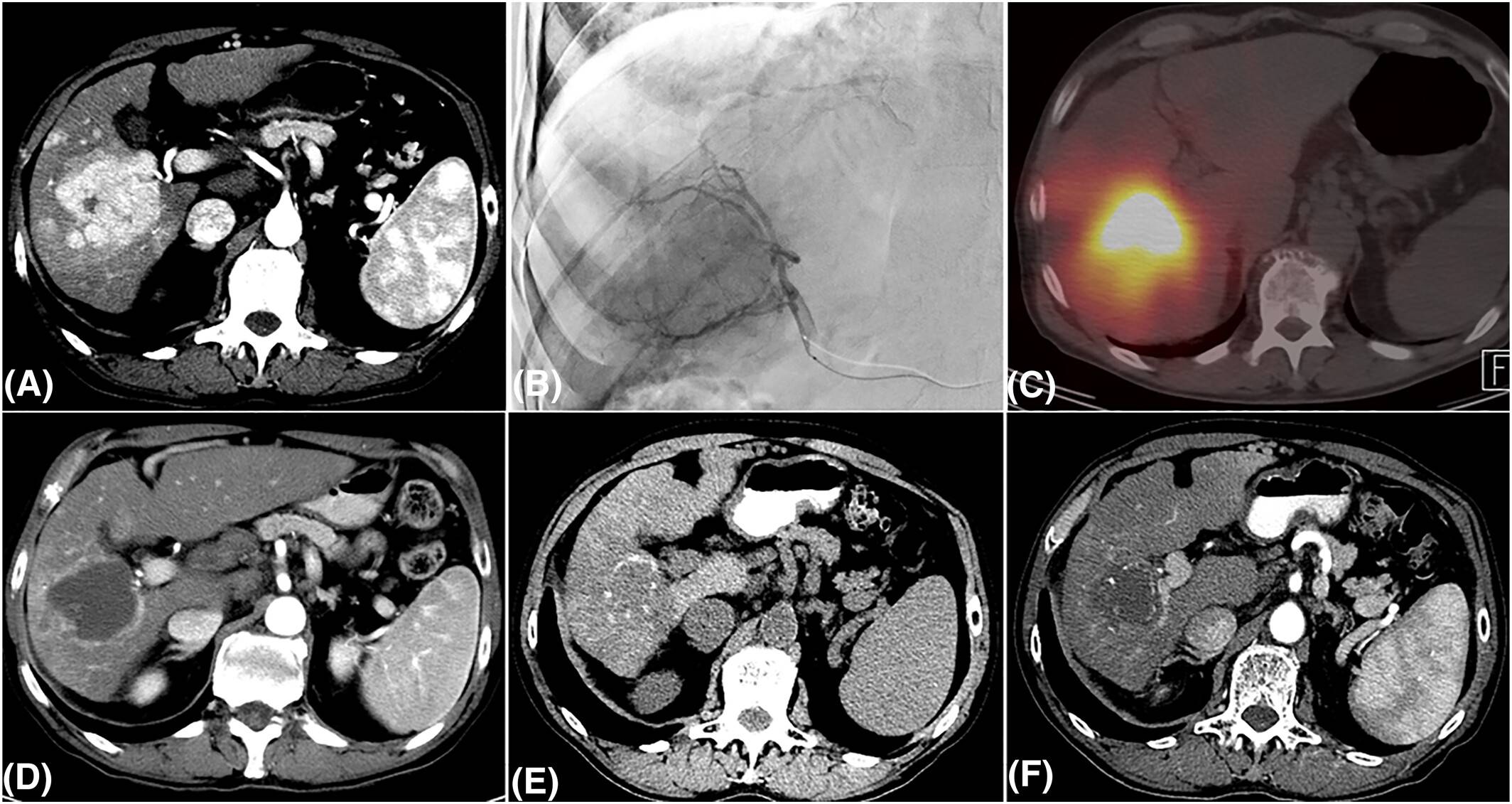
不同BCLC分期中的经动脉治疗策略
对于BCLC B期HCC患者(多灶性HCC,无血管侵犯或肝外转移,肝功能保留,体能状态0-2分),TARE优于TACE,因为研究表明TARE与治疗后更长的疾病进展时间相关。然而,大多数BCLC B期患者并不符合根治性TARE的条件,仅有部分患者(如病变局限于单一肝叶,或具有足够未受累肝实质以支持高剂量消融性TARE)可能成为根治性TARE的候选者。
在TRACE前瞻性随机研究中,72例不可切除HCC患者被随机分配接受TARE或TACE,TARE组的中位疾病进展时间(17.1个月 vs 9.5个月;p=0.002)及中位OS(30.2个月 vs 15.6个月;p=0.006)均优于TACE组。
对于BCLC C期HCC患者(存在血管侵犯或肝外转移,体能状态≤2分),系统治疗仍为标准方案。对于肝功能良好且疾病得到控制的患者,可考虑将TARE作为巩固治疗选择。尽管目前尚无统一共识,但三项独立的前瞻性研究表明,即使在存在门静脉癌栓的情况下,单独TARE治疗仍可获得良好结局,OS为13~15个月。
在对其他局部治疗无效或不适合的HCC患者中,RTOG-1112 III期RCT显示,在校正分层因素后,索拉非尼联合SBRT较单用索拉非尼可改善OS和PFS(OS 15.8个月 vs 12.3个月;PFS 9.2个月 vs 5.5个月)。
局部区域联合治疗策略
当患者的疾病状态(病灶数量、大小及分布)不适合单一局部区域治疗方式时,临床上常联合多种局部治疗策略。例如,对于一侧肝叶病灶负荷较重的多灶性HCC患者,在一侧肝叶实施TARE或TACE,同时在对侧肝叶联合TA或SBRT,有时可实现良好的局部控制。所有此类病例在实施治疗前,均需经多学科肿瘤委员会讨论,并在外科肿瘤学、放射肿瘤学、内科肿瘤学及介入放射学等多学科达成共识。
此外,有证据表明,在治疗单发病灶时,将TACE等经动脉治疗与TA或SBRT等消融治疗联合应用,可获得更佳疗效。例如,一项纳入289例HCC患者的回顾性研究显示,联合消融治疗(TA或SBRT)可显著改善预后:联合治疗组的3年OS率为85.3%,而单纯TACE组为47.1%;中位OS几乎翻倍(83.4个月 vs 33.9个月)。该研究得出结论,在TACE后加用消融治疗与显著改善的局部控制率和生存获益相关。
总体而言,经皮热消融(TA)是小肝癌患者一种安全且有效的治疗选择。不断增加的循证医学证据支持其疗效,使其在经过合理筛选的患者中被确立为一种具有根治潜力的替代方案。对于较大的肿瘤,结合先进剂量学评估实施的TARE可实现优异的局部肿瘤控制,相较TACE可改善OS,并在部分患者中具有潜在的根治性。图2展示了不同HCC临床场景下推荐的局部区域治疗策略。
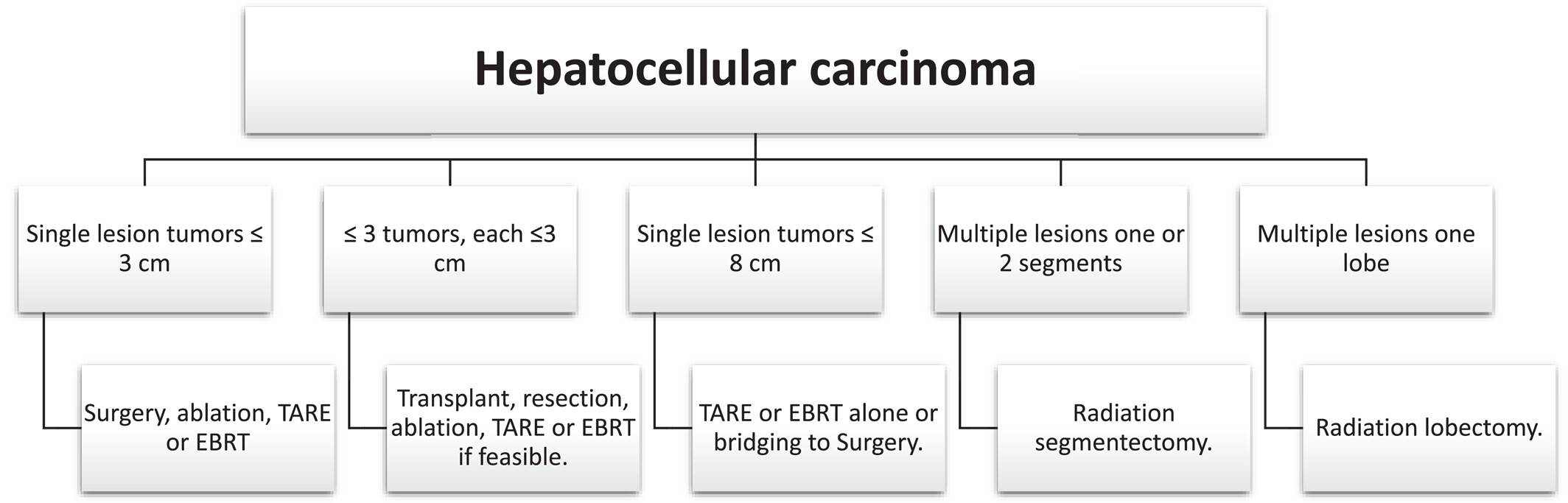
在临床指南中的定位
经皮肝脏消融在临床实践中已被广泛认可为治疗肝脏恶性肿瘤的重要手段,其相较传统外科切除具有恢复更快、成本更低的优势。根据2022年BCLC治疗指南,对于极早期HCC患者(定义为单发肿瘤,最大直径≤2 cm),若不适合肝移植或外科切除,射频消融(RFA)或微波消融(MWA)被推荐作为一线治疗方案。
对于早期HCC患者,若因门静脉高压或肝功能不全而不适合外科切除,在肿瘤数目不超过3个且每个肿瘤最大直径≤3 cm的前提下,消融亦可作为替代治疗选择。肝脏消融的候选患者通常应具备Child-Pugh A或B级肝功能状态以及良好的体能状态。鉴于其微创性和成本优势,在合适的患者中可优先考虑消融治疗;而对于较大的肿瘤,或位于消融高风险区域(如邻近胆囊)的肿瘤,则可能更适合选择外科切除。
对于不适合肝移植、外科切除或消融治疗的患者,2022年BCLC治疗指南推荐在0-A期HCC(最多3个肿瘤,且每个肿瘤最大直径<3 cm)、需要降期治疗的肿瘤,或等待肝移植的患者中采用TACE和TARE(或选择性内放射治疗)。
2025年欧洲肝病学会(EASL)发布的HCC治疗指南为这类患者提出了更为灵活的治疗策略,认为在以下情况下可将体外放射治疗(EBRT)作为一种治疗选择:
对于符合米兰标准的单发病灶患者,若治疗后复发风险较高(肿瘤最大直径>3 cm);或基于肿瘤部位因素;或作为TARE/TACE的替代方案,用于不适合消融或消融后复发、且接受TACE/TARE并发症风险较高的患者(如胆道系统已被细菌定植,增加TACE/TARE后感染和肝脓肿风险)。
曾经仅被视为姑息治疗手段的TARE,如今也被认为在部分患者中具有潜在的根治价值。所谓“以根治为目的”的放射性栓塞,指在经过筛选的局限性HCC患者中(BCLC 0-A期及部分适合90Y肝段切除的BCLC B期患者),实施90Y肝段或肝叶放射性切除,并以高于姑息性90Y治疗的放射强度给药,其主要目标是实现完全且持久的肿瘤清除,治疗理念类似于外科切除或消融,而非单纯的姑息、桥接或降期治疗。
这种以根治为目的的90Y治疗策略亦可应用于其他恶性肿瘤患者,如肝内胆管癌(iCCA)、结直肠癌肝转移(CLM)或其他适合90Y肝段治疗的肝转移瘤,以实现治疗病灶的完全且持久缓解。其根治潜力得益于先进剂量学在临床中的应用进展(即对治疗所需放射剂量的精确计算),这一策略已在随机前瞻性研究(如Dosisphere trial-01研究)中证实疗效,并得到肝移植切除标本中TARE后病理完全缓解证据的支持。目前,TARE已被广泛用于原发性肝肿瘤的治疗,主要应用于HCC。
此外,TARE亦可作为姑息治疗手段,用于改善PFS或肝内PFS。在这类患者中,必须应用先进剂量学技术(即最大化肿瘤照射剂量、最小化正常肝组织照射剂量),以实现恰当的患者筛选和治疗实施。在前瞻性研究中,有10%~15%的姑息治疗患者因剂量限制而不符合该治疗条件。
Abdelsalam ME, Ahrar K, Sheth RA, et al. Interventional oncology: A primer for clinicians on the role of ablation and embolization for solid tumors. CA Cancer J Clin. 2026 Jan-Feb;76(1):e70051.
排版编辑:肿瘤资讯-Marie
重磅综述 | CA(IF 232.4):消融与栓塞在肝内胆管癌治疗中的作用——实体瘤介入治疗(中)
重磅综述 | CA(IF 232.4):消融与栓塞在结直肠癌肝/肺转移治疗中的作用——实体瘤介入治疗(下)











 苏公网安备32059002004080号
苏公网安备32059002004080号


