在备受瞩目的2025年欧洲肿瘤内科学会(ESMO)年会上,DESTINY-CRC02研究的最终分析结果重磅公布(摘要号:737MO)。这项关键的II期临床试验,旨在评估抗体偶联药物(ADC)德曲妥珠单抗(T-DXd)在HER2阳性转移性结直肠癌(mCRC)患者中的疗效与安全性。最终分析结果不仅巩固了德曲妥珠单抗在该领域的治疗地位,更通过长期随访数据,为临床实践提供了更深刻的洞见和更优的剂量选择依据。【肿瘤资讯】特邀福建省肿瘤医院林榕波教授解析这一研究。
专家介绍
福建省肿瘤医院胃肠内科主任医师
福建医科大学硕士生导师、博士生导师
中国抗癌协会肿瘤整体评估专业委员会副主任委员
福建省抗癌协会癌痛专委会主任委员
CSCO第五届理事
CSCO胃癌专家委员会委员;CSCO胃癌诊疗指南执笔人
中国抗癌协会肿瘤靶向治疗专委会常委
中国抗癌协会癌痛整合治疗专委会常委
中国抗癌协会中西整合神经内分泌肿瘤专委会常委
中国抗癌协会癌症康复和姑息治疗专委会常委
2012-2015年援博茨瓦纳公主玛丽娜医院
HER2阳性mCRC——一个亟待突破的治疗领域
人表皮生长因子受体2(HER2)的过表达或扩增,是转移性结直肠癌(mCRC)中一个独特的分子亚型。尽管其在mCRC中的发生率相对较低,约占2%~3%[1],但在标准化疗失败后,HER2已成为一个至关重要的“可操作”治疗靶点,为靶向治疗的应用提供了坚实的理论基础。然而,长期以来,对于经多线治疗的HER2阳性mCRC患者而言,有效的治疗选择依然匮乏。
德曲妥珠单抗的出现,为这一困境带来了曙光。作为一种创新的ADC药物,它由三部分精密构成:靶向HER2的人源化单克隆抗体(曲妥珠单抗)、可裂解的连接子,以及高效的拓扑异构酶I抑制剂(DXd)作为细胞毒性载荷。这种“生物导弹”式的设计,使得德曲妥珠单抗能够精准地将强效化疗药物递送至表达HER2的肿瘤细胞内部,从而在最大化杀伤肿瘤的同时,降低全身性毒副作用。
在DESTINY-CRC02研究之前,I期DESTINY-CRC01研究已初步证实了德曲妥珠单抗的非凡潜力。该研究显示,在经治的RAS野生型HER2阳性mCRC患者中,6.4 mg/kg剂量的德曲妥珠单抗带来了高达45.3%的确认的客观缓解率(cORR),中位无进展生存期(PFS)达到6.9个月[1]。这一令人振奋的结果,为德曲妥珠单抗的后续开发奠定了坚实的循证医学基础。
然而,DESTINY-CRC01的成功也留下了一些关键的临床问题:首先,6.4 mg/kg是否是最佳剂量?在乳腺癌等其他瘤种的研究中,较低的5.4 mg/kg剂量已展现出相似疗效但更优安全性的潜力。其次,德曲妥珠单抗在RAS突变人群中的疗效如何?这是一个预后更差且治疗选择极为有限的患者亚群。为了解答这些问题,更大规模、随机化的DESTINY-CRC02研究应运而生。
DESTINY-CRC02研究设计与初步结果回顾
DESTINY-CRC02[2]是一项全球多中心、随机、双臂II期临床试验,旨在直接比较5.4 mg/kg与6.4 mg/kg两个剂量的德曲妥珠单抗在HER2阳性(IHC 3+,或IHC 2+/ISH+)mCRC患者中的疗效与安全性。研究共纳入122例既往接受过标准治疗的患者,允许RAS突变型患者入组,但排除了BRAF突变的患者。其主要研究终点为盲态独立中心评估(BICR)的cORR。研究设计包含两个阶段:
第一阶段:共80例患者按1∶1的比例随机分配,分别接受每3周一次静脉输注5.4 mg/kg(n=40)或6.4 mg/kg(n=40)的德曲妥珠单抗治疗。
第二阶段:额外入组42例患者,全部进入5.4 mg/kg剂量组进行治疗。这种两阶段设计允许研究者在第一阶段初步评估两个剂量的疗效与安全性后,将更多患者分配到更具潜力的剂量组中,以获得更精确的数据。
在2023年ASCO大会上公布的初步分析结果[2]中,一个看似“反常”却具有重要临床意义的现象出现了:
疗效方面:5.4 mg/kg剂量组的cORR在数值上更优,达到了37.8%,而6.4 mg/kg组为27.5%。
安全性方面:较低剂量组的安全性显著更优,3级及以上治疗相关不良事件(TEAE)的发生率更低,特别是中性粒细胞减少和贫血等血液学毒性。
这一“倒置的剂量-反应曲线”提示,6.4 mg/kg剂量带来的更高毒性可能导致了更频繁的剂量中断、延迟或下调,从而影响了药物的持续暴露和最终疗效。因此,初步分析的结论明确指向:5.4 mg/kg是HER2阳性mCRC治疗中获益-风险比更优的剂量选择。
此外,按HER2表达水平对5.4 mg/kg剂量组进行的亚组分析显示,IHC 3+患者的治疗获益最大,cORR高达46.9%,IHC 2+/ISH+患者仅为5.6%[2]。这提示,HER2表达水平本身可能是德曲妥珠单抗在mCRC中疗效的最强预测生物标志物。基于DESTINY-CRC02及其他两项研究DESTINY-PanTumor02(NCT04482309)和DESTINY-Lung01(NCT03505710)的结果,德曲妥珠单抗(5.4 mg/kg)已在包括美国在内的数个国家获批经治的不可切除或转移性HER2 IHC 3+实体瘤适应症,包括结直肠癌。
2025 ESMO最终分析:长期随访下的新洞见
本次ESMO大会上报告的最终分析[3],是在更长的随访时间(中位随访时间:5.4mg/kg组15.9个月,6.4mg/kg组19.7个月)后得出的结果,它不仅验证了初步结论,更在总生存期(OS)数据上带来了新的洞察。
疗效终点保持稳健,5.4 mg/kg剂量优势依旧
最终分析显示,各项主要疗效指标与初步分析高度一致。5.4 mg/kg剂量组的cORR仍为37.8%,而6.4 mg/kg组为27.5%。缓解持续时间(DoR)和无进展生存期(PFS)在中位数值上也基本持平,分别为5.5个月vs 5.5个月和5.8个月 vs 5.5个月。这些数据再次确认,降低剂量并未牺牲德曲妥珠单抗的核心抗肿瘤活性。
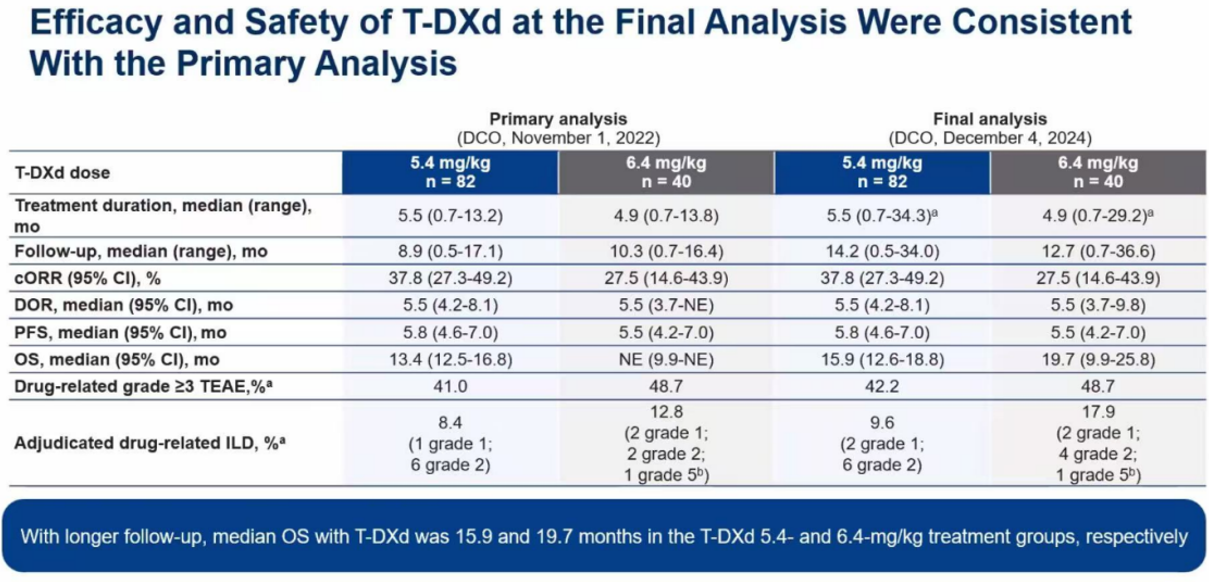
OS数据成熟,引发深入讨论
本次更新的最大亮点是OS数据的成熟。结果显示,5.4 mg/kg剂量组(n=82)的中位OS为15.9个月(95% CI,12.6~18.8个月),而6.4 mg/kg剂量组(n=40)的中位OS达到了19.7个月(95% CI,9.9~25.8个月)。
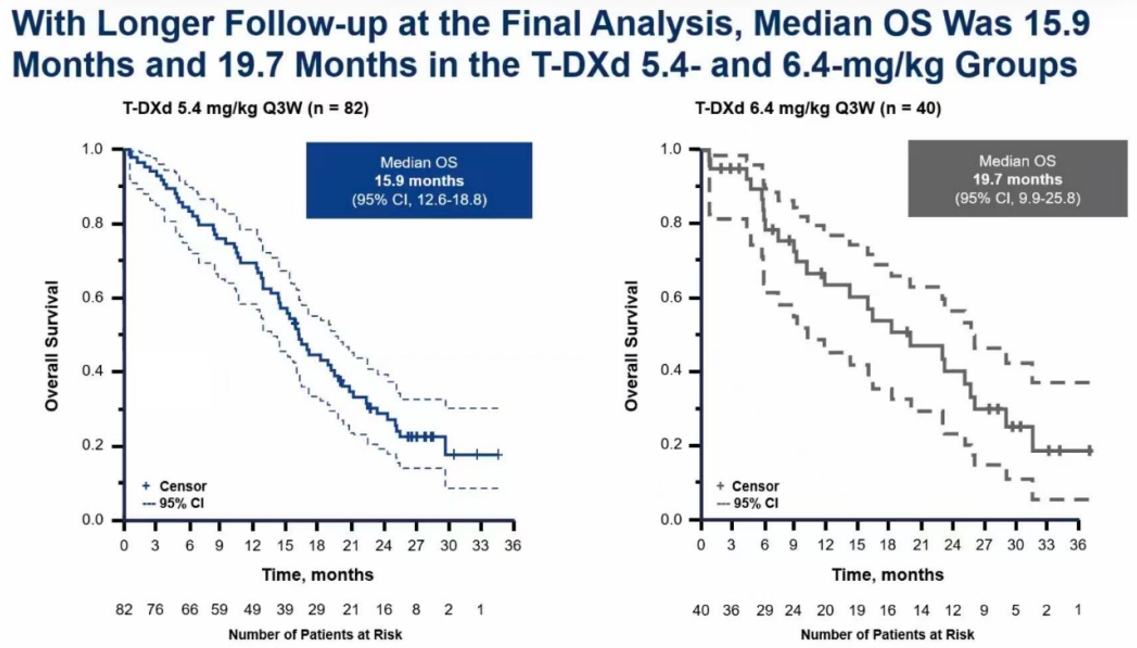
从数据上看,更高剂量组的OS似乎更长,这与初步分析中其他终点得出的结论有所不同。然而,我们必须审慎解读这一结果。首先,该试验并非设计用于直接进行OS的头对头统计学比较。其次,6.4 mg/kg组的样本量较小(n=40),其OS置信区间范围更宽,意味着数据的不确定性更大。此外,在临床试验中,OS会受到后续治疗等多种因素的影响。
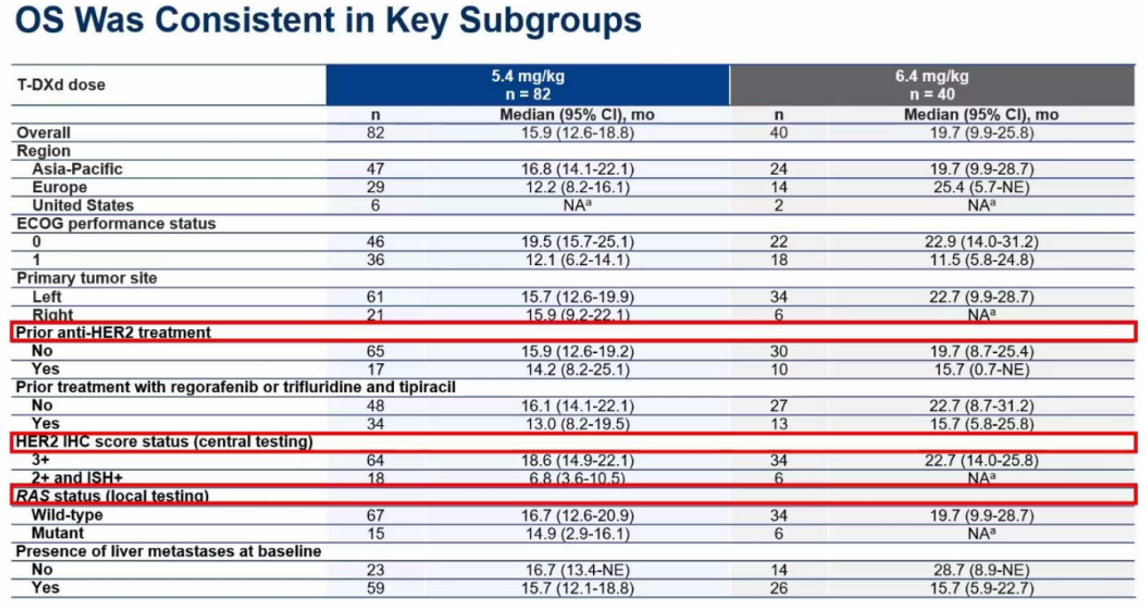
关键亚组分析:疗效的普适性与预测性
OS的亚组分析显示,无论是在RAS野生型还是突变型、既往是否接受过抗HER2治疗、以及HER2 IHC 3+的患者中,德曲妥珠单抗均展现出了一致的生存获益。特别值得注意的是,与初步分析一致,在疗效预测方面,HER2的表达水平(IHC状态)仍然是最强的预测生物标志物。在5.4 mg/kg组中,IHC 3+患者的中位OS长达18.6个月,而IHC 2+/ISH+患者仅为6.8个月。这一发现强烈提示,在临床实践中,应优先考虑将德曲妥珠单抗用于IHC 3+的患者,以实现获益最大化。
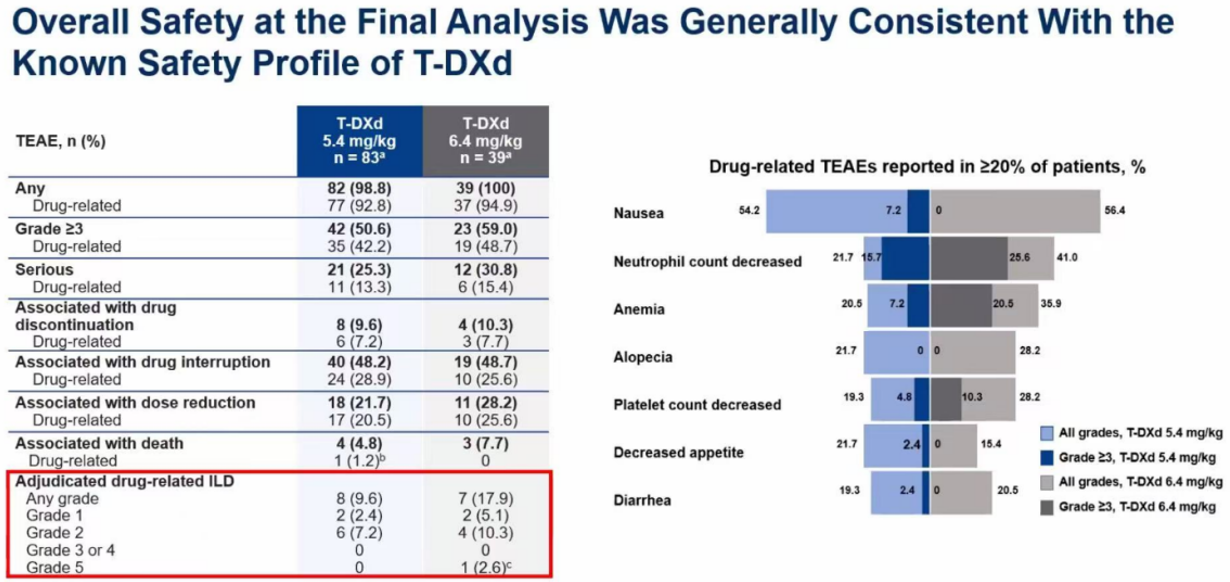
安全性数据再次确认5.4 mg/kg的优越性
最终分析的安全性数据与已知情况完全一致,未发现任何新的安全信号。数据再次确认,5.4 mg/kg剂量的耐受性更佳。其药物相关的3级及以上不良事件发生率为42.2%,低于6.4 mg/kg组的48.7%。
尤其是在德曲妥珠单抗备受关注的特殊不良事件——间质性肺病(ILD)/肺炎上,剂量差异更为关键。5.4 mg/kg组的经裁定药物相关ILD发生率为9.6%,且所有事件均为低级别(1级或2级)。相比之下,6.4 mg/kg组的ILD发生率更高(17.9%)。
结论与临床意义:长期随访验证德曲妥珠单抗卓越疗效,确立5.4 mg/kg为标准剂量
综合疗效、安全性及长期随访数据,DESTINY-CRC02研究最终分析的汇报者明确指出:
最终分析结果与初步分析高度一致,再次证明了单药德曲妥珠单抗在经治HER2阳性mCRC患者中的有效性。
德曲妥珠单抗的安全性特征可控,与既往认知相符,无新的安全问题出现。
德曲妥珠单抗 5.4 mg/kg,作为已获批用于HER2+(IHC 3+)实体瘤的剂量,展现了最佳的获益-风险比。
尽管6.4 mg/kg组在OS数据上显示出较长的趋势,但考虑到其并未带来更高的缓解率和PFS获益,反而伴随着显著增加的严重不良事件乃至死亡风险,5.4 mg/kg无疑是更安全、更合理的临床推荐剂量。这一结论支持将德曲妥珠单抗 5.4 mg/kg(每3周一次)作为经治HER2阳性(尤其是IHC 3+)、无论RAS突变状态如何、以及既往是否接受过抗HER2治疗的mCRC患者的标准治疗方案。
DESTINY-CRC02研究的成功,不仅为晚期结直肠癌患者带来了一种高效的新选择,更通过严谨的剂量探索,为临床实践提供了精准的指导。它标志着ADC药物在消化道肿瘤治疗领域迈出了坚实的一大步,也再次印证了个体化精准医疗在未来的无限潜力。
在全球数据不断充实的同时,针对中国患者的重磅研究也已启动。DESTINY-PanTumor03(NCT06271837)是一项在中国开展的II期、多中心、开放标签研究,旨在评估德曲妥珠单抗在特定HER2表达实体瘤(不包括胃癌和乳腺癌)患者中的疗效与安全性。根据其研究设计,Part 1队列将专门纳入HER2 IHC 3+的实体瘤患者,采用的正是DESTINY-CRC02研究验证的5.4 mg/kg q3w剂量方案。该研究将纳入包括结直肠癌在内的多个瘤种,其结果被寄予厚望,预计将成为支持德曲妥珠单抗在中国获批用于HER2阳性结直肠癌适应症的关键循证依据。随着全球及中国本土重磅数据的相继公布,德曲妥珠单抗必将进一步改写全球HER2阳性结直肠癌的治疗格局。
排版编辑:肿瘤资讯-WJH
[1] Yoshino T, Di Bartolomeo M, Raghav K, et al. Final results of DESTINY-CRC01 investigating trastuzumab deruxtecan in patients with HER2-expressing metastatic colorectal cancer. Nat Commun. 2023;14(1):3332.
[2] Raghav KPS, Siena S, Takashima A, et al. Trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2-overexpressing/amplified (HER2+) metastatic colorectal cancer (mCRC): Primary results from the multicenter, randomized, phase 2 DESTINY-CRC02 study. 2025 ASCO, abstr 3501.
[3] Raghav K, Siena S, Takashima A, et al. Trastuzumab Deruxtecan (T-DXd)in Patients With HER2.Positive (HER2+)Metastatic Colorectal Cancer (mCRC): FinalAnalysis of DESTINY-CRC02, a Randomized, Phase 2 Trial. 2025 ESMO, 737MO.
本篇内容源自北京康盟慈善基金会支持的ESMO专家访谈项目
版权声明











 苏公网安备32059002004080号
苏公网安备32059002004080号


