德曲妥珠单抗(T-DXd)作为一种创新的HER2靶向抗体药物偶联物(ADC),已彻底改变了HER2阳性晚期胃癌的治疗格局。继DESTINY-Gastric系列研究奠定其二线及以上治疗地位后,2025年欧洲肿瘤内科学会(ESMO)大会公布的DESTINY-Gastric04(DG-04)研究最新数据,为巩固其全球二线治疗标准地位提供了更强有力的证据;同时,DESTINY-Gastric06(DG-06)研究的数据也进一步验证了其在中国三线人群中的疗效和安全性。本次访谈浙江省肿瘤医院应杰儿教授将系统梳理德曲妥珠单抗在胃癌领域的循证之路,并重点解析此次ESMO大会报道的最新研究进展。
专家介绍
浙江省肿瘤医院肝胆胰胃内科科主任 主任医师
中国抗癌协会胃部肿瘤整合康复专委会主任委员
中国抗癌协会肿瘤靶向治疗专委会常务委员
中国抗癌协会肿瘤运动康复专委会常务委员
中国抗癌协会营养治疗专委会委员
中国抗癌协会胃癌专委会委员
浙江省抗癌协会肿瘤转移专业委员会主任委员
浙江省抗癌协会肿瘤内科专委会副主任委员
浙江省抗癌协会肿瘤营养专委会副主任委员
浙江省抗癌协会青年理事会副理事长
HER2阳性胃癌的治疗困境
胃癌是全球第五大常见恶性肿瘤,也是第四大癌症相关死亡原因,晚期患者的5年生存率不足10%,预后极差[1]。在东亚地区,尤其是中国,胃癌的疾病负担尤为沉重。在分子分型上,约10%至20%的胃癌患者表现为HER2阳性[2]。HER2的过表达驱动肿瘤增殖,使其成为理想的治疗靶点。
具有里程碑意义的ToGA研究[3]确立了曲妥珠单抗联合化疗作为HER2阳性晚期胃癌的一线标准治疗。近年来,随着免疫疗法的加入,一线治疗方案进一步优化为“靶免化”三联(帕博利珠单抗联合曲妥珠单抗及化疗)[4]。然而,一线治疗后,患者不可避免地会发生疾病进展。在德曲妥珠单抗问世之前,一线治疗失败后的二线及后线治疗选择极为有限,尚无任何HER2靶向疗法被证实能带来生存获益。这一巨大的临床空白,亟需创新疗法来填补。
德曲妥珠单抗的创新机制:高DAR与“旁观者效应”
德曲妥珠单抗的出现,为攻克这一难题带来了曙光。其卓越疗效根植于独特的分子设计。该药由三部分构成:靶向HER2的曲妥珠单抗、一种可被肿瘤细胞内酶切割的稳定连接子,以及一种高效价的拓扑异构酶I抑制剂载荷(DXd)。
德曲妥珠单抗的变革性在于两大关键特征:
高药物抗体比(DAR):其DAR高达8∶1,远超传统ADC,意味着能向肿瘤细胞递送更多的“弹头”。
强大的“旁观者效应”:其细胞毒性载荷DXd具有高细胞膜渗透性。当德曲妥珠单抗被HER2高表达细胞内吞并释放DXd后,DXd不仅能杀伤该细胞,还能穿透细胞膜,扩散并杀伤邻近的、甚至是HER2低表达或不表达的癌细胞。这一机制使其能有效克服胃癌高度的肿瘤异质性,实现更彻底的肿瘤清除。
奠定基石:DESTINY-Gastric系列研究的突破之路
德曲妥珠单抗在胃癌领域的开发策略清晰且高效。首先,关键性的II期DESTINY-Gastric01(DG-01)研究在胃癌高发地区日本和韩国进行。该研究证实,在经多线治疗(≥2线)的HER2阳性晚期胃癌患者中,德曲妥珠单抗相较于标准化疗(伊立替康或紫杉醇单药)显著改善了总生存期(OS)(12.5个月 vs 8.9个月;HR 0.60)和客观缓解率(ORR)(51% vs 14%)[5]。这是首个在此类难治性患者中证实生存获益的HER2靶向疗法随机试验,并直接促成了其在美国的首次批准。
随后,II期DESTINY-Gastric02(DG-02)研究针对西方(北美和欧洲)二线人群开展,采用了单臂设计。该研究成功复现了DG-01的卓越疗效,确认的ORR达到41.8%,中位OS达12.1个月[6]。这项研究的数据支持了德曲妥珠单抗在欧盟的批准。
DESTINY-Gastric06(DG-06)则是针对中国人群的II期“桥接”研究,纳入了既往接受过至少两种治疗方案的中国HER2阳性晚期胃癌患者。在经中心确认HER2阳性全分析集(FAS,n=73)中,独立中心评估(ICR)确认的ORR为28.8%,中位PFS为5.7个月,中位OS为11.1个月[7]。这些关键的本土数据支持了德曲妥珠单抗于2024年8月在中国附条件获批用于HER2阳性胃癌三线及以上治疗。
在II期研究取得巨大成功的基础上,为了确立德曲妥珠单抗在二线治疗中的地位,研发方又发起了DESTINY-Gastric04(DG-04)III期临床试验,旨在将德曲妥珠单抗与当时公认的二线标准治疗方案进行直接比较。这项里程碑式的全球、随机、开放标签的III期研究,纳入了一线含曲妥珠单抗方案治疗后进展的HER2阳性患者,将德曲妥珠单抗与雷莫西尤单抗(RAM)联合紫杉醇(PTX)进行“头对头”比较[8]。
该研究在预设的中期分析中即达到了其主要终点:德曲妥珠单抗在所有关键终点上均显著优于RAM+PTX方案:中位OS 14.7个月 vs 11.4个月(HR 0.70;P=0.004);中位PFS 6.7个月 vs. 5.6个月(HR 0.74;P=0.007);确认的ORR 44.3% vs. 29.1%(P<0.001)[8]。
DG-04研究以最高级别的I级证据,确立了德曲妥珠单抗作为HER2阳性胃癌患者全球二线治疗的新标准。
2025 ESMO重磅更新:DG-04与DG-06最新数据深度解析
在2025年的ESMO大会上,DESTINY-Gastric04和DESTINY-Gastric06研究公布的最新数据,为德曲妥珠单抗的临床应用提供了更深入的见解和更坚实的证据支持。
DESTINY-Gastric04:更稳健的疗效证据与更优的安全性特征
DG-04的最新报告提供了多项关键的额外分析结果,进一步巩固了德曲妥珠单抗的二线标准地位。
OS持续获益
在仅纳入“经中心实验室确认”的HER2阳性患者群体中进行的分析,进一步支持了主要终点结果的稳健性。该群体的中位OS在德曲妥珠单抗组为14.7个月,而在RAM+PTX组为12.2个月(HR=0.71),与主要分析结果(HR=0.70)高度一致[9]。
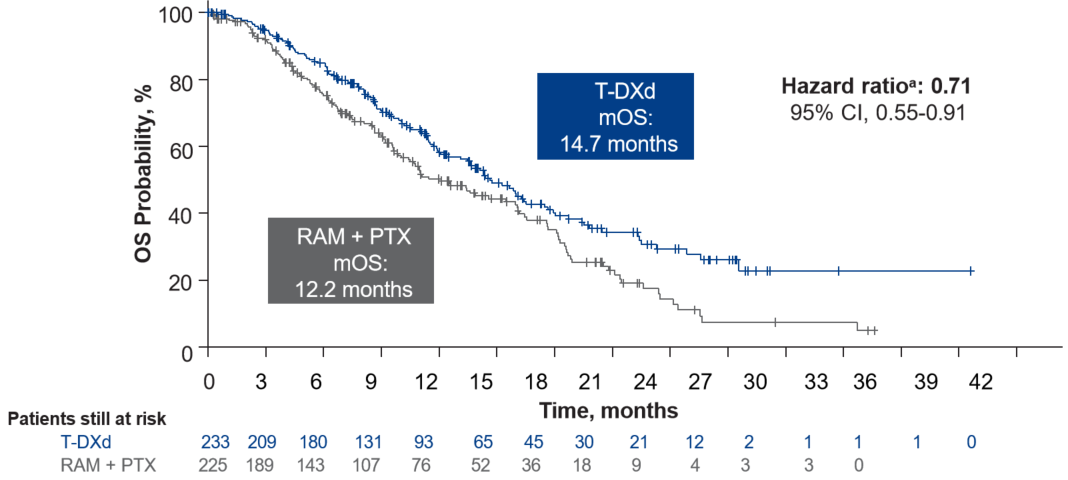
肿瘤缓解更佳
德曲妥珠单抗组观察到更显著的肿瘤缩小。与基线相比,德曲妥珠单抗组靶病灶直径总和的平均百分比变化为-38.7%,而RAM+PTX组为-27.1%;中位数变化分别为-40.0%和-26.7%。这表明德曲妥珠单抗能诱导更深度的肿瘤缓解[9]。
经暴露调整后的安全性更优
由于德曲妥珠单抗组的中位治疗持续时间更长(5.4个月 vs 4.6个月),为了更均衡地比较两个治疗臂的安全性,研究者引入了“每100患者-年暴露调整的发生率(EAIR)”这一指标。结果令人瞩目:德曲妥珠单抗组在多项关键安全性指标上的EAIR均低于RAM+PTX组:≥3级TEAE 230.9 vs 338.0;严重TEAE 89.3 vs 113.0;致死性TEAE 15.1 vs 31.0;导致停药的TEAE 24.3 vs 39.7;导致剂量减少的TEAE 72.2 vs 117.0[9]。
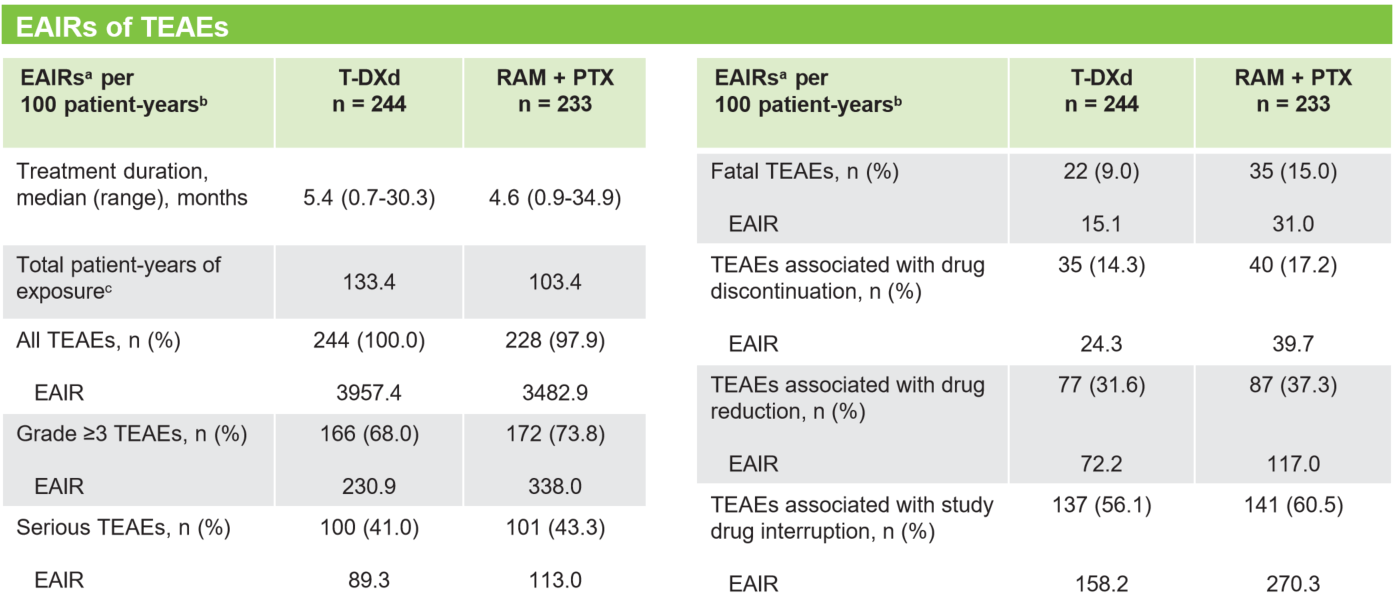
这一分析强有力地表明,尽管德曲妥珠单抗的治疗周期更长,但其严重和致死性不良事件的发生率反而更低,展现了其相较于标准化疗组合更优的长期安全性和耐受性。
患者报告结局(PRO):疗效与生活质量兼得
PRO数据显示,在整个治疗过程中,德曲妥珠单抗组和RAM+PTX组患者的FACT-Ga(癌症治疗功能评价-胃癌)量表评分均保持稳定,未出现具有临床意义的恶化[9]。这一结果证实,德曲妥珠单抗带来的卓越生存获益,并非以牺牲患者的生活质量为代价。
DESTINY-Gastric06:德曲妥珠单抗在中国人群中的应用拓展
DG-06研究在2025 ESMO大会上公布了两项重要的事后分析结果,为德曲妥珠单抗在中国特定人群中的应用提供了关键答案。
德曲妥珠单抗在经多线抗HER2治疗的复杂人群中依然高效
DG-06研究中包含了一部分基线特征更为复杂的患者,他们不仅接受过曲妥珠单抗治疗,还接受了其他HER2靶向治疗(如维迪西妥单抗、KN026、吡咯替尼等)。这项事后分析旨在评估德曲妥珠单抗在这一经多重治疗(72.7%的患者既往接受过≥3线治疗)的难治群体(n=22)中的疗效[10]。
结果显示,德曲妥珠单抗在该亚组中依然展现出强大的抗肿瘤活性。经独立中心审查(ICR)确认的ORR为31.8%,中位PFS为5.9个月,中位OS更是达到了14.5个月。这些数据与DG-06研究的整体人群(FAS)疗效“基本一致”,甚至更优(FAS人群确认的ORR 28.8%,中位PFS 5.7个月,中位OS 11.1个月)[10]。
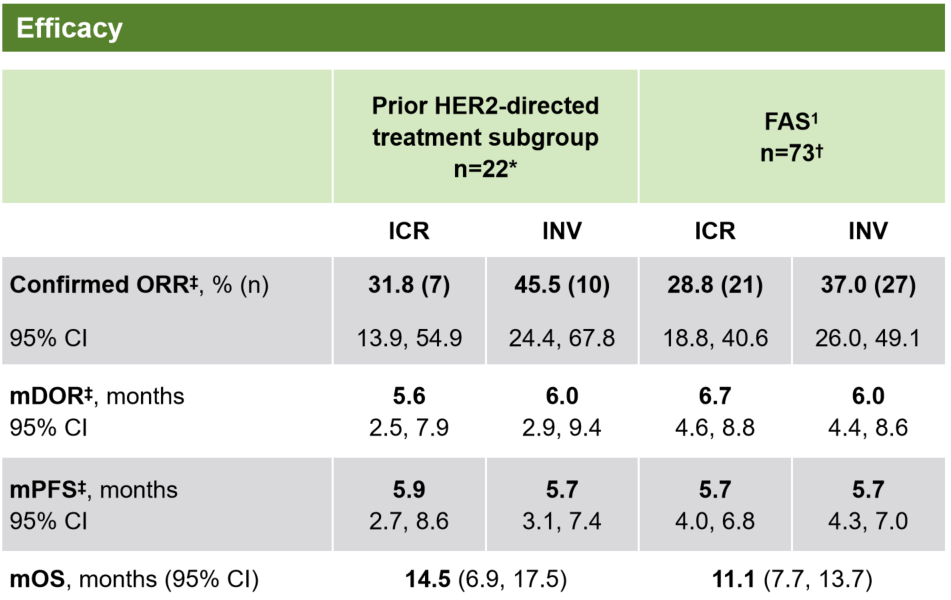
值得注意的是,在这22例经多线HER2靶向治疗的患者中,未报告(0例)经判定的药物相关ILD/肺炎事件[10]。
这一事后分析的意义重大,它提供了关键证据,表明德曲妥珠单抗对于既往接受过多种HER2靶向治疗的中国患者,仍然是一个高效安全的治疗选择。
德曲妥珠单抗在经选择的乙肝病毒(HBV)感染者中仍可安全使用
中国是乙型肝炎病毒(HBV)高发区,德曲妥珠单抗作为一种ADC,其化疗载荷是否会像传统化疗一样导致HBV再激活,是临床医生高度关注的安全问题。DG-06研究允许符合严格标准(如HBV DNA <2000 IU/ml等)的既往/已痊愈HBV感染或非活动性慢性HBV感染患者入组,但要求HBsAg阳性患者等在入组前至少7天接受了预防性抗病毒治疗,并在研究期间接受了严密监测[11]。
在纳入分析的19例HBV感染者中(17例既往/已痊愈,2例非活动性慢性),中位治疗时间为2.8个月,无一例(0例)发生HBV再激活事件。该亚组的总体安全性特征与DG-06的整体人群一致。在治疗和随访期间,仅发生1例1级ILD事件。在2例HBeAg阳性、抗HBc阳性、HBeAg阴性的患者中,未发生肝胆相关不良事件[11]。
尽管样本量有限,但这是德曲妥珠单抗在该特殊人群中的首批前瞻性安全数据,表明德曲妥珠单抗在伴有既往或非活动性HBV感染的患者中具有较低的HBV再激活风险,在严格监测和规范管理下可安全使用。
重塑标准,定义未来
德曲妥珠单抗的研发历程是胃癌靶向治疗的典范。从DG-01、DG-02和DG-06研究证实其在二线及以上治疗的显著疗效,到DG-04在III期研究中战胜强效活性对照组、确立二线治疗新标准,德曲妥珠单抗已从根本上改变了HER2阳性胃癌的治疗路径。
2025 ESMO大会公布的最新数据,为这一变革性药物的临床应用提供了更深入的证据支持。DG-04的额外分析(EAIR和PRO)不仅再次印证了其卓越疗效的稳健性,更揭示了其在长期应用中具有优于标准化疗的、可控的安全性特征。而DG-06的事后分析则拓展了德曲妥珠单抗的临床应用场景,证实了其在经多线HER2靶向治疗失败后以及在HBV感染这一特殊人群中的高效性和安全性。
德曲妥珠单抗凭借其在胃癌二线及以上治疗中的卓越疗效,正加速向一线治疗领域迈进。目前,Ib/II期DESTINY-Gastric03(NCT04379596)研究正积极探索德曲妥珠单抗联合化疗、免疫疗法等多元组合的协同潜力。初步结果显示,德曲妥珠单抗联合氟尿嘧啶类药物±帕博利珠单抗的方案已展现出令人鼓舞的抗肿瘤活性。
为进一步确证其一线治疗价值,关键性的III期DESTINY-Gastric05研究(NCT06731478)已启动。该研究将头对头比较德曲妥珠单抗+化疗+帕博利珠单抗与曲妥珠单抗+化疗+帕博利珠单抗两大方案,用于HER2阳性胃癌患者一线治疗的疗效与安全性。这些前瞻性的探索若能取得阳性结果,无疑将为全球HER2阳性胃癌患者带来更优越的一线治疗新选择。
排版编辑:肿瘤资讯-WJH
[1] Casamayor M, Morlock R, Maeda H, Ajani J. Targeted literature review of the global burden of gastric cancer. Ecancermedicalscience. 2018;12:883.
[2] Kim WH, Gomez-Izquierdo L, Vilardell F, et al. HER2 status in gastric and gastroesophageal junction cancer: results of the large, multinational HER-EAGLE study. Appl Immunohistochem Mol Morphol. 2018;26(4):239-245.
[3] Bang YJ, van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010;376(9742):687-697.
[4] Janjigian YY, Kawazoe A, Bai Y, et al. Final overall survival for the phase III, KEYNOTE-811 study of pembrolizumab plus trastuzumab and chemotherapy for HER2+ advanced, unresectable or metastatic G/GEJ adenocarcinoma. Ann Oncol. 2024;35(suppl_2):S877-S878.
[5] Yamaguchi K, Bang YJ, Iwasa S, et al. Trastuzumab deruxtecan (T-DXd; DS-8201) in patients with HER2-positive advanced gastric or gastroesophageal junction (GEJ) adenocarcinoma: Final overall survival (OS) results from a randomized, multicenter, open-label, phase 2 study (DESTINY-Gastric01). 2021 ASCO, abstr 4048.
[6] Ku GY, Bartolomeo MD, Smyth E, et al. Updated analysis of DESTINY-Gastric02: A phase II single-arm trial of trastuzumab deruxtecan (T-DXd) in western patients (Pts) with HER2-positive (HER2+) unresectable/metastatic gastric/gastroesophageal junction (GEJ) cancer who progressed on or after trastuzumab-containing regimen. 2022 ESMO, 1205MO.
[7] Shen L, Chen P, Lu J, et al. Trastuzumab deruxtecan (T-DXd) in Chinese patients (pts) with previously treated HER2-positive (HER2+) advanced gastric or gastroesophageal junction adenocarcinoma (GEJA): DESTINY-Gastric06 (DG-06) final analysis. 2022 ESMO, 129MO.
[8] Shitara K, Gümüs M, Pietrantonio F, et al. Trastuzumab deruxtecan (T-DXd) vs ramucirumab (RAM) + paclitaxel (PTX) in second-line treatment of patients (pts) with human epidermal growth factor receptor 2-positive (HER2+) unresectable/metastatic gastric cancer (GC) or gastroesophageal junction adenocarcinoma (GEJA): Primary analysis of the randomized, phase 3 DESTINY-Gastric04 study. 2025 ASCO, LBA4002.
[9] Pietrantonio F, Van Cutsem E, Shen L, et al. Trastuzumab Deruxtecan (T-DXd) vs Ramucirumab (RAM) Plus Paclitaxel (PTX) in Second-Line (2L) Treatment of Patients (Pts) With HER2+ Unresectable/Metastatic Gastric Cancer (GC)/Gastroesophageal Junction Adenocarcinoma (GEJA): Additional Data From DESTINY-Gastric04. 2025 ESMO, 2099P.
[10] Peng Z, Liu Y, Yang J, et al. Trastuzumab Deruxtecan in Patients With HER2+ Gastric Cancer or Gastroesophageal Junction Adenocarcinoma Who Received Prior Anti-HER2 Treatment Other Than / in Addition to Trastuzumab in DESTINY-Gastric06. 2025 ESMO, 2105P.
[11] Shen L, Liang X, Lu J, et al. Risk of HBV Reactivation in Patients With Past or Resolved HBV or Inactive Chronic HBV Infection Treated With Trastuzumab Deruxtecan in the DESTINY-Gastric06. 2025 ESMO, 2175P.
本篇内容源自北京康盟慈善基金会支持的ESMO专家访谈项目
版权声明











 苏公网安备32059002004080号
苏公网安备32059002004080号


