2025年国际慢性淋巴细胞白血病研讨会(iwCLL 2025)于9月12日-15日在波兰克拉科夫拉开序幕。大会聚集全球顶尖学者,持续更新慢性淋巴细胞白血病(CLL)相关研究进展。此次会议中,中国学者携多项独立研究成果惊艳亮相,聚焦CLL的病理生理机制、分子图谱与代谢重编程、临床特征与预后分析及创新疗法等方面。这些研究不仅彰显了中国科研力量的崛起,更印证了中国原研药物如泽布替尼等在提升疗效、改善生存方面的全球价值,为CLL的临床实践带来了来自中国的权威证据与智慧启示。【肿瘤资讯】特汇总2025 iwCLL大会中国学者独立开展的相关研究内容,并邀请中国医学科学院血液病医院 (中国医学科学院血液学研究所)易树华教授、江苏省人民医院(南京医科大学第一附属医院)朱华渊教授对其进行点评,详情如下。
东方智光,闪耀国际舞台·ORAL
摘要号1020:KRAS^G13D-Dependent PI3K/AKT Signaling Regulates Fatty Acid Oxidation in Chronic Lymphocytic Leukemia
中文标题:KRAS^G13D 依赖性 PI3K/AKT 信号通路调控CLL中的脂肪酸氧化
汇报人:Jun Ma
单位:山东第一医科大学附属省立医院
关键信息
本研究旨在阐明KRAS G13D突变在CLL发病过程中的功能影响及其通过PI3K/AKT/mTOR通路调控脂肪酸代谢的机制。另外,研究者还评估了KRAS与PI3K双靶向治疗策略在CLL中的疗效。结果显示,在所有CLL样本中,KRAS突变率为3.71%,其中G13D是最常见亚型(占29.13%)。该突变能显著促进细胞增殖、增强脂肪酸氧化(FAO)并激活线粒体呼吸。机制上,KRAS G13D直接结合并上调PI3K-C2α,进而激活AKT/mTOR信号通路。尽管KRAS G13D突变细胞对PI3K抑制剂相对耐药,但PI3K抑制剂联合KRAS抑制剂可协同抑制细胞增殖并克服耐药性。
主要研究结论
KRAS G13D突变通过直接结合PI3K-C2α并激活PI3K/AKT/mTOR通路,驱动CLL的代谢重编程和疾病进展。上述研究结果为临床上联合使用KRAS与PI3K抑制剂治疗该突变型CLL患者提供了强有力的支持。
摘要号1119:MYD88 Mutations in Chronic Lymphocytic Leukemia Exhibit Distinct Biological Behaviors and Prognostic Implications
中文标题:MYD88 突变在CLL中呈现独特的生物学行为及预后意义
汇报人:Yuting Yan
单位:中国医学科学院血液病医院 (中国医学科学院血液学研究所)
关键信息
本研究旨在描绘伴MYD88突变(MYD88MUT)中国CLL患者的临床特征及该突变对于患者预后的意义。通过对1081例患者进行测序,发现MYD88突变率为12.86%,最常见亚型为L265P(41.7%)和V217F(35.3%)。与野生型(MYD88WT)患者相比,MYD88MUT患者具有独特的生物学特征,包括男性居多、IGHV突变率极高(95.0%)、伴随单克隆球蛋白血症且极少伴有Del(17p)、Del(11q)等高危遗传学异常。另外,无论接受靶向治疗、免疫化疗或单纯化疗,MYD88MUT患者均展现出优异的长期生存结果(所有治疗组5年无进展生存率[PFS] >90%,10年总生存率[OS ]>70%),且相关生存优势在IGHV突变组中依然显著。
主要研究结论
伴MYD88突变的CLL患者表现出独特的生物学特征,并且无论采用何种治疗方式,其生存预后均较为出色。
摘要号1120:Serum LC-MS based untargeted metabolomics machine learning for distinguishing asymptomatic and symptomatic CLL/SLL and predicting TTFT
中文标题:基于血清 LC-MS 的非靶向代谢组学结合机器学习区分无症状与有症状 CLL/SLL患者并预测治疗启动时间
汇报人:朱华渊,Luomengjia Dai
单位:江苏省人民医院(南京医科大学第一附属医院)
关键信息
本研究采用液相色谱-质谱联用(LC-MS)非靶向代谢组学技术,对183例初治CLL/小淋巴细胞淋巴瘤(SLL)患者(无症状组:70例、有症状组:113例)的血清样本进行分析,系统探索疾病进展中的代谢重编程规律及其临床价值。研究显示,有症状组的男性(67.26% vs 51.43%, p=0.033)、β2微球蛋白水平升高(65.14% vs 13.24%, p<0.001)、IGHV未突变(82.35% vs 51.38%, p<0.001)及SF3B1突变(14.00% vs 1.82%, p=0.014)的患者比例均显著更高。研究者共鉴定出1157种血清代谢物,其中51种在CLL/SLL疾病进展中发生显著变化(37种上调、17种下调)。基于机器学习算法,研究构建了由5种代谢物组成的诊断模型(含磷酸氢盐、核黄素四丁酸酯等),在测试集中表现出高区分效能;进一步基于11种代谢物构建的预后特征,能有效预测无症状CLL/SLL患者的疾病进展风险。
主要研究结论
本研究通过大样本血清代谢组学分析揭示CLL/SLL疾病进展中存在显著的代谢重编程。而基于代谢物组合构建的机器学习模型不仅可高精度区分早期与进展期CLL/SLL患者,还能对无症状患者进行危险分层,为CLL/SLL的早期诊断、预后评估及精准干预提供了新型非侵入性标志物和策略。
摘要号1203:SF3B1 K700E Mutation Promotes SAT1-Mediated Metabolic Reprogramming and Suppresses T-cell Immune Response in Chronic Lymphocytic Leukemia
中文标题:SF3B1 K700E 突变可促进CLL中SAT1介导的代谢重编程并抑制 T 细胞免疫应答
汇报人:Hao Guo
单位:郑州大学附属肿瘤医院(河南省肿瘤医院)
关键信息
本研究探讨了SF3B1 K700E突变通过调控多胺代谢关键酶SAT1的表达,驱动CLL中代谢重编程和免疫抑制的机制。通过RNA测序、代谢组学(LC-MS/MS)及功能实验发现,SF3B1突变引起SAT1外显子4跳跃和mRNA稳定性增加,导致SAT1表达上升,进而促进多胺代谢物N1-乙酰精胺积累,并激活谷氨酰胺代谢和氧化磷酸化通路。体内外实验表明,SAT1过表达可增强CLL细胞增殖、克隆形成能力和白血病浸润(脾脏/肝脏增大),并通过组蛋白H3K27乙酰化激活IL18BP启动子,增加IL18BP分泌,抑制CD8+ T细胞功能和IFN-γ产生,诱导免疫抑制微环境。
主要研究结论
SF3B1 K700E突变通过上调SAT1表达,双重调控CLL中多胺代谢重编程和表观遗传介导的免疫逃逸机制。而靶向SAT1可能成为逆转SF3B1突变型CLL免疫抑制微环境、增强T细胞免疫疗效的新型治疗策略。
摘要号1204:EGR2 Hotspot Mutations Drive BTKi Resistance in Chronic Lymphocytic Leukemia via CD27-CD70 Interaction-Mediated T-Cell Exhaustion
中文标题:EGR2 热点突变通过 CD27-CD70 相互作用介导的 T 细胞耗竭驱动CLL的 BTK 抑制剂耐药
汇报人:Dan Yang
单位:江苏省人民医院(南京医科大学第一附属医院)
关键信息
本研究系统性地揭示了中国CLL患者中EGR2突变的临床特征、分子机制及预后价值。通过对297例初治CLL患者的分析,发现EGR2突变率为9.8%,其中p.E356K(75.6%)、p.H384(13.8%)和p.D411(10.3%)为热点突变,中位变异等位基因频率(VAF)为47%。EGR2突变患者呈现年轻化(中位诊断年龄:50岁 vs 57岁,p<0.001)、更高Binet C分期比例(52.4% vs 25.2%)、高频合并del(11q)(51.9% vs 15.4%)、ATM突变(55.2% vs 19.0%)及复杂核型(31.0% vs 13.6%),且IGHV未突变的患者比例极高(93.1%)。在113例接受持续BTK抑制剂单药治疗的患者中,EGR2突变组中位PFS显著缩短(30.1 vs 84.1个月,p<0.001),Richter转化(RT)风险显著升高(23.1% vs 1.0%)。单细胞测序分析发现,EGR2 p.E356K突变患者出现外周血中衰竭T细胞的比例更高(初治时20.54% vs 10.53%,耐药后31.02% vs 18.93%),且CD27-CD70配体-受体交互增强;ChIP-seq证实EGR2通过结合RelA(p65) motif激活NF-κB通路。
主要研究结论
EGR2热点突变(尤其是p.E356K)是中国CLL患者的独立不良预后标志,其通过增强CD27-CD70信号轴促进CD8+ T细胞衰竭,并通过直接激活NF-κB通路驱动BTK抑制剂耐药和疾病进展,为靶向免疫微环境及联合NF-κB抑制剂提供了理论依据。
摘要号1603:Single-cell transcriptome analysis reveals molecular mechanism of stem-like cells in Richter Transformation
中文标题:单细胞转录组测序揭示 RT中干性样细胞的分子机制
汇报人:Ziyuan Zhou
单位:江苏省人民医院(南京医科大学第一附属医院)
关键信息
本研究通过单细胞RNA测序(scRNA-seq)技术对12例淋巴瘤患者的淋巴结样本(包括7例克隆相关RT-DLBCL、2例CLL及3例正常对照)的80,253个细胞进行分析,构建了RT细胞的分化轨迹并揭示其驱动机制。研究发现RT组织中髓系细胞比例显著高于CLL及正常对照,提示微环境免疫细胞参与RT进程;RT细胞表现出最复杂的拷贝数变异(CNV)特征,且CNV评分与E2F靶点、G2M检查点、MYC信号、NOTCH信号、PI3K/AKT/mTOR通路及凋亡等多种关键通路活性呈正相关。代谢重编程分析显示,RT细胞中氧化磷酸化、糖酵解及TCA循环显著激活。通过CytoTRACE2和伪时间分析,研究鉴定出RT细胞中存在一个高干性亚群(状态8),其基因富集于MYC信号、细胞周期、氧化磷酸化和mTORC1通路,并发现BIRC5(survivin)在该干性亚群中特异性高表达。
主要研究结论
本研究在单细胞层面解析了RT的细胞异质性与分化轨迹,鉴定出一个具有高干性特征的肿瘤细胞亚群作为RT发生与发展的起源。该亚群通过激活BIRC5表达及代谢重编程驱动肿瘤增殖与耐药,为RT的靶向治疗提供了新的理论依据和干预策略。
摘要号1802:Targeting SF3B1 Disrupts Chronic Lymphocytic Leukemia Survival via PFKFB-mediated Glycolytic Dependency
中文标题:靶向 SF3B1 通过 PFKFB 介导的糖酵解依赖性破坏CLL细胞存活
汇报人:Hao Guo
单位:郑州大学附属肿瘤医院(河南省肿瘤医院)
关键信息
本研究探讨了靶向野生型SF3B1(剪接因子)在CLL中的治疗潜力。结果显示,h3b-8800对各类CLL模型均显示强效细胞毒性,原代细胞、MEC-1细胞及JVM3细胞的48小时IC50值分别为31.1 nM、32.55 nM及68.85 nM。转录组分析发现,h3b-8800通过SF3B1依赖的剪接调控导致PFKFB1(糖酵解抑制因子)表达下调78.6%,而PFKFB3(糖酵解激活因子)表达上调186%;代谢检测表明h3b-8800处理显著降低葡萄糖摄取(50μM时减少20.7%,100μM时减少32.7%)和乳酸分泌(50μM时减少43.5%,100μM时减少49.1%)。
主要研究结论
野生型SF3B1通过调控PFKFB1/PFKFB3平衡在CLL糖代谢中发挥关键作用;无论突变状态,剪接调节剂h3b-8800可通过重编程糖代谢通路显著抑制CLL细胞生长,这一研究成果为CLL患者提供了靶向SF3B1的新型治疗策略。
东方之声,助力CLL诊疗发展·POSTER
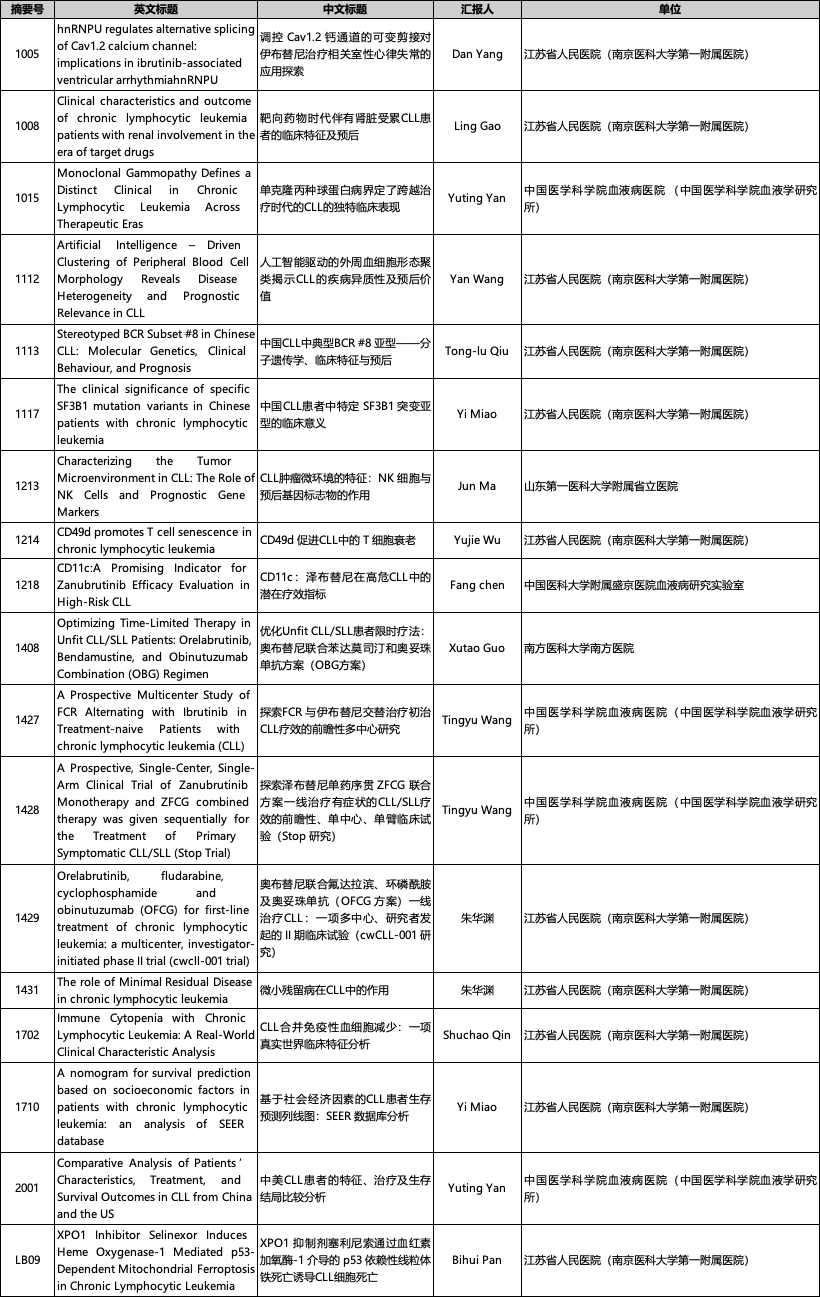
专家点评
https://www.iwcll2025.org/PosterTitles.asp?PosterSortOrder=num&pfp=BrowsebyPosterNumber.
排版编辑:肿瘤资讯-kk











 苏公网安备32059002004080号
苏公网安备32059002004080号


