EGFR突变非小细胞肺癌(NSCLC)在精准肿瘤学领域占据着极为重要的地位,约50%的亚洲NSCLC患者存在EGFR突变[1]。针对EGFR敏感突变NSCLC患者,EGFR酪氨酸激酶抑制剂(TKI)是其标准一线治疗方案,已经显著改善了患者的预后。然而,如何进一步提升该类患者的总生存期(OS)并改善高危患者的临床获益仍是临床关注的关键话题。此外,由于三代EGFR-TKI单药治疗后耐药机制具有高度异质性和复杂性,使得该类患者二线治疗机会受限,临床也亟需新机制的药物,为患者提供更多样的一线治疗选择。MARIPOSA研究中,EGFR/MET双特异性抗体埃万妥单抗以其独特的作用机制充分凸显其治疗价值。近日,埃万妥单抗联合兰泽替尼获中国国家药品监督管理局(NMPA)批准,用于一线治疗EGFR 19号外显子缺失或21号外显子L858R置换突变NSCLC。此次埃万妥单抗新适应症的获批有望重塑EGFR敏感突变NSCLC一线标准治疗新格局,基于此,【肿瘤资讯】特邀四川大学华西医院医院王永生教授解读MARIPOSA研究。
华西医院肿瘤中心副主任/临床研究部副部长
华西医院创新药物临床研究与评价国家药监局重点实验室主任
四川省卫生健康首席专家、卫健委学术技术带头人
中国抗癌协会中西整合控瘤新药研究专委会主任委员
中国医药生物技术协会临床研究专委会副主任委员
中国临床肿瘤学会(CSCO)免疫治疗专家委员会常务委员
中国临床肿瘤学会(CSCO)患教专委会常务委员
四川省医师协会第一届药物临床试验研究者分会会长
四川省医促会肿瘤学MDT分会会长
多重突破,MARIPOSA研究给患者带来更持久的疗效和更长的生存
埃万妥单抗是一种靶向EGFR及MET的全人源双特异性抗体,可通过3种潜在的作用机制激发其抗肿瘤活性:配体阻断、受体降解和免疫细胞导向活性[2]。兰泽替尼是一款第三代EGFR-TKI,可以精准靶向T790M突变以及激活型EGFR突变Ex19del和L858R[3]。三代EGFR-TKI奥希替尼一线治疗最常见耐药机制为MET扩增与EGFR C797S突变[4]。埃万妥单抗联合兰泽替尼通过胞内胞外深度抑制EGFR和MET通路,协同特异性免疫系统激活杀伤肿瘤细胞,并且EGFR的协同抑制可能产生更有效的肿瘤通路抑制(图1)。
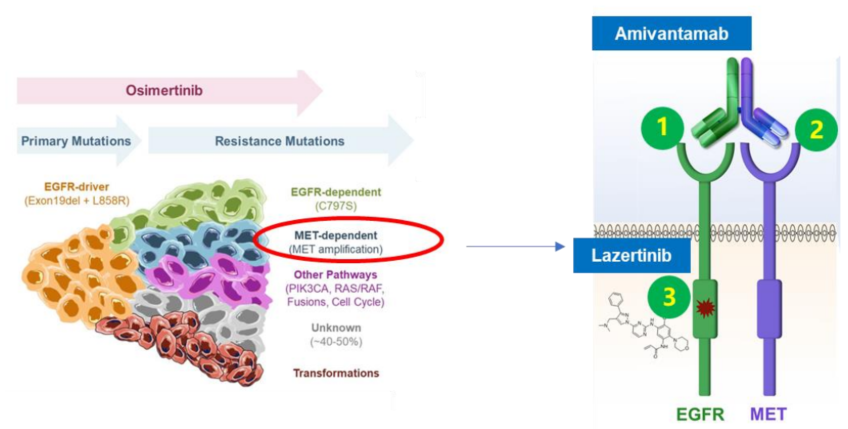
此外,埃万妥单抗联合兰泽替尼实现了“Chemo-free”,为不可耐受化疗/拒绝化疗的患者提供一种新的治疗模式。因此,埃万妥单抗联合兰泽替尼有望在EGFR敏感突变NSCLC一线治疗的疗效和安全性实现双重提升。I期CHRYSALIS研究已证明埃万妥单抗联合兰泽替尼在初治和奥希替尼耐药后的EGFR突变NSCLC中联合应用的初步疗效[5,6]。
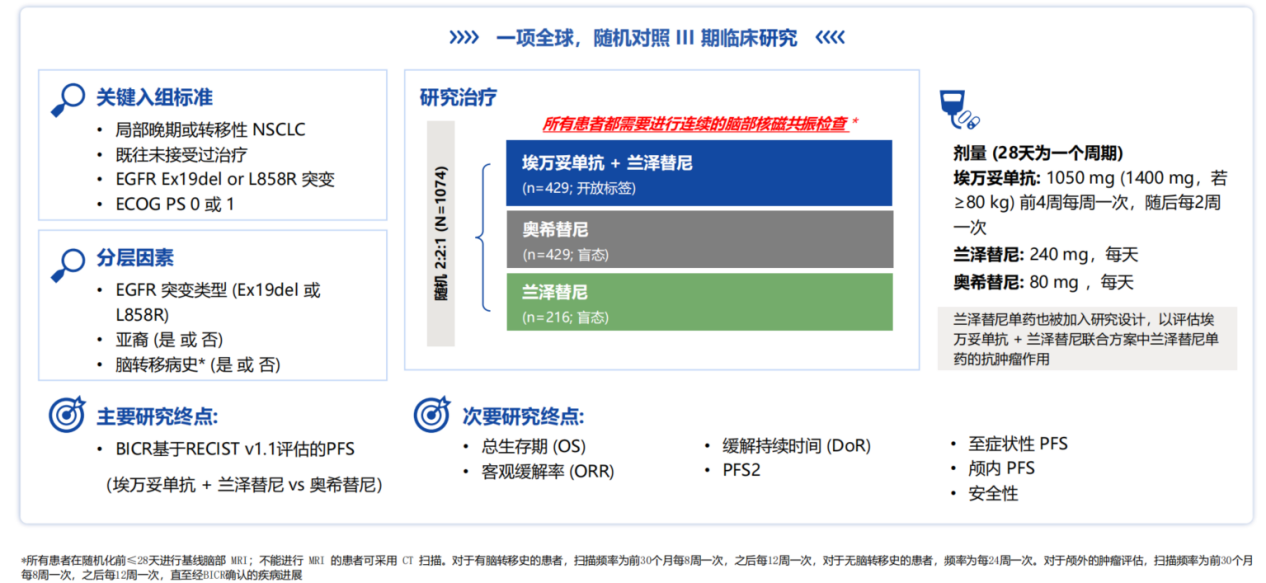
MARIPOSA研究[7]是一项全球III期随机对照研究,共纳入1074例初治EGFR Ex19del/L858R突变局部晚期或转移性NSCLC患者,旨在对比埃万妥单抗+兰泽替尼、奥希替尼单药及兰泽替尼单药的疗效(图2)。研究的主要终点是盲法独立中央审查(BICR)基于RECIST v1.1评估的无进展生存期(PFS),关键次要终点是OS。研究的分层因素包括EGFR突变类型(Ex19del或L858R),是否亚裔以及是否具有脑转移病史。
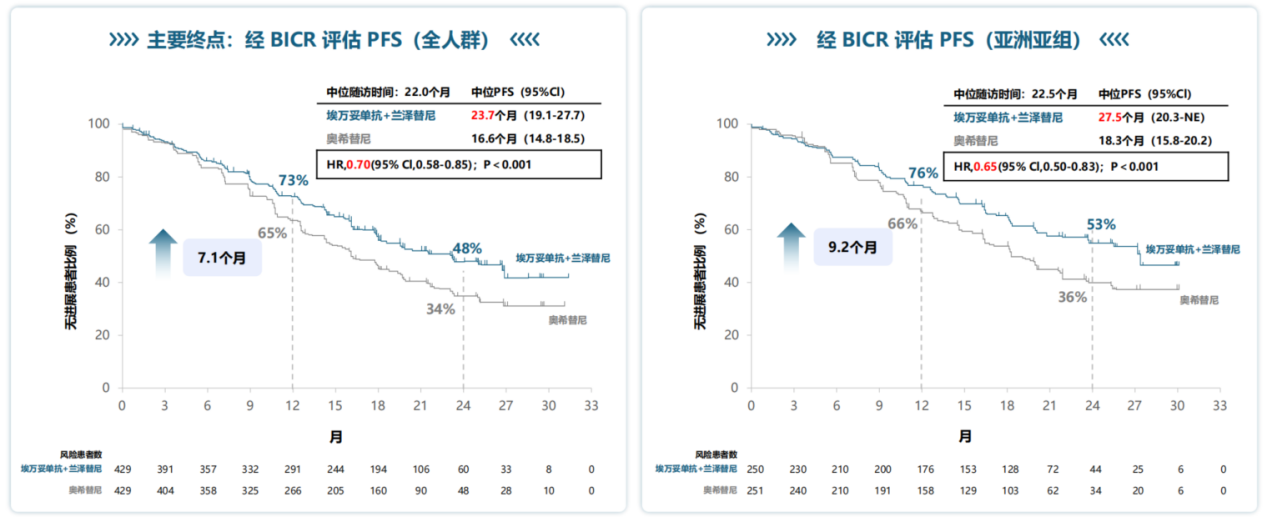
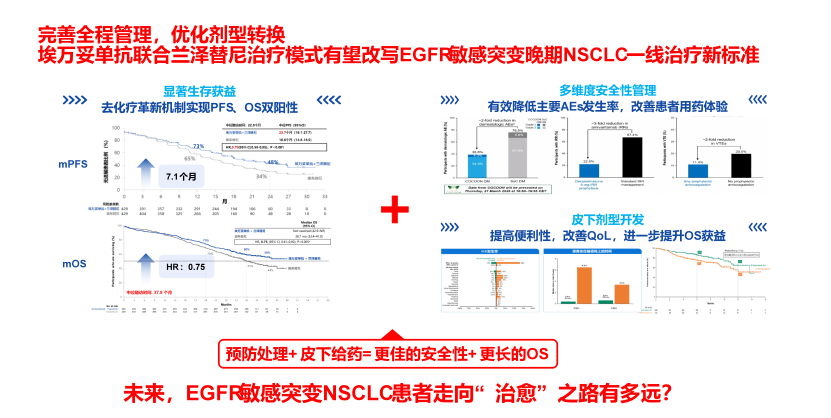
MARIPOSA研究的主要终点数据发表在The New England Journal of Medicine[7],引起了肿瘤学界的广泛关注。研究结果显示,对比奥希替尼单药组,埃万妥单抗联合兰泽替尼组的中位PFS显著延长(23.7个月 vs. 16.6个月;P<0.001),疾病进展或死亡风险降低30%(图3)。亚洲人群的疗效和全人群相一致,并且亚洲人群mPFS在数值上显示更长的获益趋势,达到27.5个月(图3)[8]。
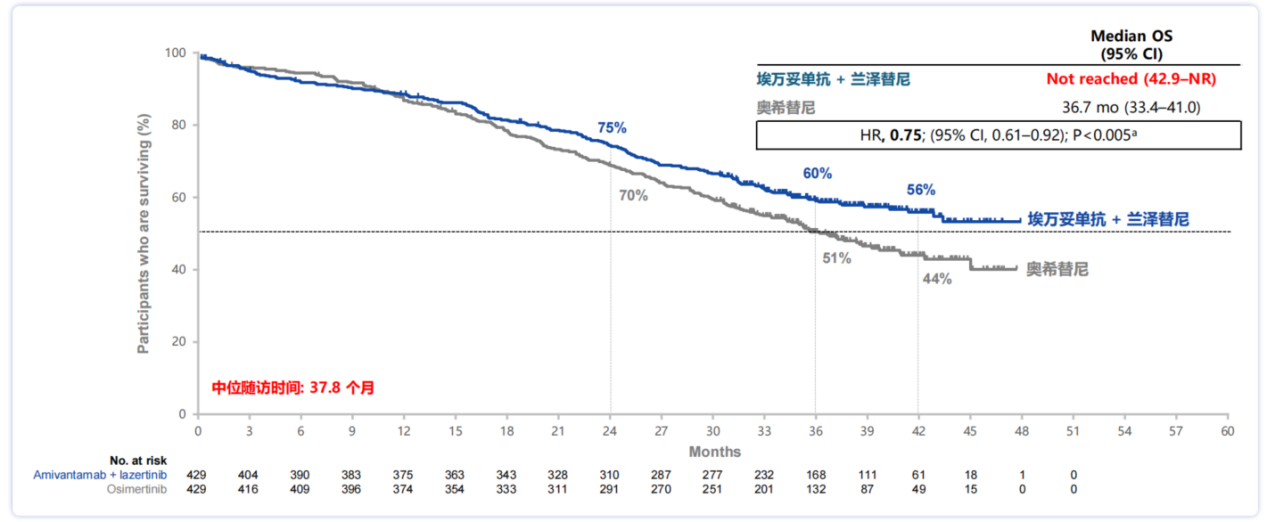
2025 ELCC会议公布了其最新的OS数据[9]。研究结果显示,中位随访37.8个月时,埃万妥单抗联合兰泽替尼组的OS较奥希替尼组明显改善,可显著降低死亡风险25%(HR=0.75,P<0.005)。相较于奥希替尼组中位OS为36.7个月,埃万妥单抗联合兰泽替尼的中位OS尚未达到,改善预计超过一年(图4),并且生存曲线呈现“长拖尾”效应。与目前的奥希替尼单药标准治疗方案相比,埃万妥单抗联合兰泽替尼组的OS得到了临床意义和统计学意义的双重改善,这是首个相比奥希替尼单药治疗有总生存获益的方案。
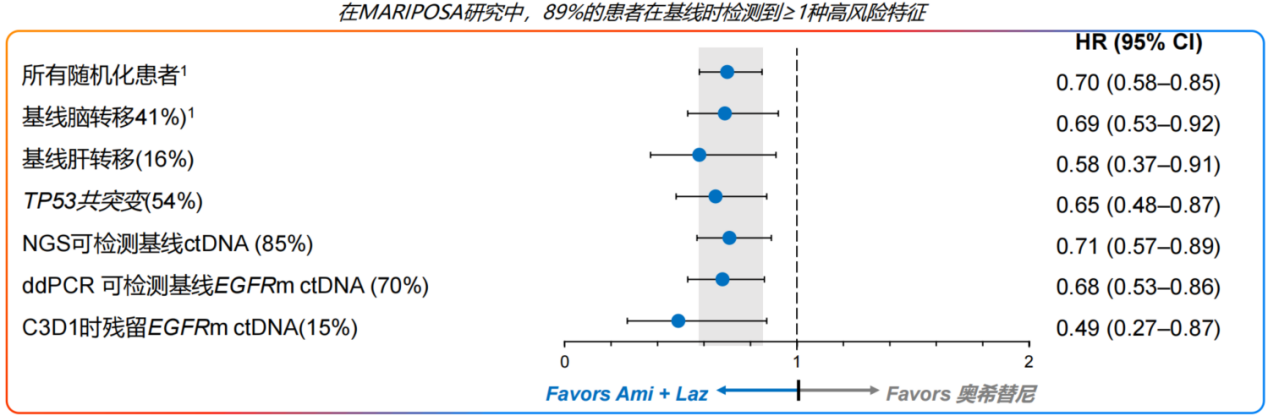
此外,值得关注的是,在MARIPOSA研究中,89%的患者在基线时检测到≥1种高风险特征。但是在具有高危特征的各亚组(基线脑转移、基线肝转移、基线TP53共突变和ctDNA阳性)中,埃万妥单抗联合兰泽替尼相较于奥希替尼单药也有显著优势,不仅可以显著改善PFS,且在数值上降低疾病复发和死亡风险更明显(图5)[10]。
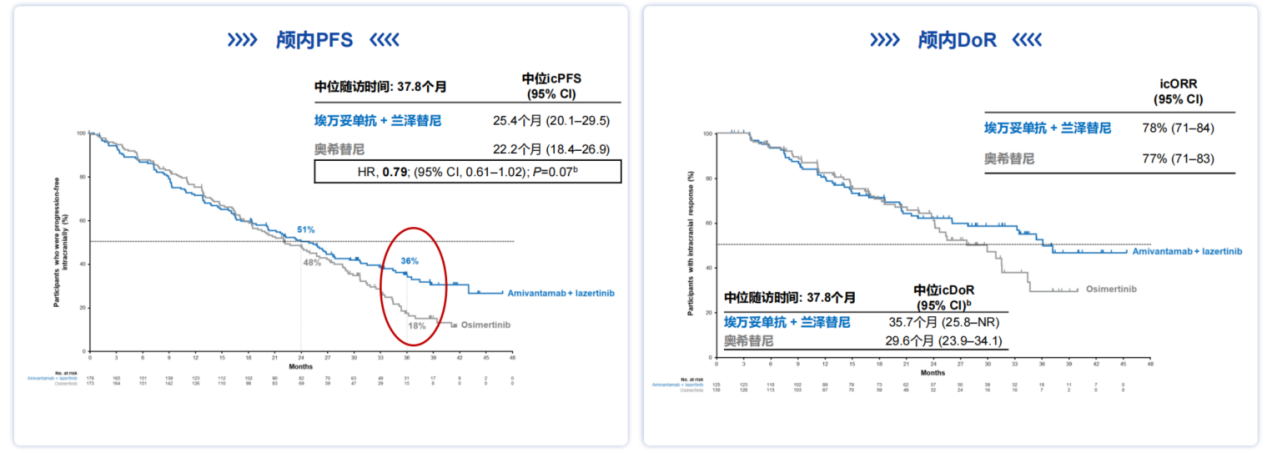
埃万妥单抗联合兰泽替尼在颅内病灶控制方面展现出良好的疗效[9]。埃万妥单抗联合兰泽替尼组的3年颅内PFS(icPFS)率是奥希替尼组的2倍(36% vs 18%)(图6)。埃万妥单抗联合兰泽替尼组也展现出持续性的颅内病灶控制,相较于奥希替尼组颅内持续缓解时间(icDoR)延长半年(35.7个月 vs 29.6个月)(图6)。
安全便捷,MARIPOSA研究的预防性处理策略全面守护患者安全
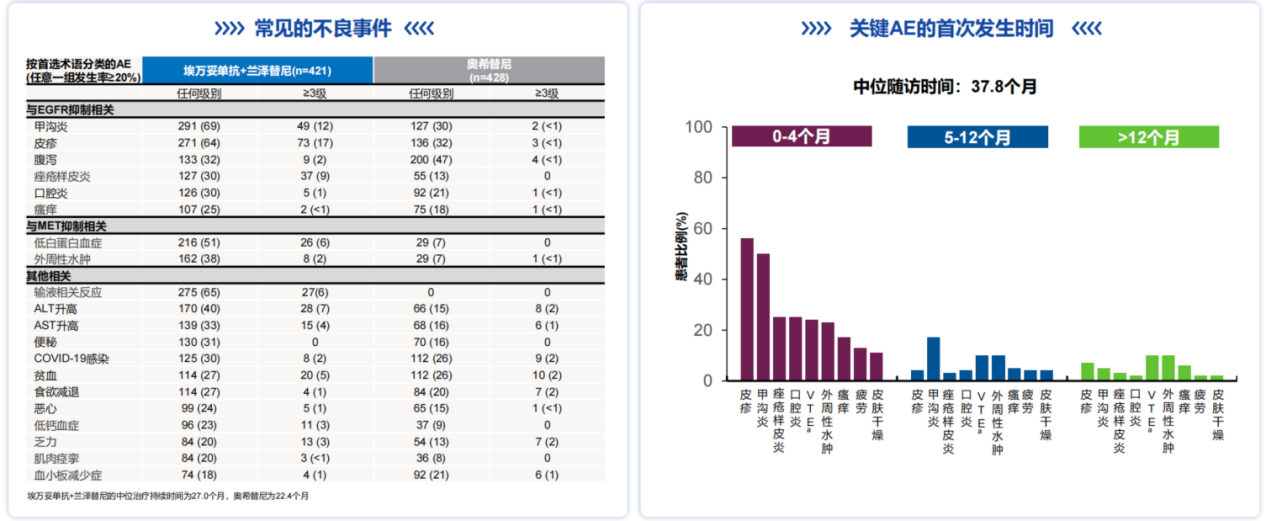
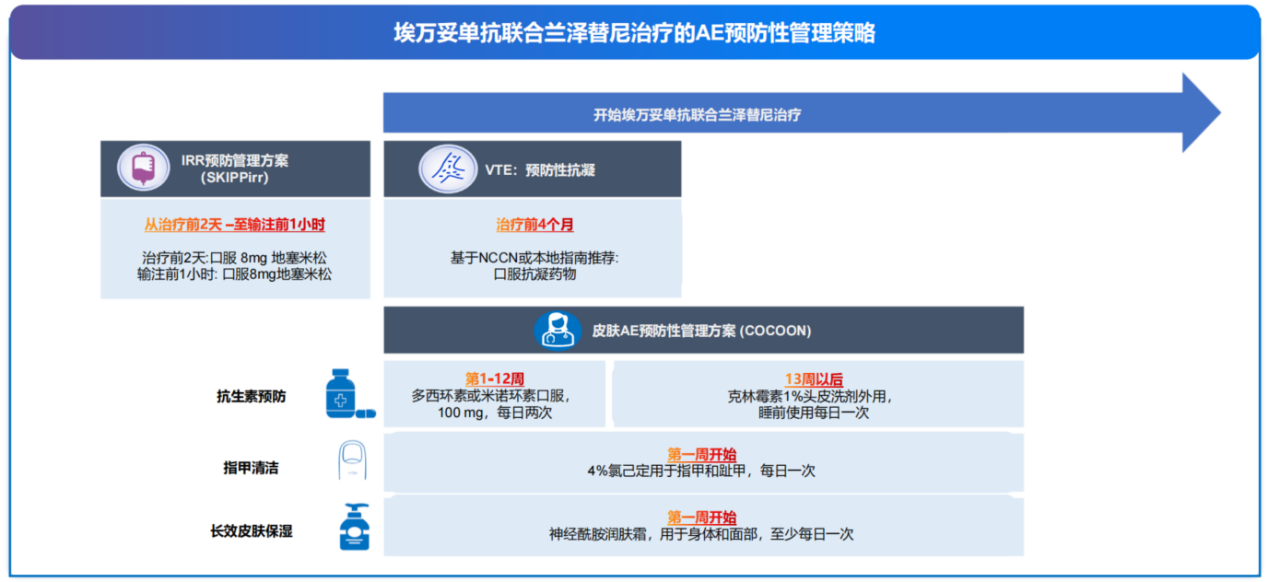
MARIPOSA研究不仅展现出良好的疗效数据,其安全性数据和围绕MARIPOSA研究开展的全方位预防性管理策略也进一步助力这一联合疗法在临床的推广和应用,为患者的安全保驾护航。埃万妥单抗联合兰泽替尼的治疗相关不良事件(TRAE)导致所有治疗终止发生率低,仅为10%[7],不良事件多为1-2级,主要不良事件可通过主动管理进行干预,且主要发生在前4个月,长期随访未发现新的安全信号,这表明其长期治疗具有可行性(图7)[9]。
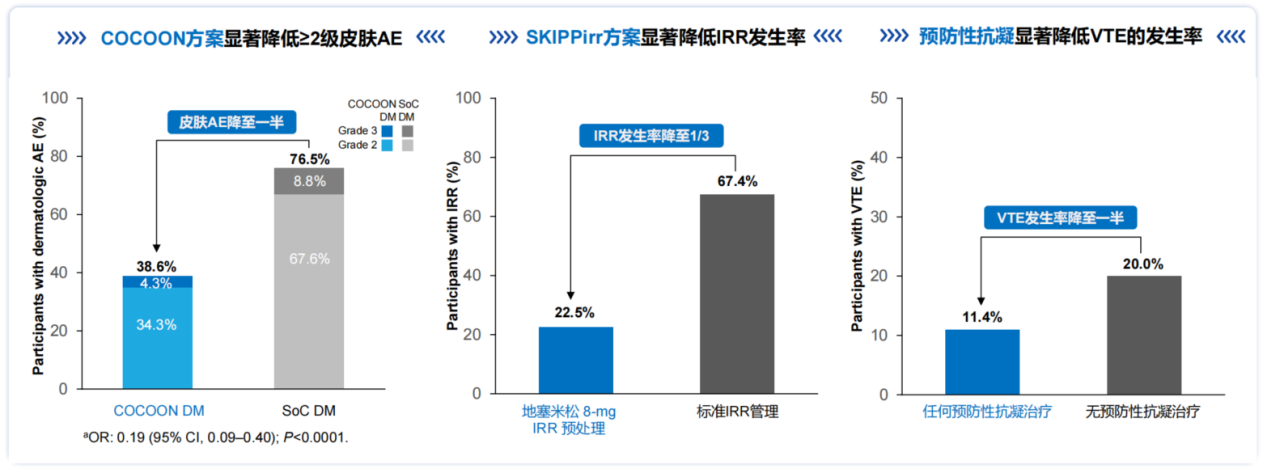
COCOON研究结果显示[11, 12],COCOON皮肤加强管理方案与标准皮肤管理方案相比,≥2级皮肤AE减少了50%(38.6% vs 76.5%)(图8),包括头皮、面部和甲沟炎等皮肤相关AE发生率,可全面改善皮肤相关AE对患者生活质量的影响。SKIPPirr是一项Simon两阶段设计+扩展阶段的II期临床研究,评估4种预防性给药方案是否能降低C1D1 输注相关反应(IRR)发生率。研究结果显示[13],地塞米松8mg预处理可有效降低静脉输注埃万妥单抗IRR的发生率(67.4% vs 22.5%)(图8)。PALOMA-2研究显示[14],预防性抗凝治疗可安全实施并有效减低深静脉血栓(VTE)发生率(11.4% vs 20.0%)(图8)。
因此,在全方位预防性管理策略(Comprehensive AE prevention strategy, CAPS)下(图9),埃万妥单抗联合兰泽替尼的生存获益有望通过改善患者体验、提升耐受性而进一步提升。
指南推荐,埃万妥单抗有望重构EGFR敏感突变NSCLC一线治疗新格局
基于MARIPOSA研究的积极结果,埃万妥单抗联合兰泽替尼已获得美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)批准用于EGFR敏感突变NSCLC一线治疗,此次NMPA的获批更是进一步印证了埃万妥单抗联合兰泽替尼在亚裔患者中的优异疗效和安全性。
目前,埃万妥单抗联合兰泽替尼也获得了国内外多部权威临床指南的一致推荐。美国国家综合癌症网络(NCCN)指南[15]已将埃万妥单抗联合兰泽替尼列为EGFR敏感突变晚期NSCLC一线治疗的I类推荐(图10)。《2025年中国临床肿瘤学会(CSCO)NSCLC诊疗指南》[16]也新增加埃万妥单抗联合兰泽替尼作为EGFR敏感突变NSCLC一线治疗的III级推荐。此外,埃万妥单抗联合兰泽替尼也获得了美国临床肿瘤学会(ASCO)指南[17]和欧洲肿瘤内科学会(ESMO)指南[18]的推荐,用于EGFR敏感突变晚期NSCLC一线治疗。基于此,这一联合疗法有望成为新的EGFR敏感突变晚期NSCLC标准一线治疗方案。

总结
近年来,EGFR敏感突变NSCLC患者的一线治疗方案得到了长足的发展,以EGFR-TKI为基础的联合治疗策略逐渐崭露头角,展现出多方面的独特优势,为患者带来了更优的治疗选择与预后期望。这些探索性组合涵盖了多种作用机制的药物,包括与EGFR-MET双特异性抗体埃万妥单抗、传统化疗、抗血管生成药物以及新兴的抗体偶联药物(ADC)等的联合应用。
在与现有EGFR-TKI标准疗法的联合方面,多项临床研究已取得了突破性进展。例如,关键的FLAURA2研究结果[19]显示,对于携带EGFR敏感突变的晚期NSCLC患者,奥希替尼联合化疗作为一线治疗方案,可将中位PFS显著延长至25.5个月。同样,另一款三代EGFR-TKI阿美替尼在AENEAS2研究中[20],当其联合化疗用于一线治疗时,中位PFS较单药治疗延长了10个月。此外,在联合抗血管生成药物的探索中,一项评估奥希替尼联合安罗替尼一线治疗伴共突变的EGFR突变晚期NSCLC的II期研究[21]显示,其1年PFS率达85%,中位PFS为29.0个月。
与此同时,将第三代EGFR-TKI与ADC相结合,也成为充满潜力的前沿方向。目前,多项旨在评估奥希替尼联合不同ADC药物一线治疗EGFR敏感突变晚期NSCLC的临床试验正在进行中。其中非常值得关注的是,探索奥希替尼联合Dato-DXd用于EGFR敏感突变一线治疗的疗效和安全性的全球III期临床研究TROPION-Lung 14正在进行中[22],期待后续研究结果的发布。
MARIPOSA研究充分体现了埃万妥单抗联合兰泽替尼在EGFR敏感突变晚期NSCLC一线治疗中的关键价值,相较于奥希替尼单药,这一联合疗法不仅显著延长了PFS和OS,OS改善预计超过一年,并且在各高危亚组尤其是基线脑转移患者中也展示了优异的疗效。在安全性方面,除了全方位预防性管理策略可全面提升患者采用埃万妥单抗联合兰泽替尼治疗的生活质量和耐受性,皮下剂型的突破更拓宽了埃万妥单抗的应用场景。PALOMA-3研究显示[23],埃万妥单抗皮下给药联合兰泽替尼可显著改善OS,安全性更佳,并且提高了用药的便利性。
在完善的全程管理和成功的剂型优化策略的支持下,埃万妥单抗联合兰泽替尼有望改写EGFR敏感突变NSCLC一线治疗新标准。随着埃万妥单抗联合兰泽替尼在NMPA的获批,相信更多的患者有望从这一疗法中获益。
[1] Zhou F, Guo H, Xia Y, Le X, Tan DSW, Ramalingam SS, Zhou C. The changing treatment landscape of EGFR-mutant non-small-cell lung cancer. Nat Rev Clin Oncol. 2025 Feb;22(2):95-116.
[2] Cho BC, Simi A, Sabari J, et al. Amivantamab, an Epidermal Growth Factor Receptor (EGFR) and Mesenchymal-epithelial Transition Factor (MET) Bispecific Antibody, Designed to Enable Multiple Mechanisms of Action and Broad Clinical Applications. Clin Lung Cancer. 2023 Mar;24(2):89-97.
[3] Dhillon S. Lazertinib: First Approval. Drugs. 2021 Jun;81(9):1107-1113.
[4] Leonetti A, et al. Br J Cancer. 2019 Oct;121(9):725-737.
[5] Amivantamab and Lazertinib in Treatment-Naive EGFR-Mutant Non-Small Cell Lung Cancer (NSCLC). 2022 WCLC, P1.16-01.
[6] Cho BC, Kim DW, Spira AI, et al. Amivantamab plus lazertinib in osimertinib-relapsed EGFR-mutant advanced non-small cell lung cancer: a phase 1 trial. Nat Med. 2023 Oct;29(10):2577-2585.
[7] Cho BC, Lu S, Felip E, et al; MARIPOSA Investigators. Amivantamab plus Lazertinib in Previously Untreated EGFR-Mutated Advanced NSCLC. N Engl J Med. 2024 Oct 24;391(16):1486-1498.
[8] Shun Lu, et al. 2023 ESMO Asia LBA10.
[9] Zhixin, Yang. 2025 ELCC, Abstract 4O.
[10] Enriqueta Felip et al. 2024 ASCO Oral 8504.
[11] Girard N, et al. ELCC 2025 10MO.
[12] 2025 ASCO abstract# 8641.
[13] G. Lopes, et al.2024 WCLC MA12.08.
[14] Sun Min Lim et al.2024 ASCO LBA 8612.
[15] NCCN Guidelines: Non-Small cell Lung cancer. Version 3.2025.
[16] 中国临床肿瘤学指南工作委员会,中国临床肿瘤学会(CSCO)非小细胞肺癌(NSCLC)诊疗指南2025.
[17] Dwight H. Owen et al. Therapy for Stage IV Non–Small Cell Lung Cancer With Driver Alterations: ASCO Living Guideline, Version 2024.3. JCO 43, e2-e16(2025).
[18] https://www.esmo.org/guidelines/living-guidelines/esmo-living-guideline-oncogene-addicted-metastatic-non-small-cell-lung-cancer/management-of-advanced-and-metastatic-disease/egfr-mutation/stage-iv-mnsclc-with-egfr-activating-mutation-before-systemic-progression
[19] D. Planchard, P.A. Jänne, Y. Cheng, et al; Osimertinib with or without Chemotherapy in EGFR-Mutated Advanced NSCLCN Engl J Med 2023; 389:1935-48.DOI: 10.1056/NEJMoa2306434.
[20] Shun Lu , et al. Aumolertinib with or without chemotherapy as first line treatment in locally advanced or metastatic NSCLC with sensitizing EGFR mutations (AENEAS2) .2025 AACR Abstract CT053.
[21] 2025 ASCO abstract# 8627.
[22] Shun Lu, et al. TROPION-Lung14: A phase 3 study of osimertinib ± datopotamab deruxtecan (Dato-DXd) as first-line (1L) treatment for patients with EGFR-mutated locally advanced or metastatic (LA/M) non-small cell lung cancer (NSCLC). 2025 ASCO. Abstract TPS8647.
[23] M. Alexander, et al. 2024 WCLC OA09.05.
*截止此文发布日期
CRC Code: EM-187062
Approved Date::2025-7-23
排版编辑:肿瘤资讯-TJ
✅ “本资料仅用于医学、科学交流,可能涉及尚未在中国获批的产品和适应症。强生创新制药不支持、不鼓励任何未被批准的药品/适应症使用。”
✅ “本资料中涉及的AE/SS/PQC已按照公司的要求上报。”(适用于含AE/SS/PQC的资料)











 苏公网安备32059002004080号
苏公网安备32059002004080号


