目前对II期结直肠癌(CRC)的风险分层在识别能从辅助化疗中获益的患者方面准确性有限,导致潜在的过度治疗或治疗不足。该研究旨在通过整合基于人工智能的影像分析与病理标志物,开发一个更精确的风险分层系统。该研究由广东省人民医院放射科刘再毅教授作为通讯作者,成果发表于《肿瘤学年鉴》(Annals of Oncology)。
该研究开发的智能风险整合系统(IRIS-CRC)提供了比当前基于指南的风险因素更精确和个性化的风险评估,有潜力使低风险患者免于不必要的辅助化疗,同时识别出高风险个体以接受更积极的治疗。这种新方法有望改善II期结直肠癌的临床决策和患者结局。
研究背景
结直肠癌(CRC)是全球第三大常见癌症,也是癌症相关死亡的第二大原因。当前,尽管对结直肠癌(CRC)的理解已取得进展,但确定哪些患者能真正从辅助治疗中获益仍是一项复杂的任务,其中II期CRC因其异质性而带来了独特的挑战 。
II期结直肠癌患者是否需要接受辅助化疗一直是临床决策的难点。在当前的临床实践中,是否对II期CRC患者进行辅助化疗的决定主要依赖于是否存在高风险的临床病理特征。然而,系统评价、荟萃分析和临床试验一致表明,辅助化疗仅能带来3%~5%的微小生存率和无复发生存率改善。这些结果表明,当前的临床病理特征不足以准确识别真正能从中获益的患者,临床治疗中仍有部分低风险患者面临过度治疗,而部分高风险患者却治疗不足。这进一步凸显了对更精确风险分层工具的迫切需求。
因此,该研究旨在利用深度学习算法开发一个基于CT的分类器,并进一步结合先进的影像分析和传统的临床病理预后标志物,以建立一个新型的风险分层系统。
研究方法
患者队列
这项回顾性多中心研究纳入了手术切缘清晰(R0)的II期CRC患者。共有12个中心的2992例II期CRC患者参与了分析。来自四个机构的1587例患者被汇总,并按7:3的比例随机分为训练数据集和内部验证数据集。来自另外八个独立中心的1405例患者被汇集作为预设的外部验证数据集,专门用于模型评估。研究的主要终点是无病生存期(DFS),次要终点是总生存期(OS)。
深度学习分类器(STAR-CRC)的开发
研究者开发了一个基于Swin Transformer的两阶段多平面深度学习网络(DLN)来预测DFS。第一阶段,在训练数据集中使用来自所有三个基本解剖平面(轴位、冠状位和矢状位)的CT图像训练了一个多平面CT基础模型。第二阶段,以训练好的多平面CT基础模型作为基础,在同个训练数据集上使用相应的平面图像微调出三个平面特异性模型(AX模型、COR模型和SAG模型)。这个风险分层分类器被命名为STAR-CRC(Swin Transformer Assisted Risk-stratification for CRC)。
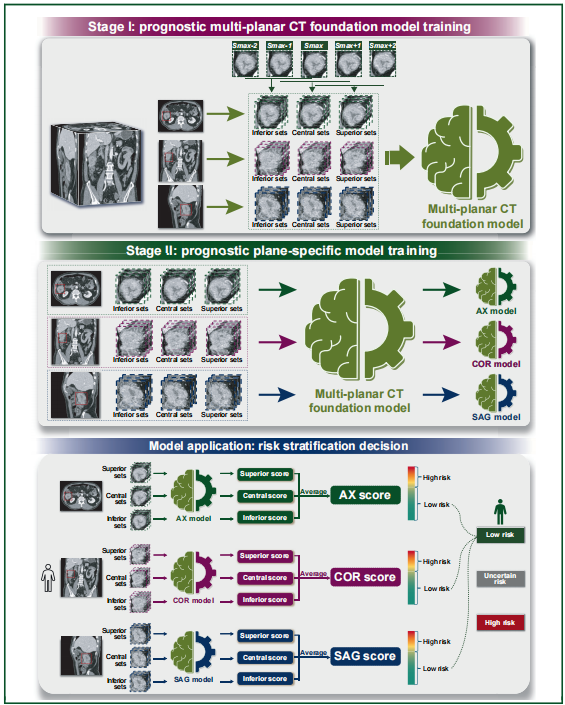
风险分层系统的开发与验证(IRIS-CRC)
研究者整合了当前临床实践指南(NCCN和ESMO)推荐的病理因素,以开发一个综合风险分层系统,旨在进一步为不确定风险亚组内的个体重新分配风险。候选的病理因素包括pT分期(pT3或pT4)、淋巴结清扫数目(NLNS)(<12或≥12)、淋巴管侵犯(LVI)(阴性或阳性)、神经周围侵犯(PNI)(阴性或阳性) 。
为了进行比较,研究者定义了一个旨在反映当前指南和临床实践的风险分层系统(GRSS-CRC),该系统仅包括上述候选病理因素。
最终,研究建立了名为IRIS-CRC(Intelligent Risk Integration System for Stage II Colorectal Cancer)的四级风险分层系统。 该系统首先使用STAR-CRC进行初步分层,将患者分为低风险、不确定风险和高风险组。随后,它使用基于指南的病理因素(pT分期、NLNS、LVI、PNI)对不确定风险组进行再分类。最终将患者分为四个预后等级:有利(Favorable)、中等(Intermediate)、差(Poor)和极差(Very poor)。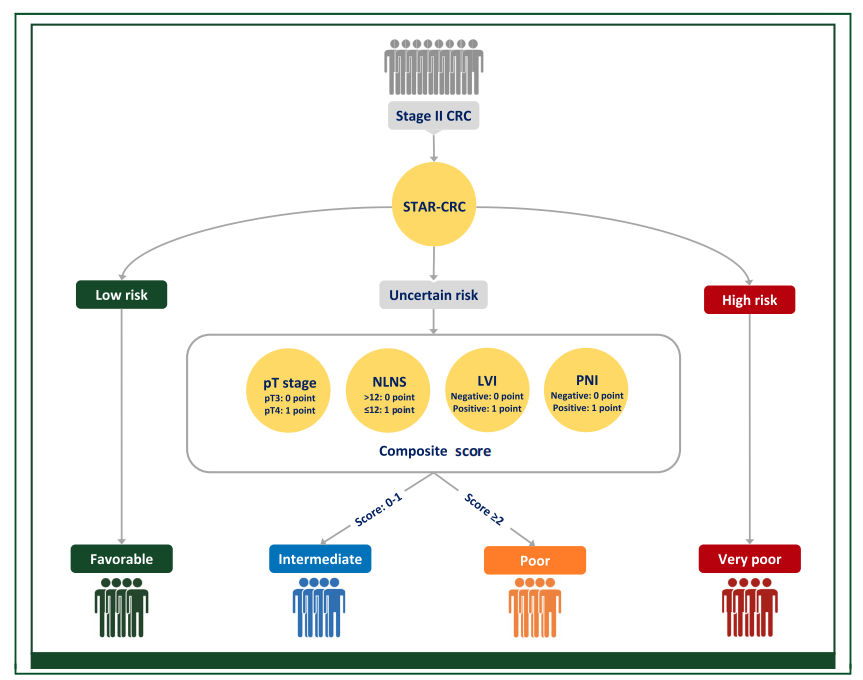
研究结果
GRSS-CRC的性能
研究者构建了一个基于指南的风险分层系统(GRSS-CRC),纳入了当前临床实践指南(ESMO和NCCN)推荐的既定风险因素,包括pT分期、NLNS、LVI和PNI。 GRSS-CRC在所有数据集中均表现出有限的区分性能。在训练数据集中,其C-index为0.545。内部验证和外部验证数据集的C-index也表现平平(分别为0.563和0.584)。Kaplan-Meier分析显示,低风险组和中等风险组之间的分层效果差,生存曲线出现重叠。
STAR-CRC的性能
STAR-CRC表现出显著的分层能力(对数秩检验 P<0.0001)。在外部验证数据集中,高风险与低风险组的未校正HR为9.09,不确定风险与低风险组的未校正HR为2.75。STAR-CRC的C-index(训练集:0.783;内部验证集:0.768;外部验证集:0.670)在所有三个数据集中均显著高于GRSS-CRC(所有P<0.0001) 。
在训练数据集中,STAR-CRC将53.5%的患者分类为低风险,3年DFS率为0.97;8.6%的患者为高风险,3年DFS率为0.36。剩余37.9%的患者属于不确定风险组,3年DFS率为0.84。在外部验证队列中,41.7%被分类为低风险,7.3%为高风险,51.0%为不确定风险。
IRIS-CRC的性能
通过对不确定风险亚组应用病理风险因素评分,研究者建立了四级风险分层系统IRIS-CRC。IRIS-CRC在所有数据集中均表现出稳健的预后分层能力,有利组的3年DFS率持续≥0.95,中等组在0.95~0.75之间,差组在0.75~0.55之间,极差预后组≤0.55。
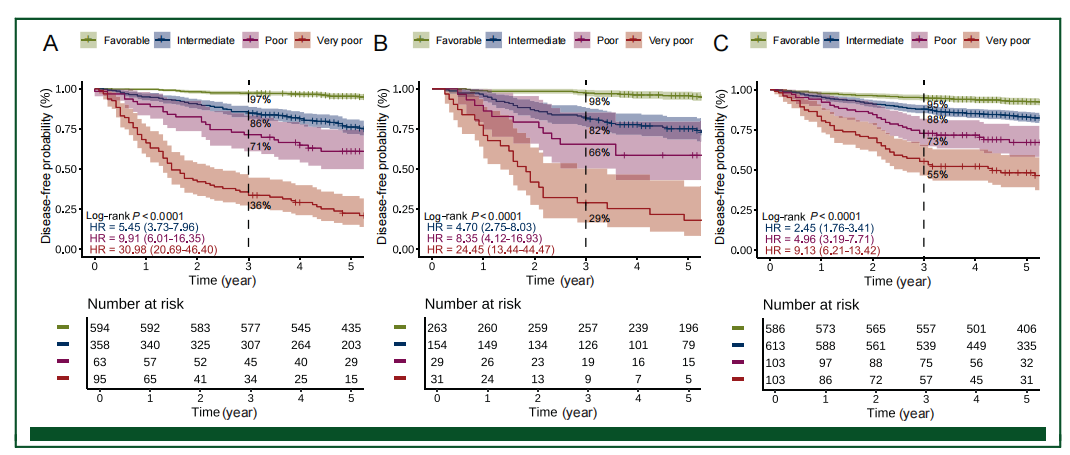
在训练数据集中,IRIS-CRC是DFS的显著预测因子(对数秩检验P<0.001),中等、差、极差组相对于有利组的HR分别为5.45、9.91和30.98。其预后价值在两个验证数据集中都得到了证实(均为对数秩检验P<0.001)。
与GRSS-CRC相比,IRIS-CRC在所有数据集中均表现出优越的区分能力,C-index显著更高(外部验证集:0.686 vs 0.584;P<0.0001) 。
从GRSS-CRC到IRIS-CRC的重新分层
在外部验证数据集中,IRIS-CRC将GRSS-CRC高风险组中27.1%的患者降级为有利组(提示避免过度治疗)。同时,它将GRSS-CRC低风险组中6.5%的患者升级为极差预后类别(提示强化治疗)。对于GRSS-CRC中等风险组的患者,IRIS-CRC将40.1%重新分类为有利组,7.0%重新分类为极差预后组。
关于治疗模式的验证
IRIS-CRC的性能在化疗和非化疗队列中都具有普遍性。 IRIS-CRC在两种治疗环境中都保持了一致的预后分层,有利组保持了极佳的结局(3年DFS≥0.95),而极差组的预后始终最差(3年DFS<0.55)。相比之下,GRSS-CRC未能在接受辅助化疗的患者中实现明确的风险分层。
研究结论
IRIS-CRC通过整合CT影像特征与已建立的病理因素,为II期CRC的风险分层提供了一种新方法,与传统评估相比,展现了更优越的预后性能。与仅基于指南推荐的临床病理风险因素构建的GRSS-CRC相比,IRIS-CRC表现出更强的分层性能。
IRIS-CRC提供了比当前基于指南的风险因素更精确和个性化的风险评估,有潜力使低风险患者免于不必要的辅助化疗,同时识别出高风险个体以进行更积极的治疗。外部验证证实,IRIS-CRC成功识别了大部分具有良好预后的低风险患者。 值得注意的是,GRSS-CRC高风险患者中的27.1%和中等风险患者中的40.1%被重新分类为有利预后组,其3年DFS率>95%。对于这些患者,辅助化疗带来的微小生存改善可能被相关的毒性所抵消。
这种新方法有望改善II期CRC的临床决策和患者结局。未来的研究应侧重于通过随机对照试验进行前瞻性验证,以确定哪些患者可以安全地避免辅助化疗,并评估其在指导高风险患者治疗决策中的作用。
Huang YQ, Chen XB, Cui YF, et al. Enhanced risk stratification for stage II colorectal cancer using deep learning-based CT classifier and pathological markers to optimize adjuvant therapy decision. Ann Oncol. Published online June 4, 2025. doi:10.1016/j.annonc.2025.05.537
排版编辑:肿瘤资讯-AS











 苏公网安备32059002004080号
苏公网安备32059002004080号


