病史摘要:患者,女,34岁,因“发热、咳嗽”就诊,胸部CT提示肝多发占位。
症状体征:患者体重1月减轻3kg;无腹痛、腹泻,无大便性状改变。
诊断方法:全身PET/CT示:降结肠癌,肝脏多发转移瘤。肠镜检查及活检提示降结肠中分化腺癌。肝穿刺病理回报肝组织内中分化腺癌浸润。
治疗方法:FOLFOX联合西妥昔单抗全身治疗10周期,原发灶、肝转移灶均缩小。2023年11月行多学科会诊(MDT)讨论,继续内科全身治疗2周期,同时加用局部治疗。2023年11月21日行肝动脉造影+锝99MAA灌注术,2023年11月30日行肝动脉造影+钇90放射灌注栓塞术,后续西妥昔单抗联合卡培他滨维持治疗。
临床转归:目前病情稳定,未见肿瘤进展征象。2024年2月复查肠镜见治疗后改变,活检病理:“降结肠活检”粘膜慢性炎。无进展生存期(PFS)已达8个月,生存质量良好。
适合阅读人群:肿瘤内科;肝胆外科
关键词:结肠癌;肝转移;多学科(MDT);综合治疗
引言
结直肠癌是消化道中最常见的恶性肿瘤之一。根据2020年中国癌症统计数据,结直肠癌在我国所有恶性肿瘤中的发病率和死亡率分别排在第二和第五位[1]。值得关注的是,近年来结直肠癌患者的平均发病年龄有年轻化的趋势,同时,发现在进展期的肿瘤和左侧结肠的肿瘤数量有所增加[2-3]。肝脏是结肠癌转移的主要目标器官之一,报道显示约有25%到30%的结肠癌患者会出现肝转移[4- 5]。本文介绍了一例通过MDT合作进行综合诊治,成功治疗了一位结肠癌伴发多发性肝转移患者的案例,旨在为结直肠癌肝转移的最佳治疗策略提供实践参考。
临床资料
一般资料
患者,女,34岁,2023年6月 因“发热、咳嗽”在当地医院就诊,查胸部CT提示肝多发占位。为进一步诊断就诊于我院,2023年6月10日行上腹部增强CT检查,见肝内多发肿块,考虑恶性转移瘤可能。查肿瘤标志物:CEA 7781ng/ml,显著升高;CA199 695.9 U/ml,显著升高。无恶心、呕吐,无腹痛、腹泻,无大便性状改变,体重1月减轻3kg。既往体健,否认高血压、糖尿病等慢性病史,否认手术、外伤、输血史。平素月经规律,否认烟酒等不良嗜好史,否认冶游史。27岁结婚,育有1子1女,家人体健,家族史无特殊。专科体格检查:腹平坦,无压痛及反跳痛,腹部未扪及包块,肝脾肋下未触及,肠鸣音正常,移动性浊音阴性。
检查
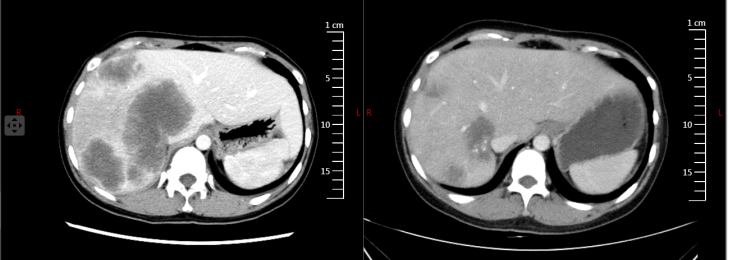
2023年6月13日行全身PET/CT(图1),结果提示:降结肠癌,肝脏多发转移瘤。2023年6月19日在我院行超声引导下肝脏病灶穿刺活检,2023年6月21日行肠镜检查及活检(图2)。肠镜活检病理回报提示降结肠中分化腺癌(图3A)。肝穿刺病理回报:“叶肝组织穿刺活检”肝组织内中分化腺癌浸润(图3B),片内结构结合免组染色及病史提示在肠道等处找原发灶。基因检测:MSS稳定型,KRSA、NRAS、BRAF V600E 野生型,PD-L1:CPS阴性,CPS<1。
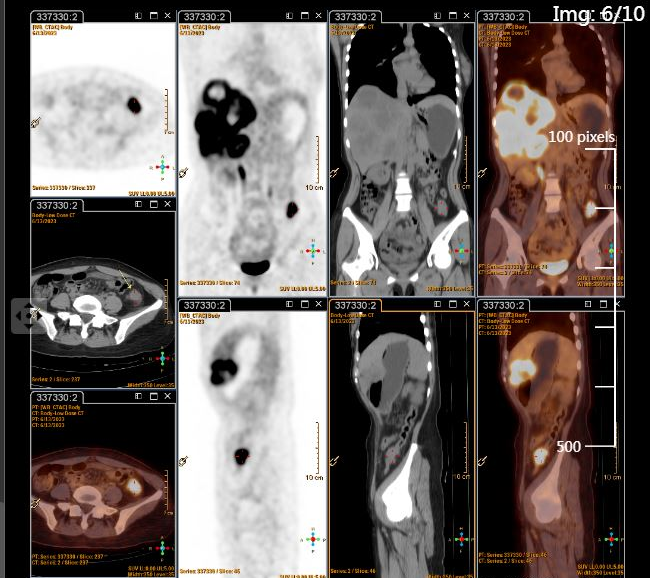
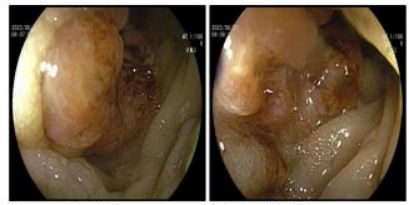
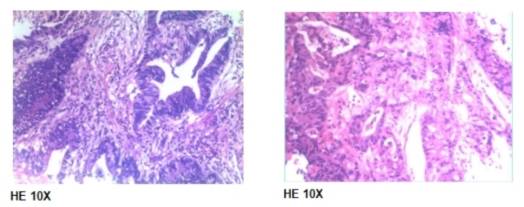
诊断与鉴别诊断
根据患者的影像学检查及病理结果,初步诊断:降结肠恶性肿瘤(腺癌)伴肝转移。
治疗
2023年7月7日在我院开始行FOLFOX联合西妥昔单抗一线治疗10周期,具体:奥沙利 120mg 静滴第1天+氟尿嘧啶600mg静滴第1天+左亚叶酸 300mg 微量泵泵入 46h+氟尿 3600mg微量泵泵入46h,每2周重复;西妥昔单抗静滴首次400 mg/m2,之后250 mg/m2,每周给药一次。化疗后24小时予以硫培非格司亭6mg皮下注射预防性升白细胞。
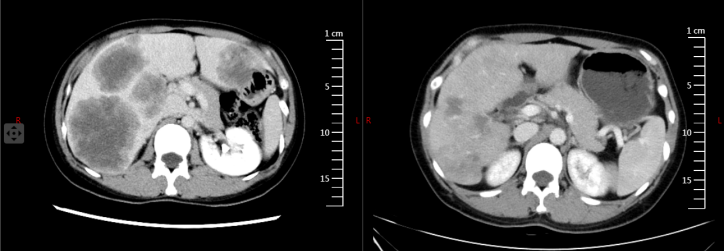
8周期疗效评估PR,2023年10月26日腹部增强CT与2023年8月28日上腹部CT增强片比较(图4)示:1.肝脏肿大,肝内多发低密度转移性结节及肿块,病灶较前均明显缩小,数目同前;2.余腹腔脏器未见明显异常强化影。胸部平扫CT:两肺未见明显活动性病灶,纵隔未见明显肿大淋巴结。
治疗期间耐受性良好,不良反应主要为皮疹,无明显血液学毒性。
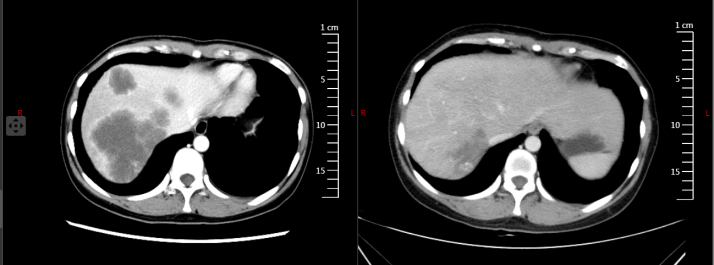
2023年11月2日行多学科会诊讨论,意见:内科治疗有效,原发灶、肝转移灶均缩小,目前有手术时机,但肝脏病灶根治性切除有难度,可能需要切除右半肝,创伤大。充分讨论并与患者沟通后,建议继续内科全身治疗,同时加用局部治疗。
2023年11月21日行肝动脉造影+锝99MAA灌注术,经肝右、肝左动脉分支超选至目标肿瘤动脉后分别注射5.0mCi、6.0mCi 99mTc-MAA。
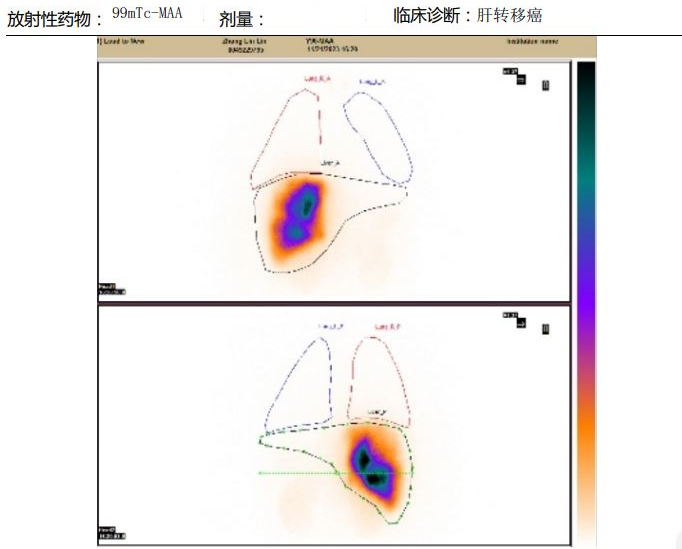
2023年11月30日行肝动脉造影+钇90放射灌注栓塞术,超选至目标肿瘤动脉后分别注射0.9GBq、1.43GBq 90Y树脂微球。
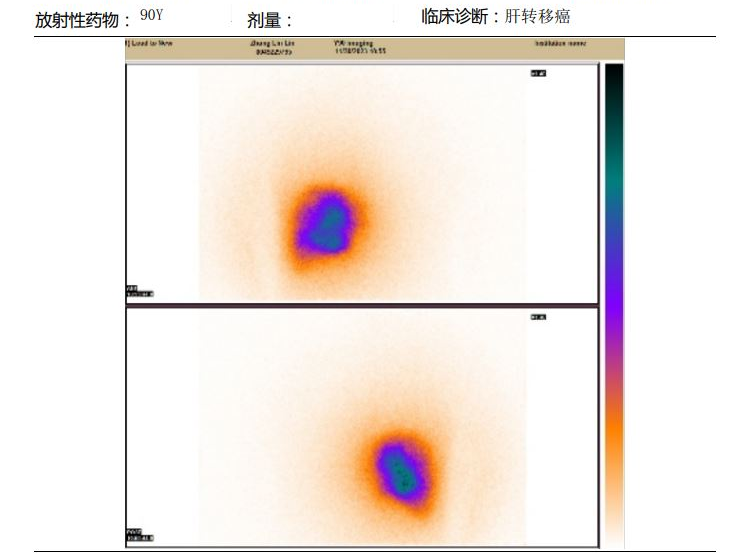
2023年12月8日、2023年12月22日行原方案第11、12周期治疗。2023年12月29 日开始西妥昔单抗联合卡培他滨维持治疗。
治疗结果、随访及转归
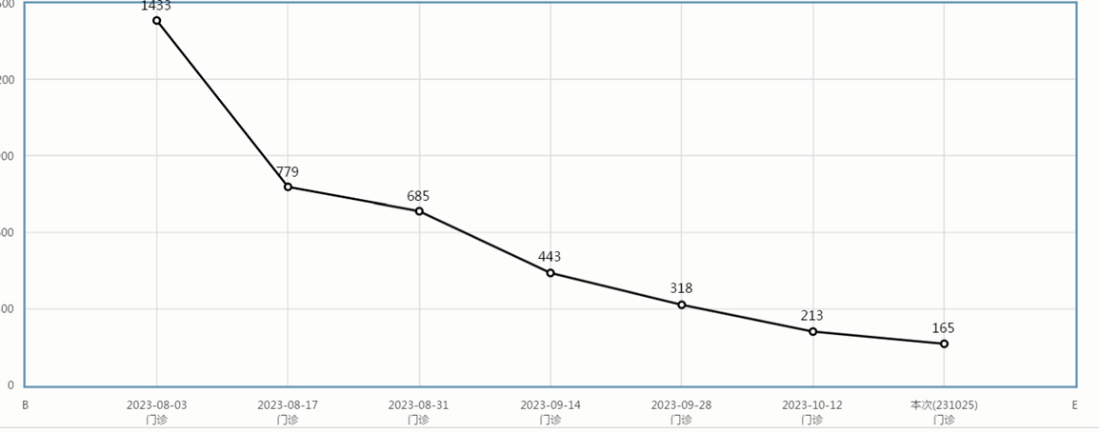
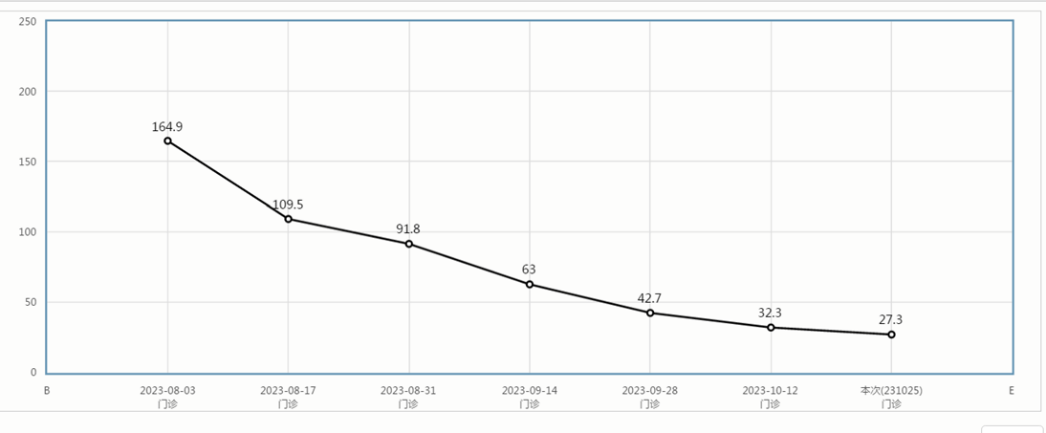
患者目前病情稳定。2024年1月10日复查上腹部磁共振提示肝脏转移灶较前相仿,继续予以西妥昔单抗联合卡培他滨维持治疗至今,未见肿瘤进展征象。2024年1月31日复查肿瘤标志物:CEA 15.1 ng/ml,轻度升高;CA199 12.4 U/ml,正常范围内。2024年2月1日复查肠镜见治疗后改变,活检病理:“降结肠活检”粘膜慢性炎。无进展生存期已达8个月,生存质量良好。
讨论
在美国,每年约有140,000例新发结直肠癌(colorectal cancer, CRC)新发病例,在初次诊断CRC时,近25%的患者有同步结直肠肝转移(synchronous colorectal liver transferstas, CRLM)。肝脏是 CRC 远处转移最常见的部位,最终,大约50-60%的患者会发展为CRLM,通过手术切除原发病灶及转移灶是目前被广泛认为唯一可能实现治愈的治疗方法[6]。据研究表明,接受肝转移病灶切除手术的患者五年生存率可超过50%,而仅接受姑息性治疗的患者五年生存率大约仅有5%。然而,约有80%的患者在初次诊断时已无法进行手术治疗[7]。在面对庞大的结肠癌肝转移患者群体时,如何制定有效的治疗策略成为临床上的一大挑战。
多学科团队合作是现代医疗体系中不可或缺的一部分,它通过整合不同专业的知识和技能,为患者提供更高质量的医疗服务。MDT能够集合不同专业领域的知识和经验,对患者进行全面的评估,从而制定出更为精准和个性化的治疗方案。并且通过团队成员之间的有效沟通,可以快速分享信息和决策,减少重复检查和治疗,提高医疗服务的效率。根据《国家卫生健康委员会中国结直肠癌诊疗规范(2023版)》[8],强调了多学科团队(MDT)在结直肠癌诊疗中的重要作用,建议条件允许的医疗机构将尽可能多的结直肠癌患者,特别是复发或转移性患者的诊疗纳入MDT管理之下。在本例中,患者在初诊时即被诊断为结肠癌伴发肝脏多发转移,病情晚期,肿瘤负担重。通过多学科团队的紧密合作,采取全身化疗联合靶向治疗等措施成功缩小了肿瘤体积,并通过后续的局部治疗获得了生存的益处,同时也确保了患者的生活质量,充分体现了以患者为中心的多学科协作治疗模式的优势。
本例中的患者是KRAS、NRAS和BRAF基因野生型的晚期左半结肠癌患者。尽管初诊时肝转移病灶无法直接切除,但是考虑到患者非常年轻并且有强烈的治疗意愿。因此,我们选择了FOLFOX方案联合西妥昔单抗作为全身治疗方案。CALGB 80203研究评估了FOLFOX或FOLFIRI方案与西妥昔单抗联合作为一线治疗转移性结直肠癌(MCRC)的价值。结果表明,加入西妥昔单抗可以提高缓解率[9]。COIN-B研究表明,西妥昔单抗持续应用作为化疗间歇期的维持治疗是安全的。最常见的3-4级不良反应为皮疹(21/77[27%]:20/92[22%] ),中性粒细胞减少(22[29%]:30[33%]),腹泻(14[18%]:23[25%]),以及嗜睡(20[26%]:19[21%])[10]。考虑到治疗的安全性,我们在化疗后24小时使用硫培非格司亭进行预防性治疗,以防中性粒细胞减少伴发热。患者经过12个周期的治疗,疗效良好,耐受性佳,未出现需减量或延迟治疗的情况。在全身治疗的后期,还适时引入了锝99MAA灌注术和钇90放射灌注栓塞术等治疗手段[11-12],且未观察到明显的不良反应。此案例不仅展示了患者的生存获益,也证明了该综合治疗方案的高效性和安全性。
利益冲突声明 所有作者均声明本研究不存在利益冲突
[1] Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021,71(3):209-249.
[2] Siegel RL, Wagle NS, Cercek A, et al. Colorectal cancer statistics, 2023. CA Cancer J Clin 2023.
[3] Huang J, Lucero-Prisno DE 3rd, Zhang L, et al. Updated epidemiology of gastrointestinal cancers in East Asia. Nat Rev Gastroenterol Hepatol 2023.
[4] Manfredi S, Lepage C, Hatem C, et al. Epidemiology and management of liver metastases from colorectal cancer[J]. Ann Surg 2006; 244: 254-259.
[5] Hackl C, Neumann P, Gerken M, et al. Treatment of colorectal liver metastases in Germany: a ten-year population-based analysis of 5772 cases of primary colorectal adenocarcinoma[J]. BMC Cancer 2014; 14: 810.
[6] Doussot, Alexandre et al. “Hepatic arterial infusional chemotherapy in the management of colorectal cancer liver metastases.” Hepatic oncology vol. 2,3 (2015): 275-290. doi:10.2217/hep.15.9
[7] House MG, Ito H, Gönen M, et al. Survival after hepatic resection for metastatic colorectal cancer: trends in outcomes for 1,600 patients during two decades at a single institution[J]. J Am Coll Surg 2010; 210: 744-752, 752-745.
[8] 国家卫生健康委员会中国结直肠癌诊疗规范(2023版)
[9] THOMPSON H, KIM J K, YUVAL J B, et al. Survival and organ preservation according to clinical response after total neoadjuvant therapy in locally advanced rectal cancer patients: A secondary analysis from the organ preservation in rectal adenocarcinoma (OPRA) trial [J]. Journal of Clinical Oncology, 2021, 39(15_suppl): 3509-.
[10] Wasan H, Meade AM, Adams R, Wilson R, Pugh C, Fisher D, Sydes B, Madi A, Sizer B, Lowdell C, Middleton G, Butler R, Kaplan R, Maughan T; on behalf of the COIN-B investigators.Intermittent chemotherapy plus either intermittent or continuous cetuximab for first-line treatment of patients with KRAS wild-type advanced colorectal cancer (COIN-B): a randomised phase 2 trial.Lancet Oncol. 2014 Apr 2. pii: S1470-2045(14)70106-8.
[11] 李涛, 王志鑫. 钇90放射微球与抗肿瘤药物治疗肝癌的临床进展[J]. 临床医学进展, 2024, 14(2): 2528-2534.
[12] Meyer, Carsten et al. “Yttrium-90 radioembolization of unresectable hepatocellular carcinoma - a single center experience.” OncoTargets and therapy vol. 10 4773-4785. 26 Sep. 2017, doi:10.2147/OTT.S137519
排版编辑:肿瘤资讯-黄洋洋











 苏公网安备32059002004080号
苏公网安备32059002004080号


