肿瘤骨转移是晚期癌症患者最常见的并发症之一,它不仅会引发一系列严重的骨相关事件(SREs),极大地影响患者的生活质量,更是影响患者总生存期(OS)的关键因素。随着现代肿瘤治疗的进步,患者的生存期得以延长,骨转移的发生率也随之上升,使得骨骼健康管理在肿瘤全程治疗中的重要性日益凸显。
近日,在基金会举办的三方研讨会上,海军军医大学第二附属医院(上海长征医院)杨诚教授就肿瘤骨转移相关主题进行了系统梳理,涵盖其流行病学特征与病理生理机制,深入剖析了溶骨性与成骨性转移的临床特点与危害,并重点阐述了以RANKL抑制剂地舒单抗为代表的现代骨保护治疗如何重塑治疗格局,为患者带来更大的临床获益。【肿瘤资讯】特别整理其中精华内容,以飨读者。
上海长征医院骨科医院
现任中国人民解放军骨科专业委员会骨肿瘤学组秘书
中国医师协会骨科分会《骨科循证临床诊疗指南》编辑审核秘书组组长
中国医师协会骨科分会脊柱菁英会创始会员
中国残疾人康复协会肢体残疾康复专业委员会脊柱康复学组委员
中国抗癌协会肉瘤专业委员会软组织肉瘤学组委员
中国抗癌协会肉瘤专业委员会四肢肿瘤学组委员
中国抗癌协会肉瘤专业委员会放化疗学组委员
中国抗癌协会肉瘤专业委员会创新与转化学组委员
中国康复医学会修复重建外科专业委员会骨肿瘤学组委员
中国医药教育协会骨与软组织肿瘤专业委员会委员
骨科在线编委会编委
骨转移的流行病学、危害与古老根源
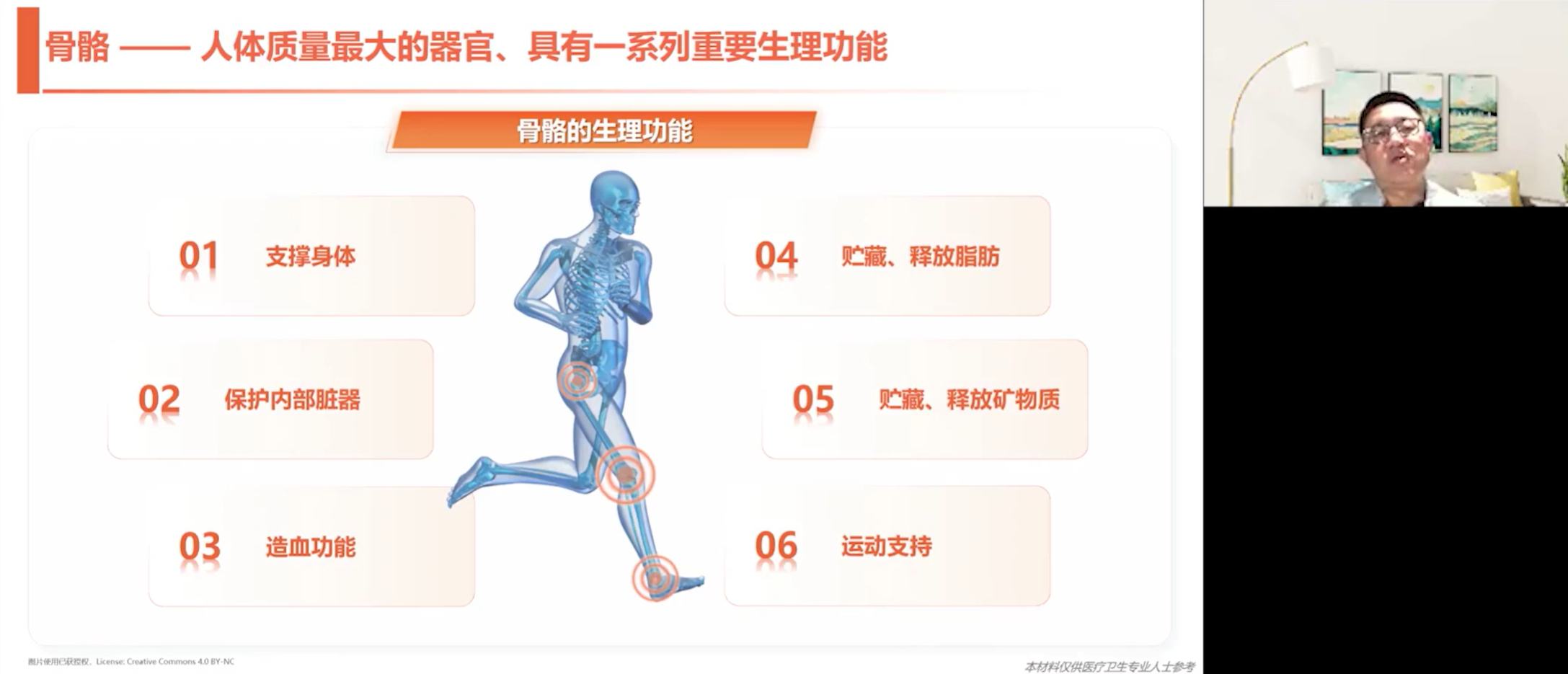
骨骼是人体质量最大的器官,承担着支撑身体、保护内脏、储藏和释放矿物质、运动支持以及造血等六大核心生理功能。一旦发生肿瘤骨转移,这些功能便会受到严重破坏:脊柱不稳乃至病理性骨折会导致支撑功能受损,进而导致运动功能受到影响;骨破坏会引发高钙血症;若伴有大面积骨髓侵犯,造血功能也将受到严重抑制。因此,维护骨骼健康是癌症治疗全程中不可或缺的基石。
肿瘤骨转移并非新问题,它是一个困扰人类数千年的古老疾病。2022年《柳叶刀·肿瘤学》上发表的一篇文章,通过对一具公元前2500年至2050年的骸骨进行影像学重建,发现其存在全身多发的混合性骨转移——既有成骨性改变,也有溶骨性破坏。这表明,骨转移自古以来就是伴随人类的顽疾。
那么,肿瘤为何会偏爱骨骼?经典的“种子与土壤”学说为我们提供了初步解释。随着基础研究的深入,其机制被进一步阐明。RANK/RANKL信号通路在骨重塑平衡中的核心作用逐渐被我们熟知。当这条通路发生异常,导致破骨与成骨的平衡被打破,破骨细胞功能异常活跃,就会为骨转移的发生和发展创造条件,并引发严重的溶骨性破坏。
在临床实践中,肺癌、乳腺癌和前列腺癌是骨转移的高发癌种。尤其在前列腺癌中,高达80%的晚期患者会出现骨转移。然而,一个值得关注的临床现象是,尽管前列腺癌骨转移发生率最高,但在因骨转移需要接受外科手术的患者中,乳腺癌和肺癌却占据了绝大多数。这与不同癌种骨转移的生物学特性(如溶骨性破坏程度、成骨反应的强度)密切相关,详细原因将在后续讨论。

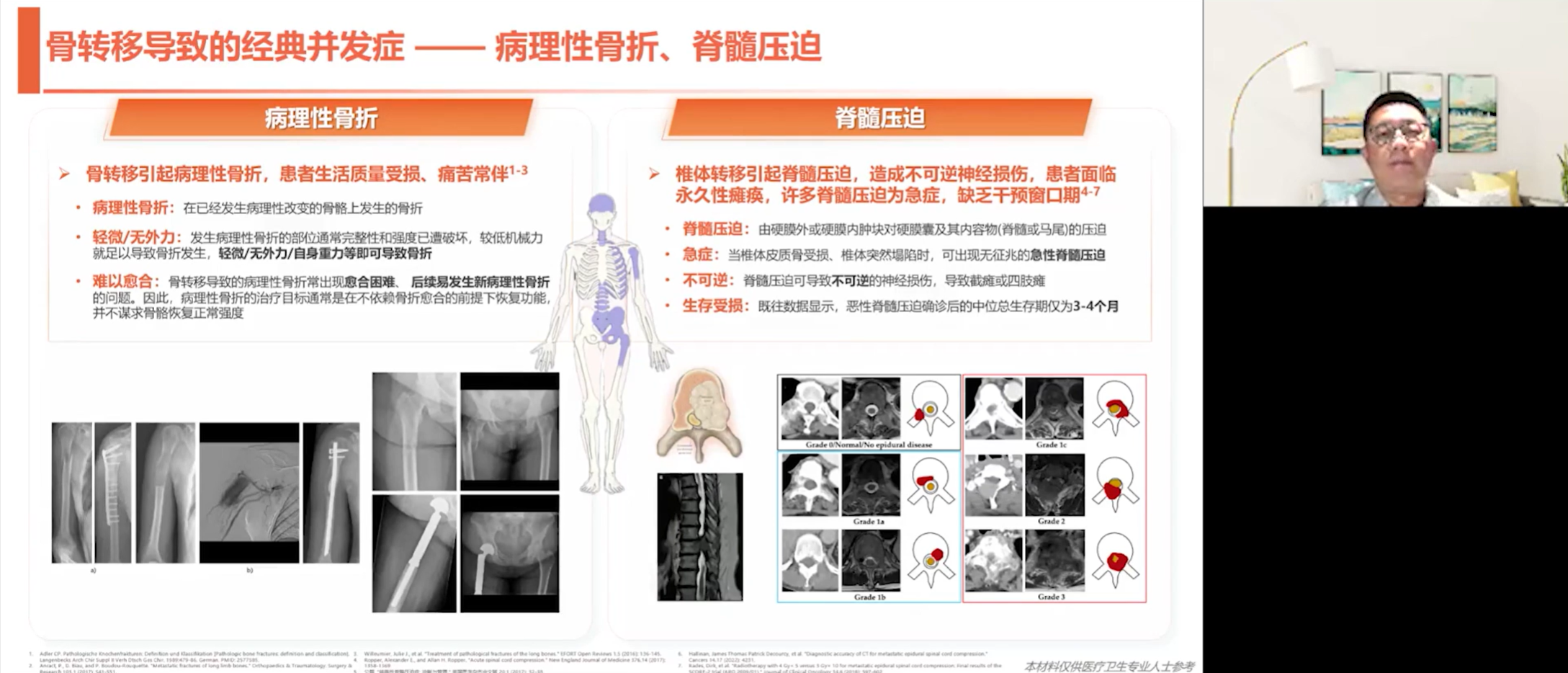
骨转移的初诊模式也至关重要。许多患者在确诊原发肿瘤时就已发生骨转移,更有甚者(约30%-40%)以骨转移引发的症状作为首发表现前来就诊。骨转移导致的并发症,包括病理性骨折、脊髓压迫等,是其危害性的集中体现。骨转移性疼痛常极为剧烈,往往需要用到三阶梯止痛的最高等级——吗啡类药物,部分患者甚至对强阿片类药物反应不佳。脊髓压迫若未能及时解除,可能导致瘫痪;瘫痪状态极易引发呼吸道、泌尿系统的严重感染,最终会影响患者生存。因此,对骨转移患者进行及时的多学科(MDT)干预至关重要。一旦出现需要外科介入的指征,外科医生应尽早干预,为患者赢得接受后续全身治疗的宝贵时间和机会。如果错过了最佳手术时机,最终将严重影响患者的生存。
随着现代肿瘤治疗进入“长生存时代”,患者的OS越来越长,骨骼健康已成为肿瘤患者长期生存管理中的“隐形杀手”。对肿瘤患者的骨骼健康管理必须是全程的,只有这样才能为患者提供一个相对安全、舒适的生存环境。
骨转移的机制:“溜进来、住下来、搞破坏”的三步曲
骨转移的发生和发展,可以形象地概括为一个“三步曲”:
“溜进来”——悄然定植:肿瘤细胞通过循环系统侵入骨骼,并在骨微环境中“潜伏”下来,进入休眠期,在此期间不断重塑肿瘤微环境。
“住下来”——转移灶形成:在特定条件下,骨微环境进入病理状态,肿瘤细胞不断增殖,最终形成转移灶。
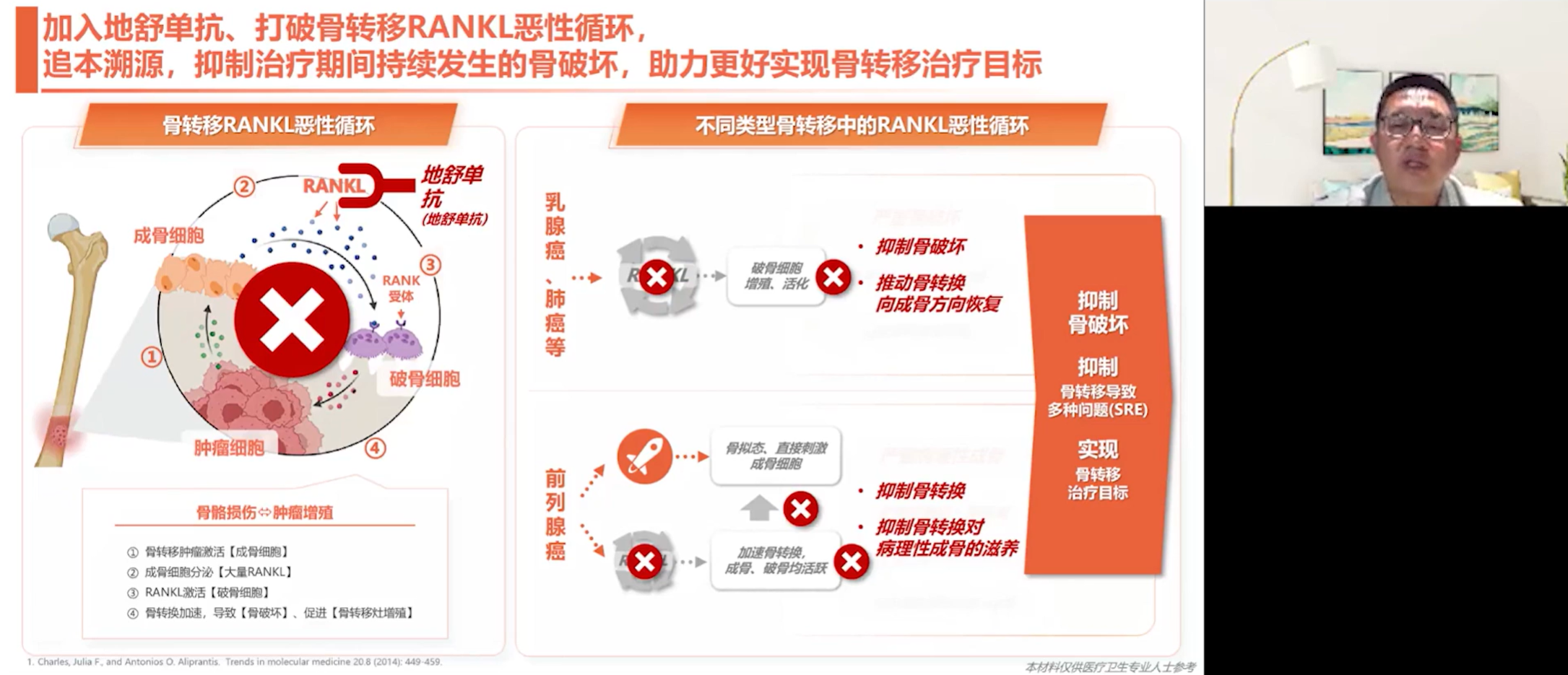
“搞破坏”——恶性循环:转移灶一旦形成,便会启动一个以RANKL为核心的、不可逆的恶性循环。肿瘤细胞刺激成骨细胞大量分泌RANKL,RANKL再过度激活破骨细胞,导致骨质被大量溶解吸收。而被破坏的骨骼会释放出更多生长因子,反过来又进一步刺激肿瘤细胞增殖,从而加剧骨破坏。

乳腺癌和肺癌的骨转移以溶骨性破坏为主,因此临床上更早出现病理性骨折、脊柱不稳等严重事件。相比之下,前列腺癌的骨转移多表现为成骨性改变,这与其肿瘤细胞能够发生“骨拟态”有关。然而,这种成骨是病理性的,新生成的骨骼内部结构杂乱无章,韧性和刚度显著下降,脆性明显增加。这种“伪装”的强化使得患者早期症状不明显,容易错过最佳治疗时机。这一点明确解释了为何在因骨转移并发症需接受外科手术的患者群体中,肺癌和乳腺癌患者占据了更高的比例(而前列腺癌患者相对较少)。
骨转移的治疗:从“救火”到“防火”的综合管理
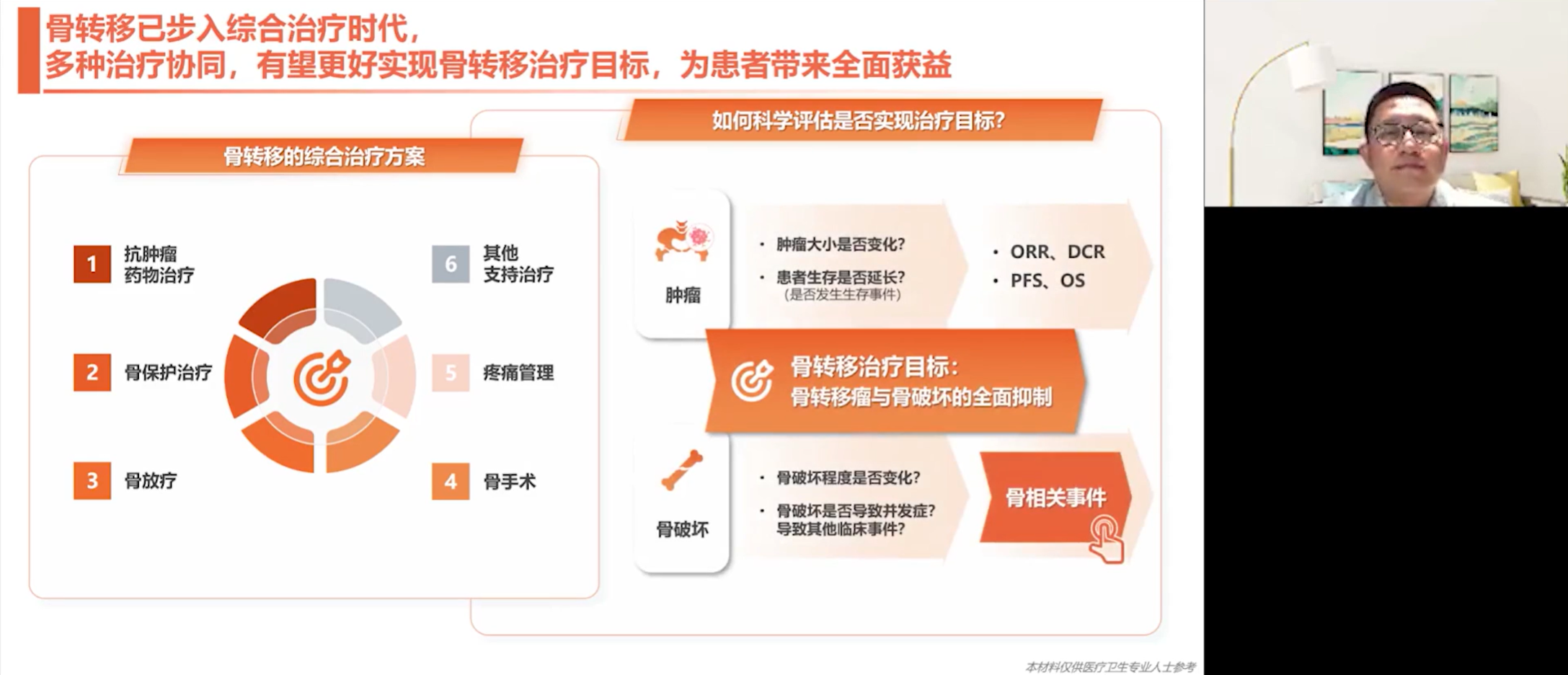
骨转移治疗的首要核心目标,是降低疾病相关的死亡风险,其次则是提高患者的生活质量,并尽可能快速、有效地控制其痛苦。要实现这一目标,必须基于其发病机制,精准干预骨重塑失衡过程。
如今,骨转移已进入综合治疗时代,治疗理念也发生了根本性转变。医学证据表明,骨保护治疗不应延迟至骨转移发生后才进行,对于高风险患者,一旦确诊就应尽早启动。这种“防患于未然”的主动管理,要求我们将骨保护治疗、抗肿瘤治疗等手段及早应用。当然,如果确诊时已发生骨转移,那么抗肿瘤治疗、骨手术、放疗以及骨保护治疗等手段都应被纳入综合治疗方案中。
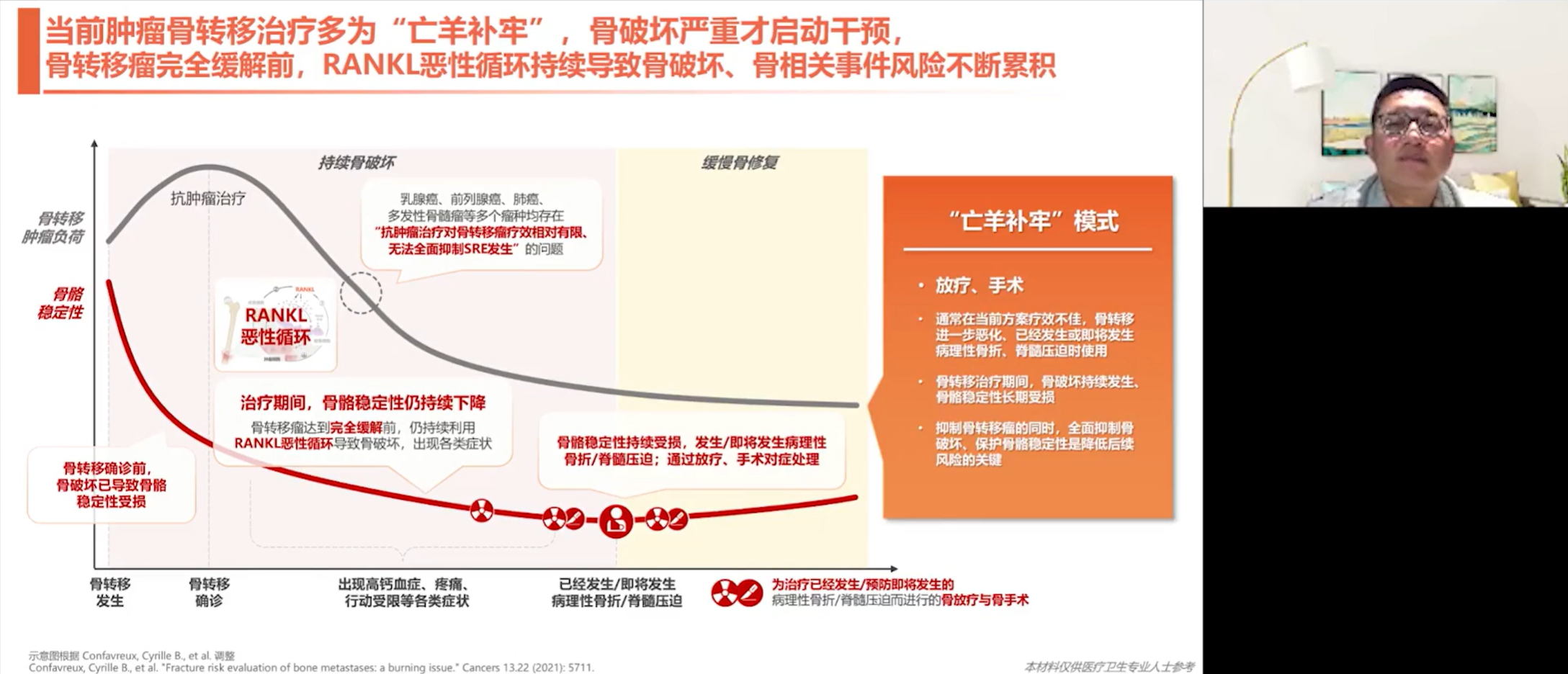
如何科学评估治疗目标是否实现?其关键指标在于能否有效抑制骨破坏,减少骨相关事件(SREs)的发生。真实世界数据显示,骨转移患者的SREs累计发生率非常高,即使在免疫治疗时代,其发生风险仍未得到理想控制。在这种背景下,外科手术和放疗的角色,可比作“救火队长”。当患者发生病理性骨折或脊髓压迫时,外科医生通过手术,或联合放疗科医生进行放疗,可以解决局部的危急问题。但这些都是局部“救火”,无法从根本上解决肿瘤这个全身性的问题。因此,“骨破坏严重了才干预”的旧观念亟需摒弃。骨保护治疗应在骨转移确诊甚至更早阶段就介入,及早遏制RANKL恶性循环,才能有效降低SREs的发生率。
从机制上解决问题才是治疗的根本。地舒单抗作为一种靶向RANKL的单克隆抗体,能够精准地与RANKL结合,阻止其激活破骨细胞。它不仅能抑制已形成转移灶的骨破坏,甚至能在肿瘤细胞刚刚“定植”于骨骼、改造微环境的阶段就介入,抑制微转移灶的骨破坏,从而实现治疗与预防的双重目标。更准确地说,地舒单抗的核心目标是“降低SREs发生率”,当它与其他综合治疗手段联合时,才能更准确地称为“骨转移治疗”。
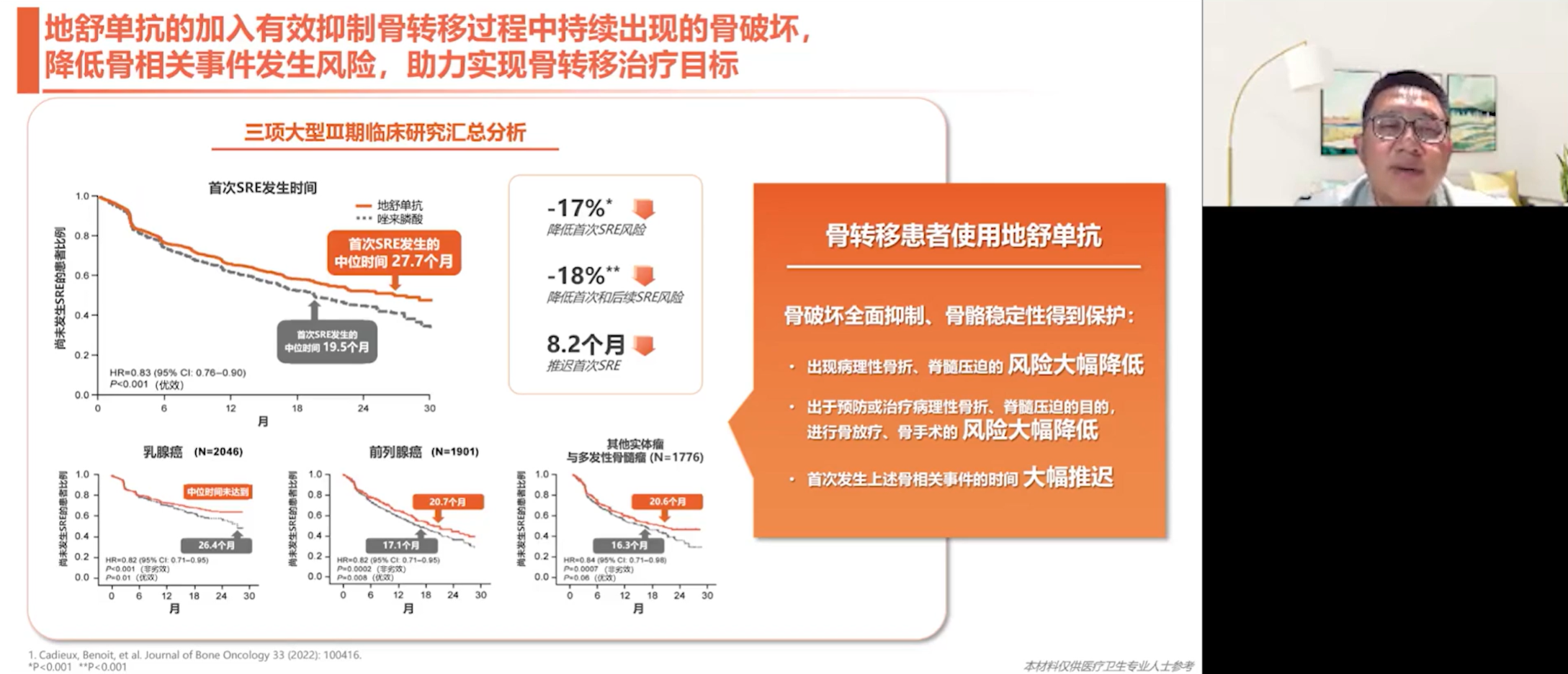
地舒单抗的疗效已在多项大型III期临床试验中得到证实。这些研究大多是随机、双盲、阳性对照设计,一项研究头对头比较了地舒单抗与当时的标准治疗——双膦酸盐(如唑来膦酸)的疗效。该研究以“至首次发生SRE的时间”为主要终点。结果显示,无论是在乳腺癌、前列腺癌还是其他实体瘤中,地舒单抗均展现出优效性。具体而言,地舒单抗组首次SRE发生的中位时间显著延迟,较唑来膦酸组延长约8.2个月。对于患者而言,这是一个非常大的福音,意味着骨破坏得到有效抑制,骨骼稳定性得到保护,从而显著降低了病理性骨折及骨科干预手术的风险。
对于骨转移患者,治疗不能偏颇于任何一方面。而骨保护治疗还能与其它疗法协同增效,成为骨转移综合治疗中非常重要的一部分。
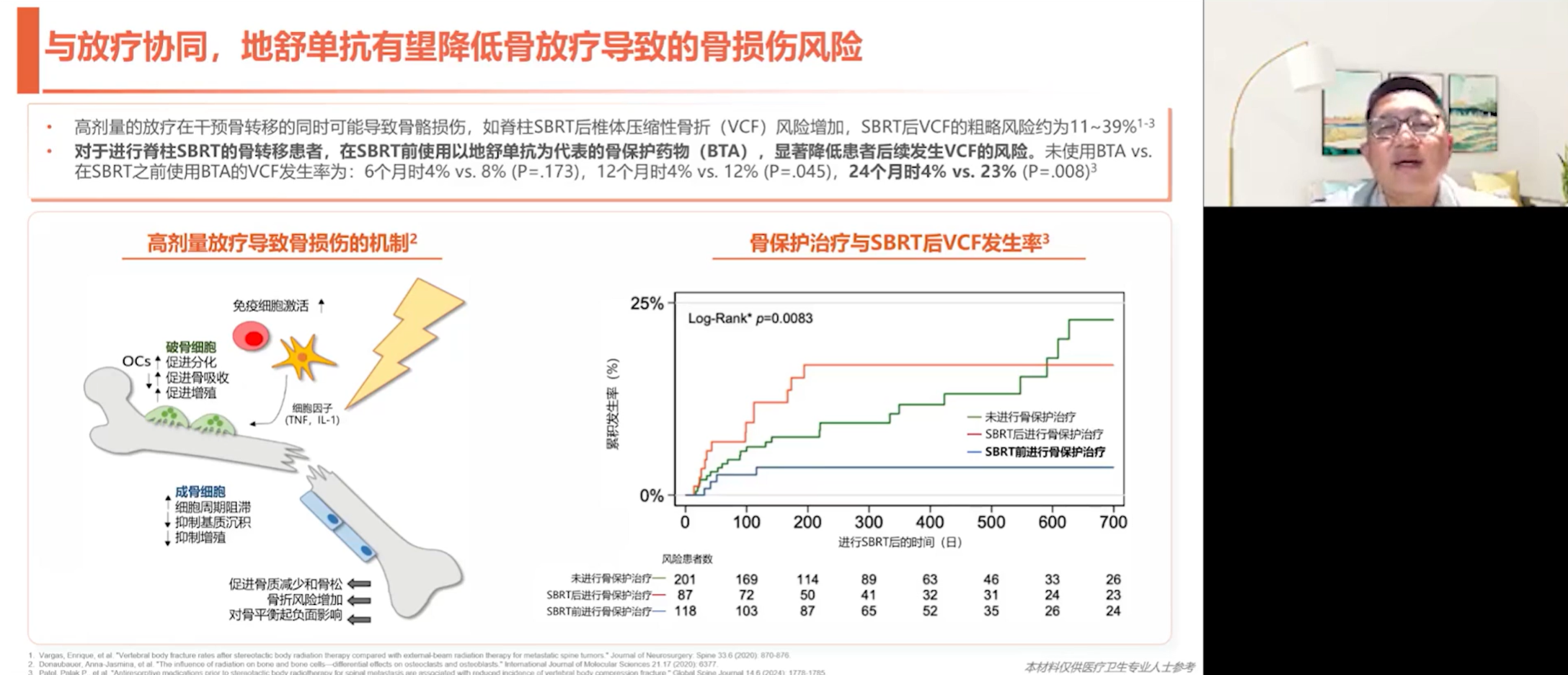
与放疗协同:过去,骨科医生常担心放疗会增加骨骼脆性,导致二次损伤。有时推荐患者去放疗,结果患者扭个腰就骨折或者瘫痪了,还不如直接手术。但临床数据显示,在立体定向放疗(SBRT)前进行骨保护治疗,可显著降低椎体压缩性骨折的风险。这打消了我们的顾虑,让更多患者能从“骨保护+放疗”的联合模式中安全获益。
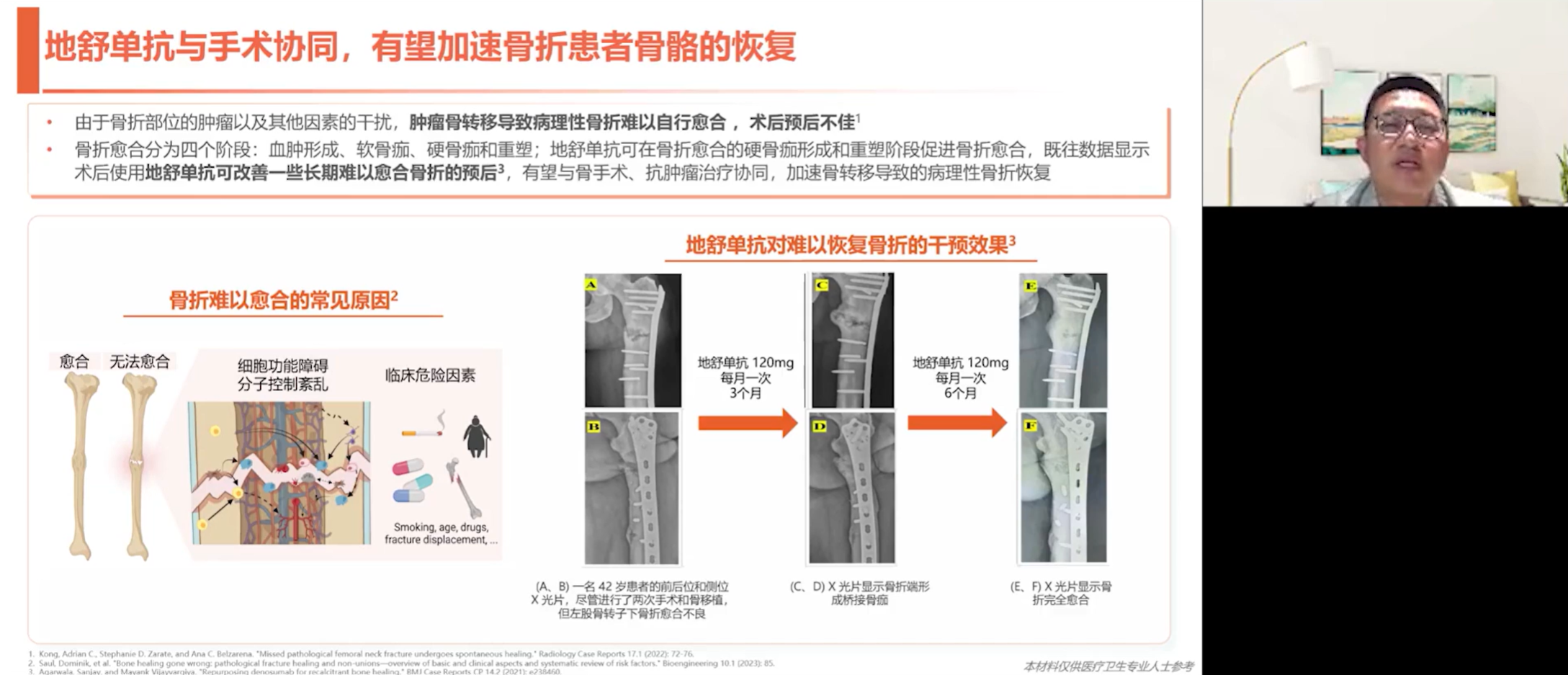
与手术协同:病理性骨折不同于普通骨折,它几乎无法自行愈合,即便愈合,形成的骨骼也是无法承重。因此,手术内固定时,螺钉必须打入健康的骨骼中,这往往意味着更大的手术范围。地舒单抗等药物的应用,通过抑制破骨、为正常成骨创造条件,能够改善骨折断端的骨质,为内固定物提供更稳固的锚定,甚至可能加速病理性骨折的康复。
一例临床病例可加深理解:一位老年女性患者,有肺癌病史(早期原位癌,两次手术均未进行后续全身治疗),患病十年后突然出现脊柱疼痛和后凸畸形。影像学检查(MRI)显示,其胸5至胸9椎体信号异常,胸7椎体发生病理性骨折并严重压迫胸髓,PET-CT证实为脊柱多发转移。患者已出现双下肢不全瘫,无法行走。

面对这种情况该怎么办?患者未接受过任何全身治疗,我们对其化疗、靶向治疗的敏感性一无所知。如果因瘫痪就放弃治疗,患者很快会因感染等并发症危及生命。此时,“救火队员”必须上场。脊柱转移瘤手术的核心目标是:保护和恢复神经功能,重建脊柱稳定性,控制疼痛,最终是提高生活质量,为患者赢得接受后续综合治疗的机会,并非为了切瘤而切瘤。
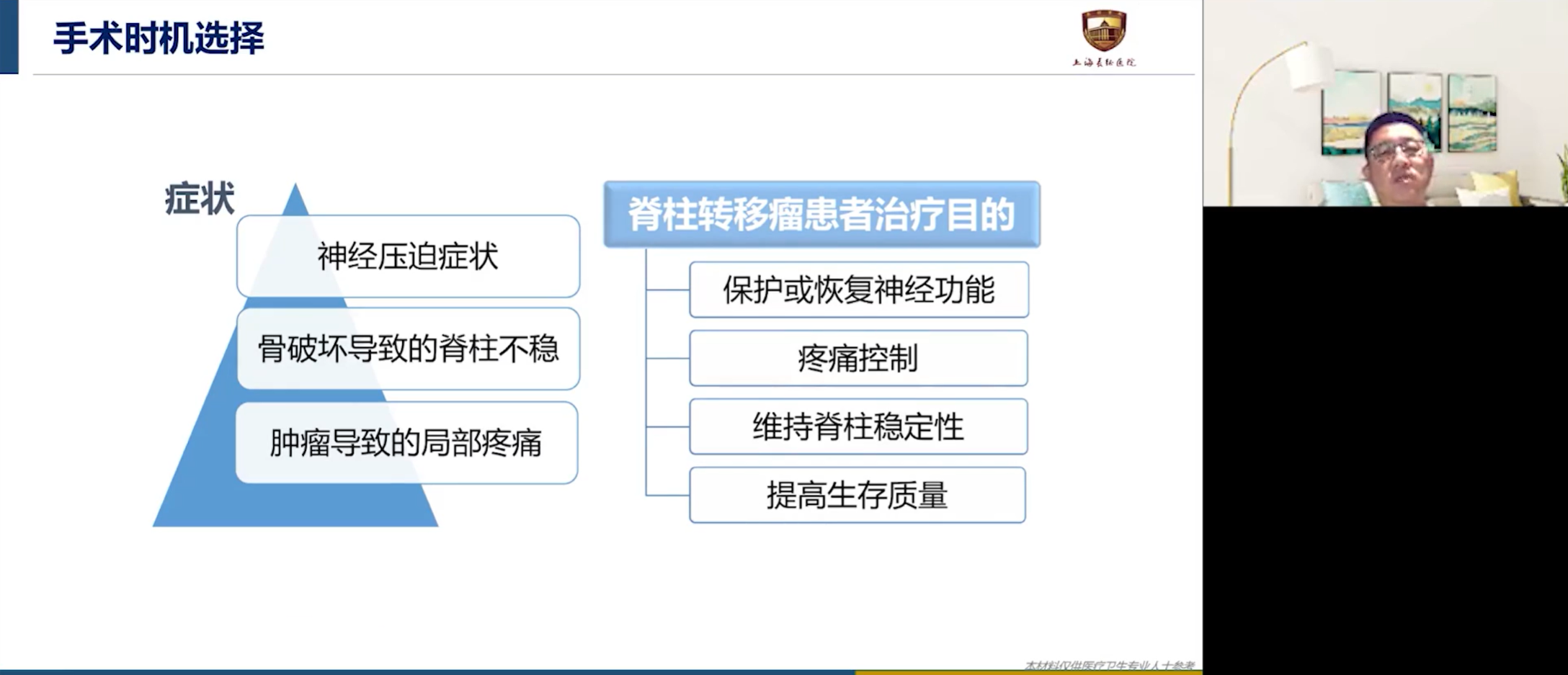
我们依据NOMS决策框架(综合评估神经功能、肿瘤学、力学稳定性和全身系统状况)进行评估,该患者评分高于手术建议阈值,肿瘤负荷情况、全身情况也适合手术。手术的具体方式应根据患者情况决定。围术期骨保护治疗应当尽早开启。


入院后,我们立即启动地舒单抗骨保护治疗,并迅速施行了后续手术,包括椎管减压、内固定以及骨水泥强化。术后患者恢复良好,疼痛缓解,双下肢功能明显改善,两周后即可下床活动。后续,根据基因检测结果,患者接受了吉非替尼靶向治疗。术后半年复查,影像学显示手术区域的骨性结构得到显著改善和重建,血清碱性磷酸酶(ALP)水平也明显下降。
总而言之,骨转移治疗联合地舒单抗可助力实现骨转移瘤与骨破坏的全面抑制。对于骨转移的治疗,抗肿瘤治疗、骨保护治疗、外科手术、放疗及疼痛管理等多方面的治疗均非常重要,多学科综合管理是确保整合疗效、提升患者预后的关键所在。

讨论精要
外科决策是一个极其谨慎的过程。首先要明确病理类型及其对放化疗的敏感性;其次评估肿瘤负荷,是寡转移还是多发转移,是否累及重要脏器或承重骨;第三,也是最关键的,要看患者的治疗阶段。一个未经系统治疗的患者,我们应积极手术为其创造后续治疗机会。但如果患者已经历多线治疗失败,再进行创伤大的手术可能只会缩短生存期,获益甚微。此外,原发灶类型也决定了干预方式,例如前列腺癌的成骨性转移,若无不稳,我们手术范围可能就仅限于减压,会比处理乳腺癌的溶骨性破坏更小。但无论如何,骨保护药物的全程使用是我们坚持的原则。
一个重要的临床现实是,靶向、免疫等全身治疗虽能改善骨痛症状,其对已发生的骨结构破坏的逆转作用有限,亦不能有效预防病理性骨折。许多患者在全身治疗有效的情况下,仍在承重骨部位出现压缩性骨折,此时就需要骨科或放疗科的局部干预。
在使用地舒单抗等骨保护药物时,要对患者进行充分宣教,强调常规补充活性钙和维生素D的重要性。同时,虽然风险相比双膦酸盐类药物较低,仍需关注下颌骨坏死,建议患者在治疗前处理好活动性口腔疾病。
排版编辑:肿瘤资讯-IRIS











 苏公网安备32059002004080号
苏公网安备32059002004080号


