本文概要
非小细胞肺癌
EGFR突变
1.NeoADAURA研究:术前新辅助,III期,奥希替尼,R0切除高达95%,N2降期达53%
EGFR-TKI耐药
2.SACHI研究:MET扩增,III期,奥希替尼+赛沃替尼 vs 含铂化疗,PFS为8.2 vs 4.5个月
3.HERTHENA-Lung02研究:III期,HER3-DXd vs 含铂化疗,已撤回上市申请
4.OptiTROP-Lung03研究:III期,芦康沙妥珠单抗 vs 多西他赛,OS获益
HER2突变
5.REZILIENT1研究:后线,2b期,Zongertinib(CLN-081),ORR为35.2%,PFS为9.5个月
ALK融合
6.ALNEO研究:术前新辅助,II期,阿来替尼,MPR为46%,pCR为12%
KRAS G12C
7.KRYSTAL-7研究:一线,Adagrasib+K药,PDL1高表达获益明显
免疫治疗
8.SWOG/NRG S1914研究:早期不可手术,III期,T药(新辅助/辅助)+SBRT vs 标准治疗,OS无差异
9.CheckMate816研究:术前新辅助,III期,O药+化疗 vs 化疗, OS胜出
10.CAMPASS研究:一线,III期,贝莫苏拜单抗+安罗替尼 vs K药,PFS为11 vs 7.1个月
11.TROPION-Lung02研究:一线,Ib期,Dato-DXd+K药±含铂化疗,疗效值得进一步探索
小细胞肺癌
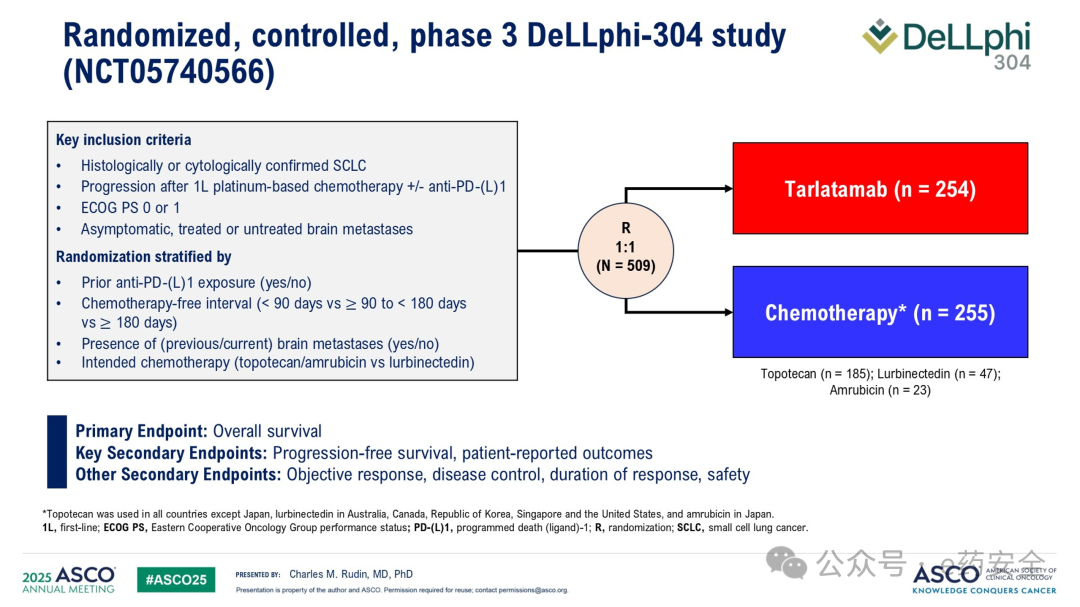
12.DeLLphi-304研究:二线,III期,Tarlatamab vs 标准治疗,OS为13.6 vs 8.3个月
13.一项研究:后线,II期,ZG006,ORR高达62.5%
14.一项研究:后线,I期,BL-B01D1,ORR为44.8%,OS为12.0个月
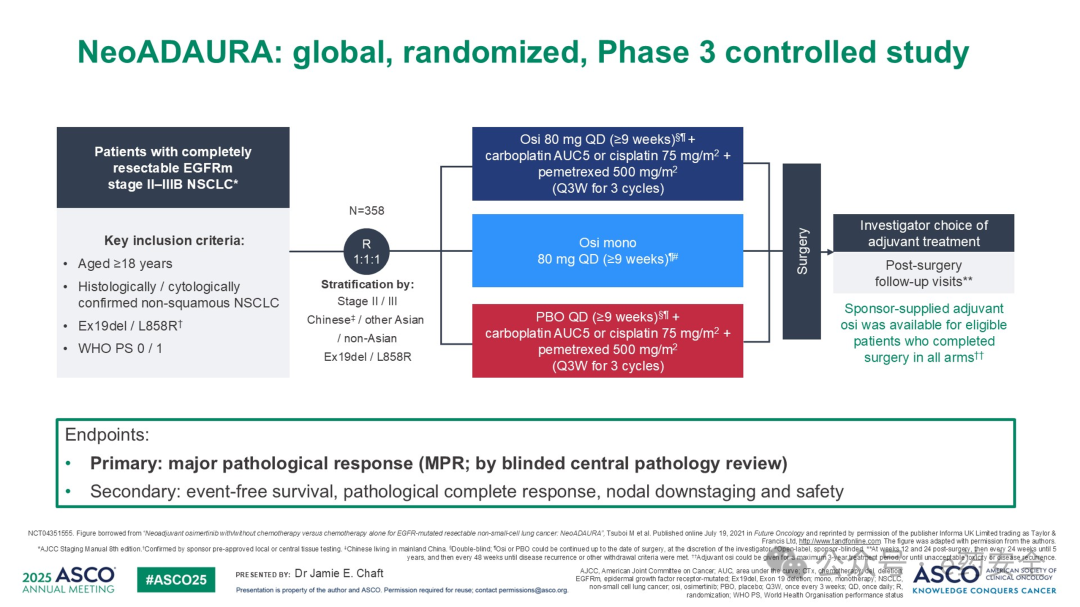
研究设计
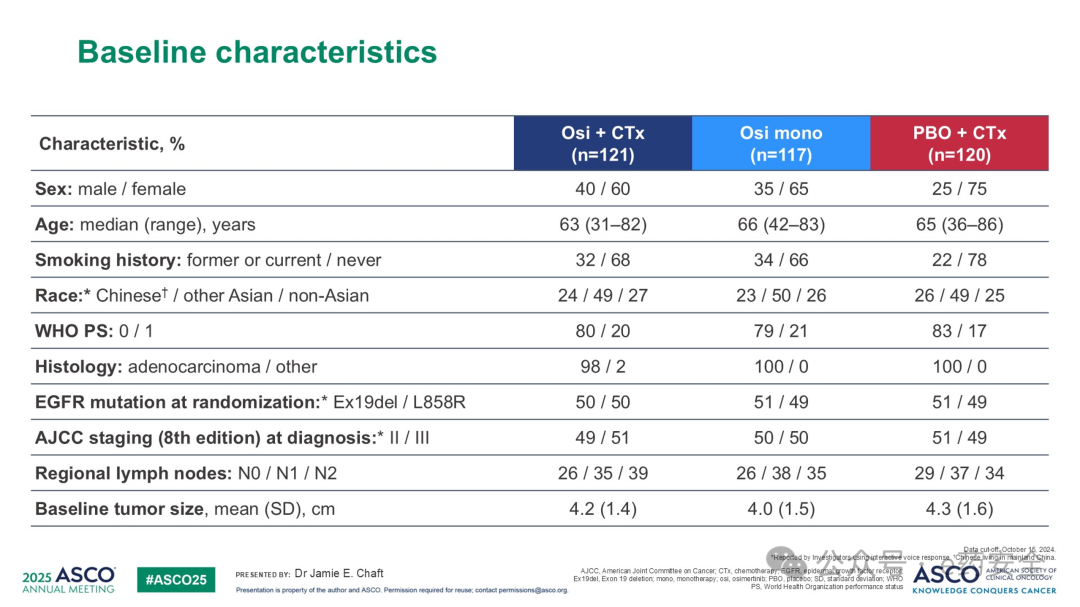
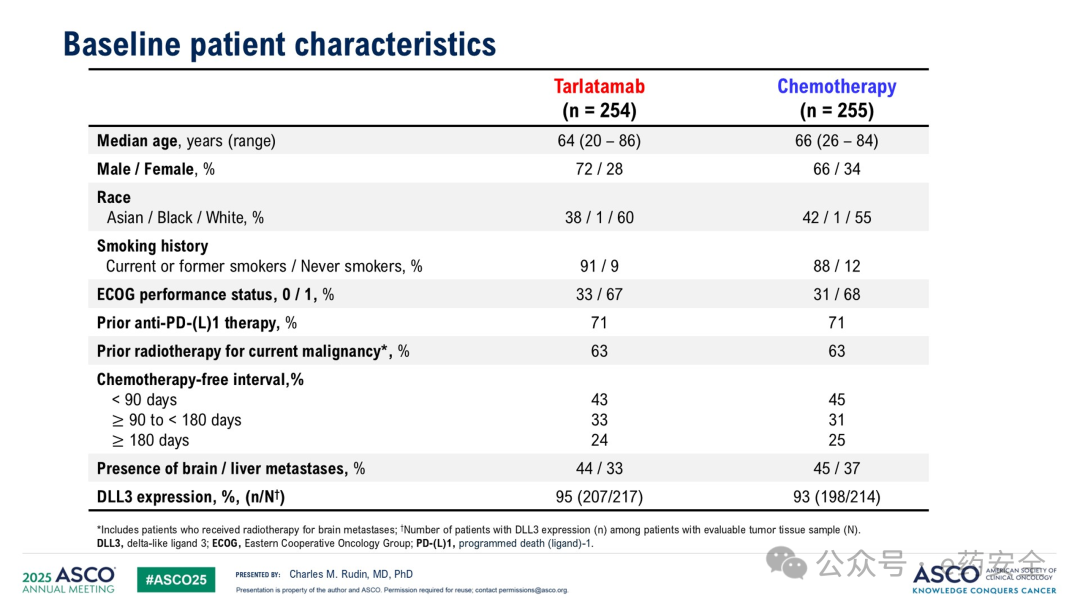
基线特征
研究结果:数据统计截止至2024年10月15日。研究结果研究共纳入358例随机分组患者。各组均有较高的手术切除率。
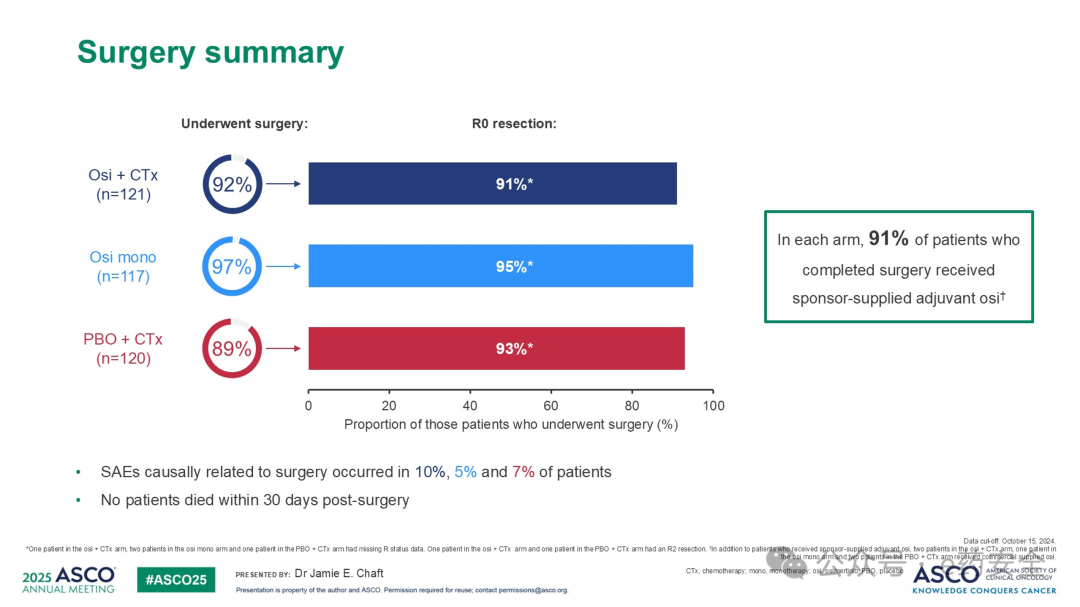
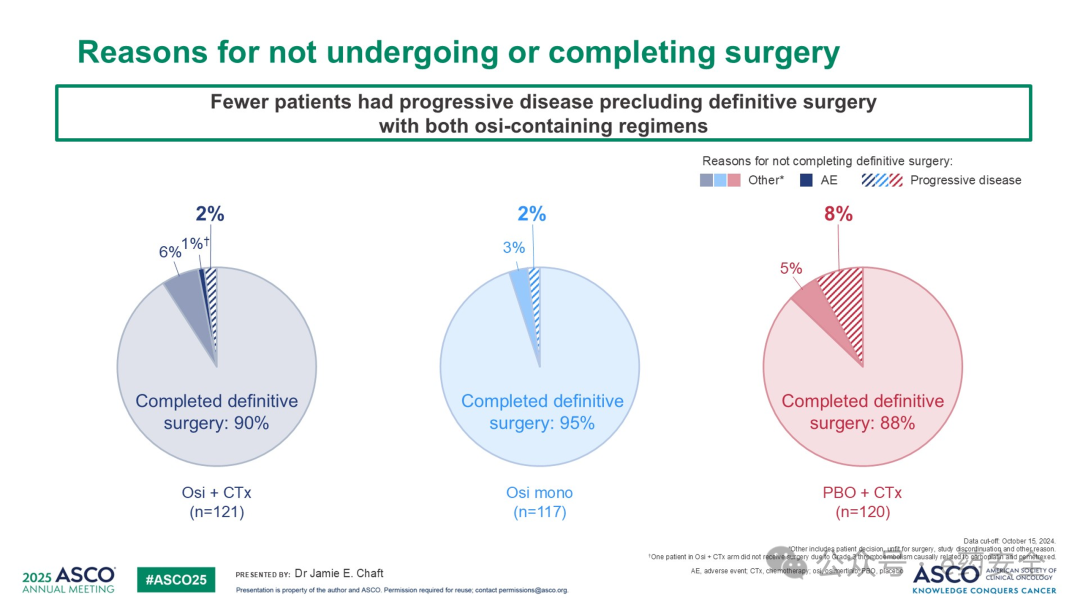
奥希替尼联合化疗组和奥希替尼单药组相较于安慰剂联合化疗组,MPR率显著更高(26% vs 25% vs 2%),而 PCR率则是4% vs 9% vs 0%。EFS(15%成熟度)数据提示奥希替尼联合化疗组和奥希替尼单药组均显示出较安慰剂联合化疗组有一定的生存优势。各个组术后均有超过80%的患者术后接受了奥希替尼辅助治疗。
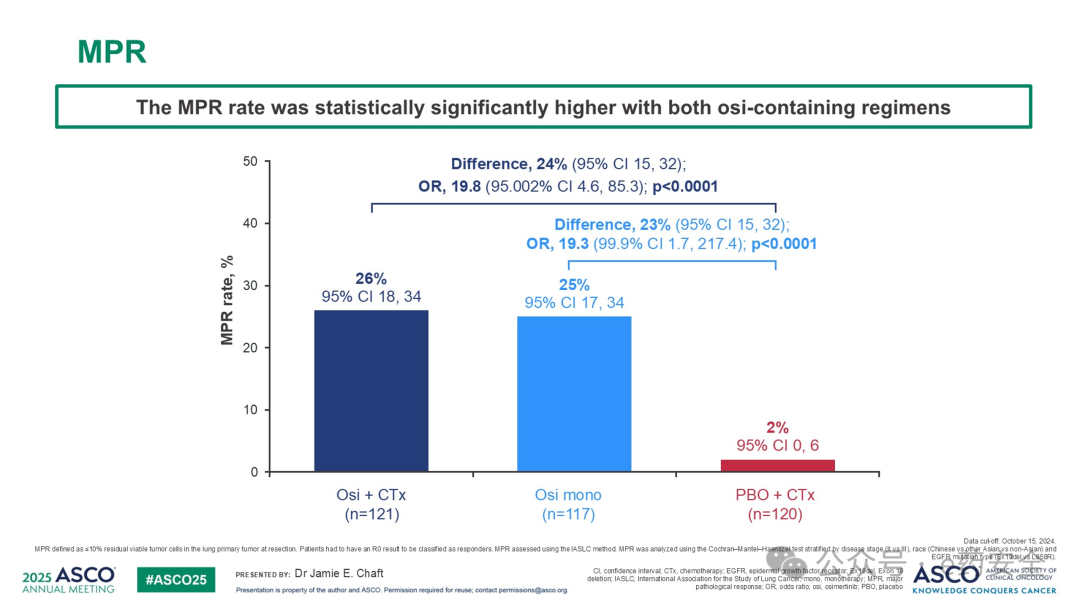
MPR
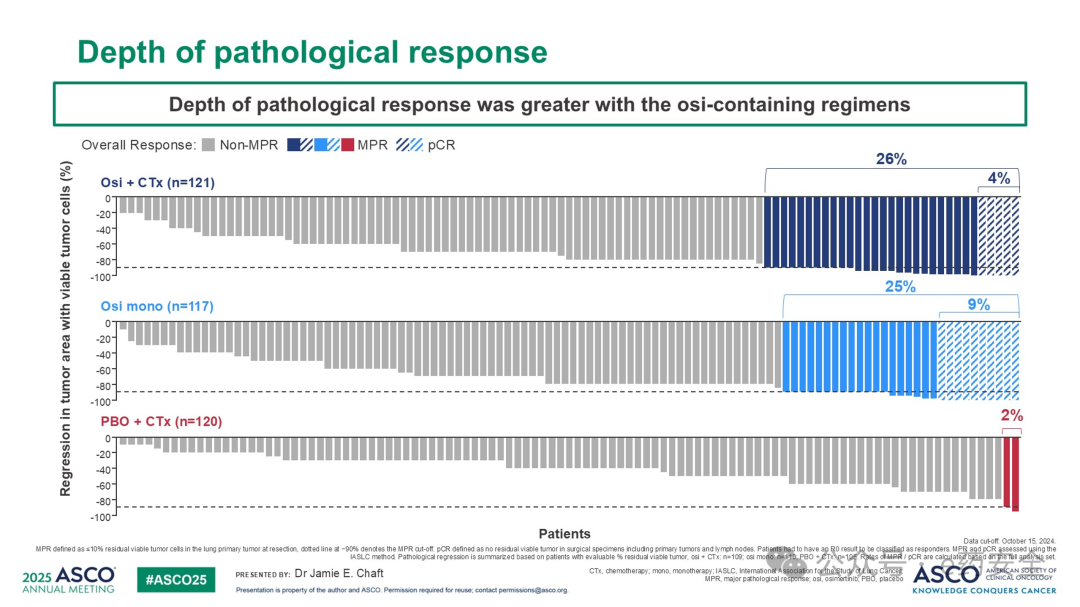
病理缓解程度
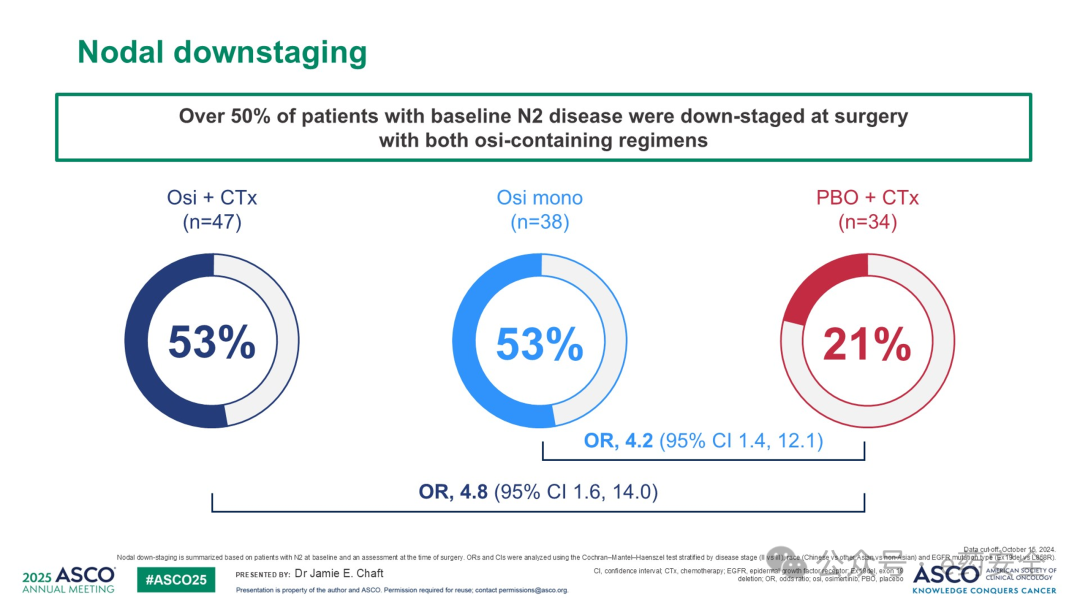
N降期
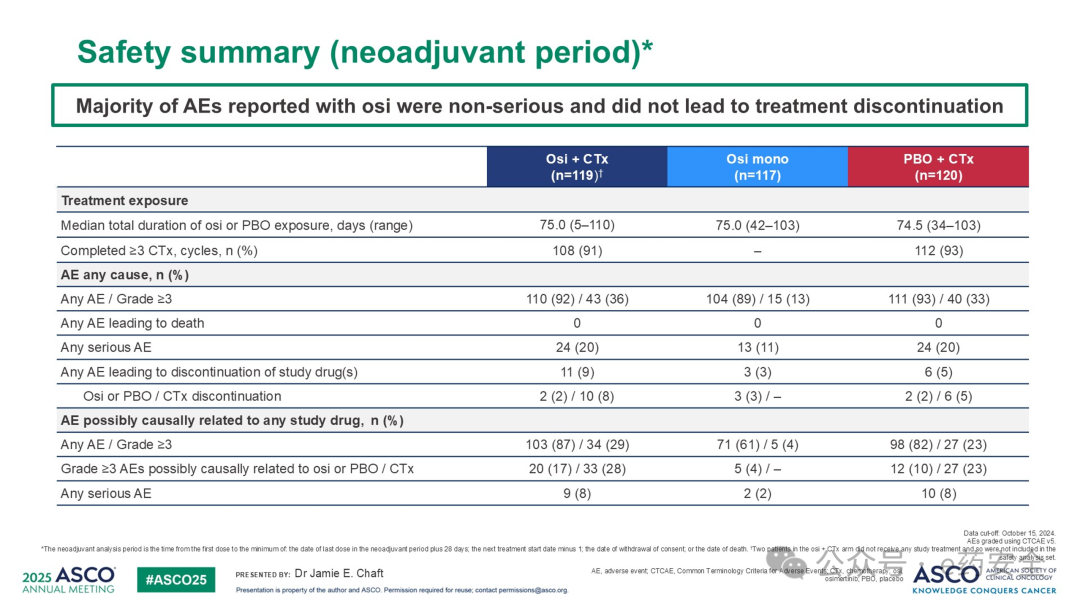
安全性
SACHI研究
陆舜教授汇报研究结果
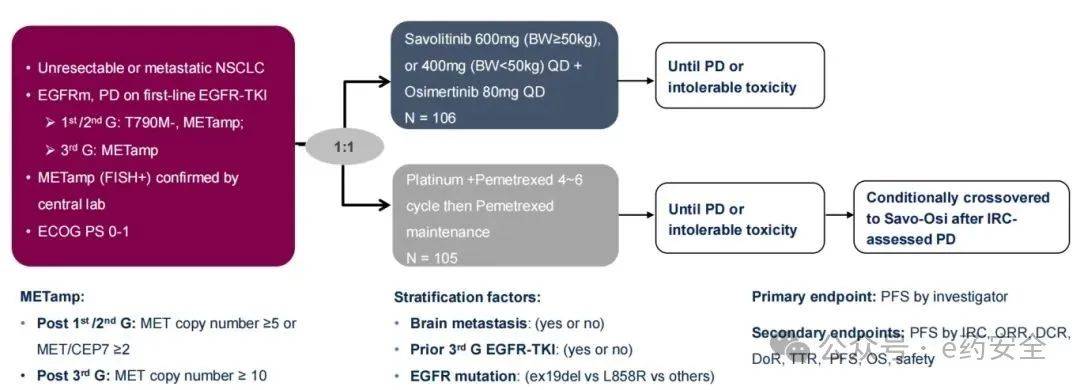
研究设计
研究结果:无论是在既往一/二代EGFR-TKI经治人群中还是在ITT人群中,双靶联合组较化疗组经研究者评估的中位PFS均得到显著延长。 在既往一/二代EGFR-TKI经治人群中,双靶联合组、化疗组的中位PFS分别为9.8个月vs 5.4个月 ;在ITT人群中,分别为8.2个月 vs 4.5个月。两分析集经IRC评估的PFS获益与研究者评估一致。 在既往三代EGFR-TKI经治人群中,双靶联合组的中位PFS同样得到显著延长(6.9个月 vs 3.0个月,HR=0.32,p<0.0001)。
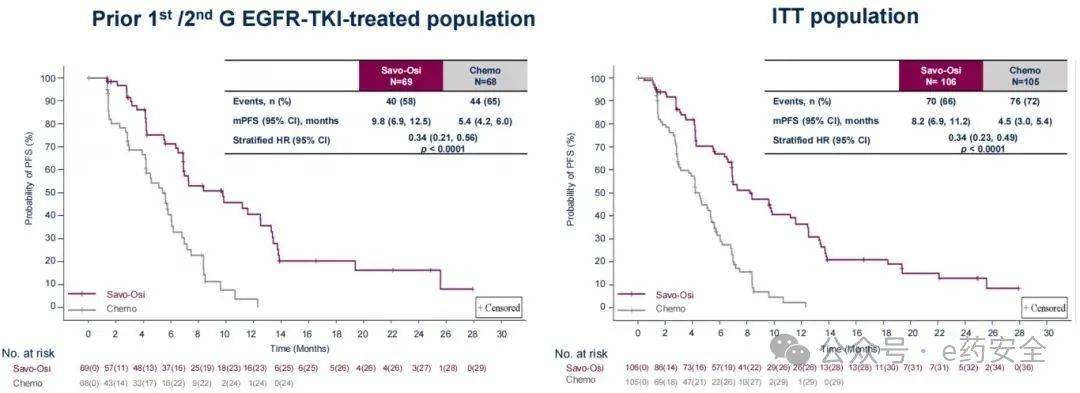
经研究者评估的PFS
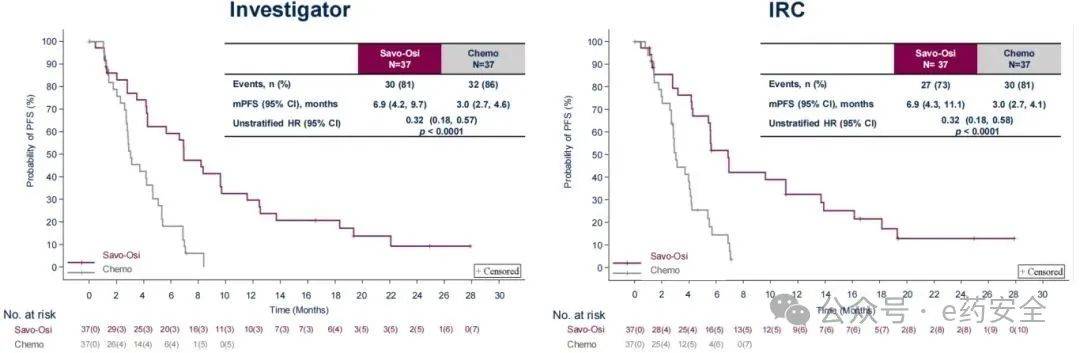
既往三代EGFR-TKI经治人群PFS
此外,亚组分析提示,双靶联合治疗在包含脑转移亚组在内的多个亚组中均显示出与总人群一致的PFS获益。OS数据尚未成熟(成熟度40%),中位OS为双靶联合组22.9个月 vs 化疗组17.7个月,(HR=0.84,95% CI:0.55-1.29),需要说明的是化疗组有55例(52%)患者在后续接受了MET抑制剂治疗(45例接受研究方案交叉治疗,10例接受其他MET抑制剂治疗)。
在疗效应答方面,双靶联合组、化疗组分别为58% vs 34%;DCR分别为89% vs 67%;中位DoR分别为8.4个月 vs 3.2个月。
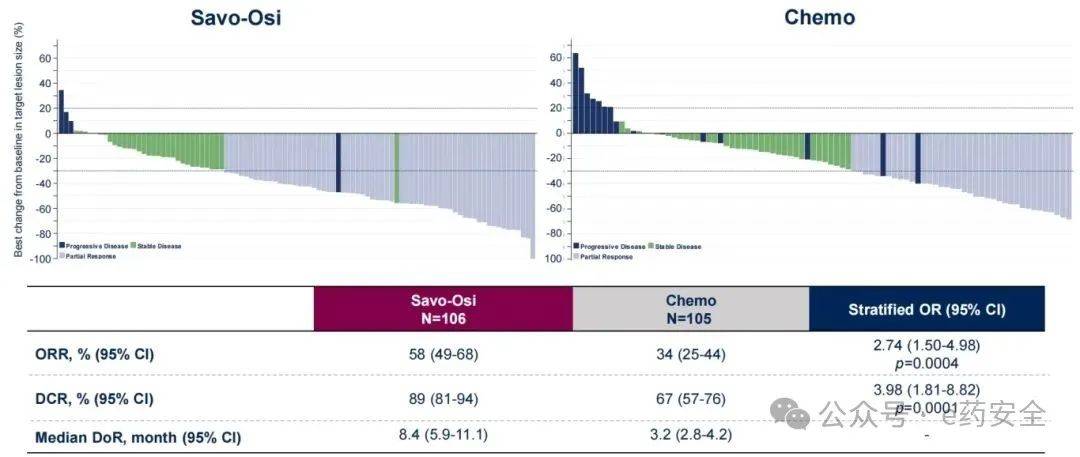
ITT人群肿瘤缓解状况
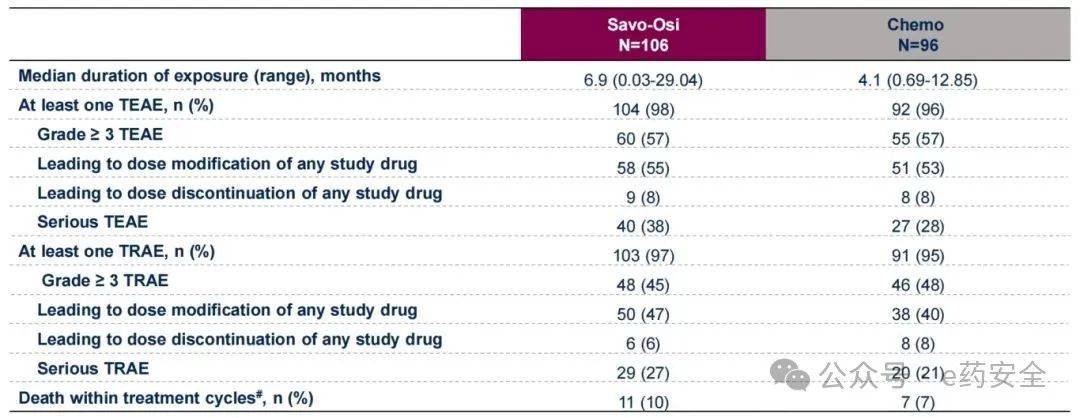
安全性数据
在安全性方面,双靶联合组和化疗组≥3级治疗相关不良事件(TRAE)发生率相当(45% vs 48%),且双靶联合组的血液学不良事件发生率更低。提示赛沃替尼联合奥希替尼治疗整体安全性良好。
Patritumab deruxtecan(HER3-DXd)是一款靶向 HER3 的 ADC,由第一三共和默沙东共同开发和商业化 (日本除外) 。 HERTHENA-Lung02是一项多中心、随机、开放标签的Ⅲ期研究,评估HER3-DXd与标准铂类化疗对比,在接受三代EGFR TKI治疗后出现疾病进展EGFR突变晚期非小细胞肺癌中的疗效和安全性 。主要终点为 BICR 评估的无进展生存期(PFS)。关键次要终点为总生存期(OS)。
研究结果: 586人被随机分配到HER3-DXd或铂类化疗(中位年龄,64岁;61%女性;60%亚洲人)。 HER3-DXd显著改善了PFS(HR=0.77;95%CI,0.63-0.94;P=.011)。HER3-DXd与 铂类化疗 的mPFS为5.8 vs 5.4个月 。HER3-DXd与 铂类化疗 的PFS率在6个月时为50% vs 38%;9个月时为29% vs 19%;12个月时为18%vs 15%。HER3-DXd与含铂化疗的ORR为35.2% vs 25.3%。HER3-DXd与含铂化疗的DOR为5.7 vs 5.4个月。在基线时脑转移患者中,HER3-DXd(n=105)的颅内PFS中位数为5.4个月,含铂化疗(n=95)为4.2个月(HR,0.75;95%CI,0.53-1.06)。在本次方案规定的期中数据截止时,总生存期(OS)数据尚不成熟。
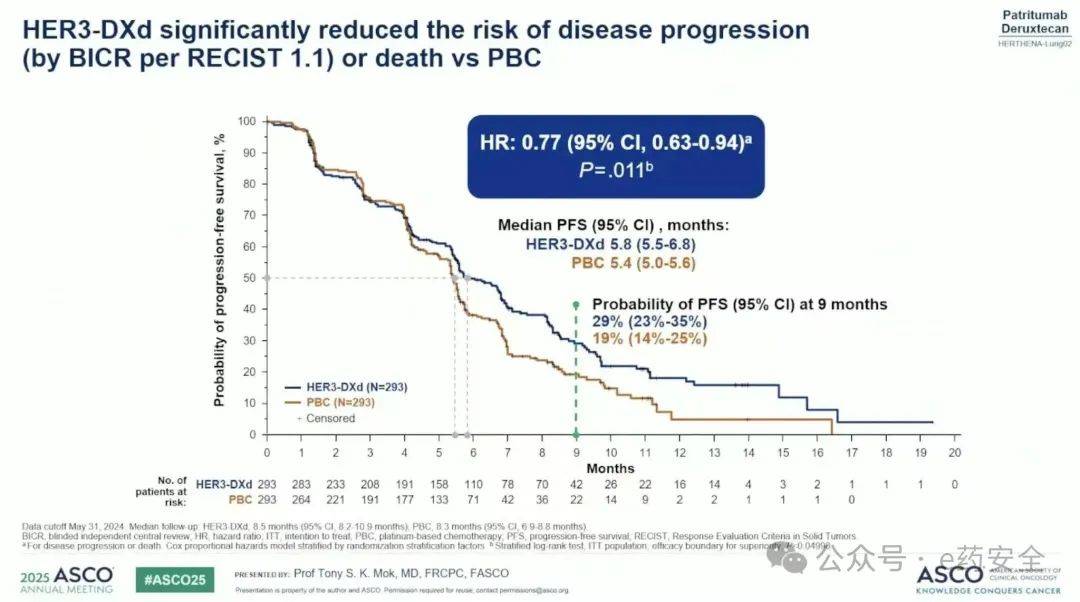
PFS
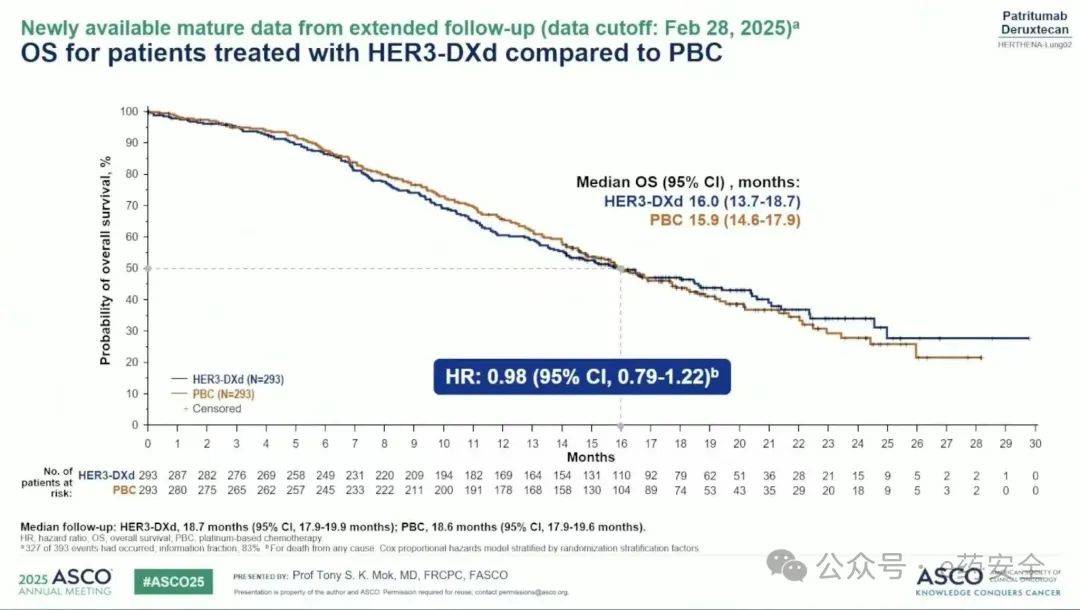
OS
不过,就在5月29日,第一三共和默沙东联合发布新闻稿称,HER3-DXd在 HERTHENA-Lung02 III 期临床试验中的 OS 结果未达到统计学显著性,双方也因此 撤回了 HER3-DXd 向 FDA 递交的针对 NSCLC 的上市申请 。
OptiTROP-Lung03研究:是一项随机对照、多中心研究, 旨在探索芦康沙妥珠单抗对比多西他赛在EGFR-TKIs和含铂化疗治疗后进展的EGFR敏感突变NSCLC患者中的疗效与安全性。入组患者以2:1比例随机分至芦康沙妥珠单抗组和多西他赛组,其中多西他赛组患者经盲态独立评审委员会(BIRC)确认疾病进展(PD)后可交叉接受芦康沙妥珠单抗治疗。研究终点采用多重检验序列,依次检验ORR、PFS以及总生存期(OS),并通过秩保持结构失效时间(RPSFT)模型校正交叉治疗对OS的影响。
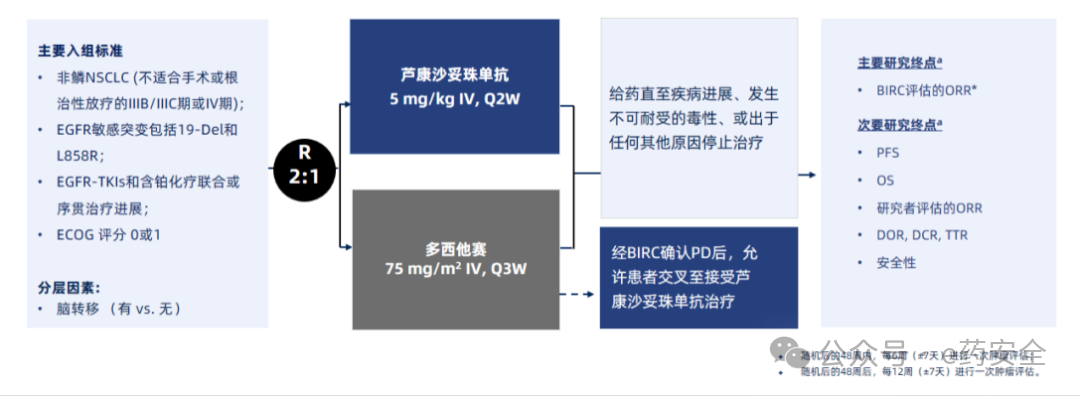
研究设计
研究结果:截止2024年12月31日,中位随访时间已达12.2个月。与多西他赛组相比,芦康沙妥珠单抗组确认的客观缓解率(ORR)(BIRC评估:45.1% vs 15.6%,单侧p=0.0004)、 中位无进展生存期(PFS)(BIRC评估:6.9个月 vs 2.8个月,HR=0.30,单侧p<0.0001;研究者评估:7.9个月 vs 2.8个月,HR=0.23)。
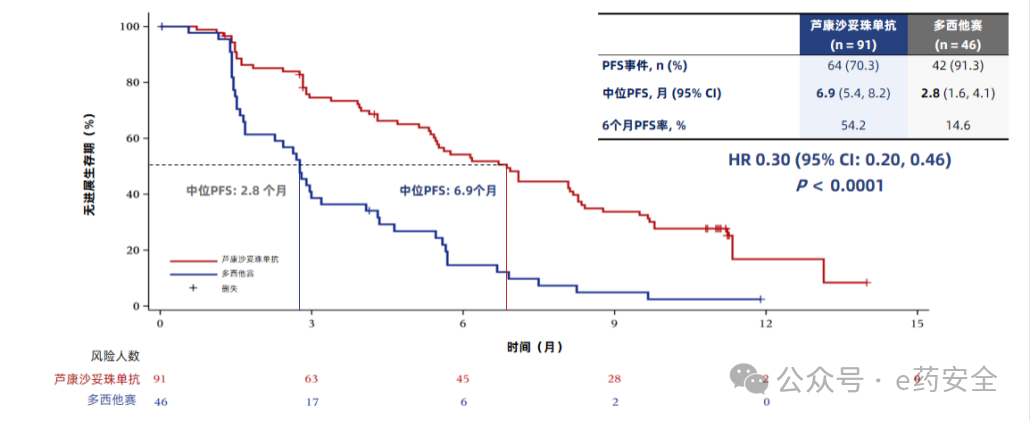
BIRC评估的PFS
中位总生存期(OS)(两组中位OS均未达到,HR=0.49,单侧p=0.007)均显著高于多西他赛组,且多西他赛组36.4%的患者交叉至芦康沙妥珠单抗组,经RPSFT模型调整后,多西他赛组中位OS为9.3个月,芦康沙妥珠单抗组未达到(OS HR=0.36),死亡风险降低64%。
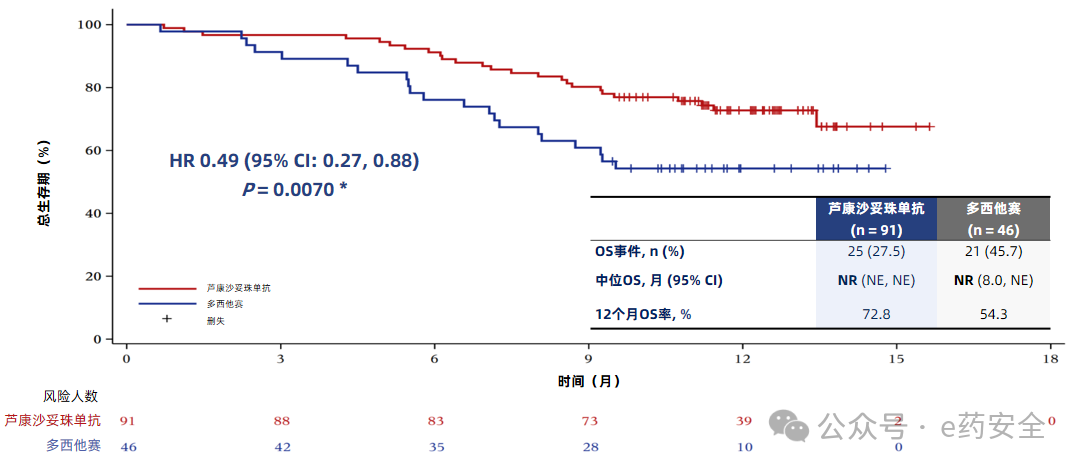
OS曲线
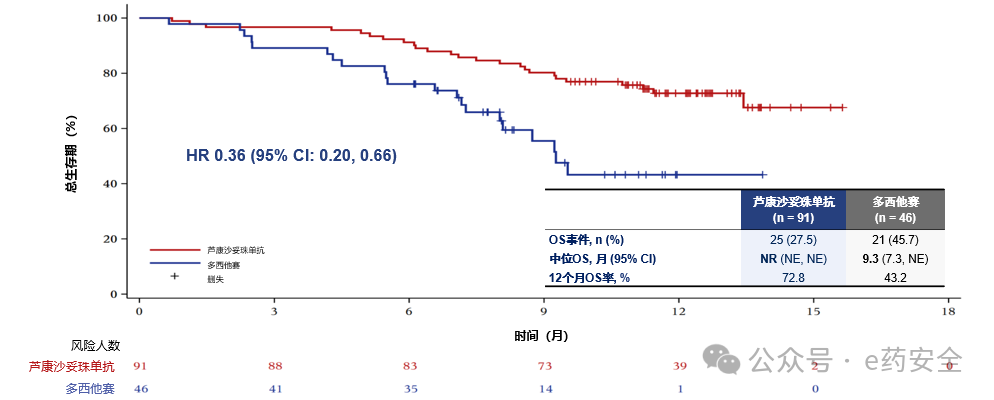
经PRSFT模型校正的OS曲线
在安全性方面,芦康沙妥珠单抗未发现新的安全性信号,与既往报道一致,两组最常见的治疗相关不良事件(TRAEs)均为血液学毒性,但芦康沙妥珠单抗组≥3级TRAE和严重TRAE发生率低于多西他赛组,且未发生间质性肺炎(ILD)。
埃万妥单抗(amivantamab)已获批用于EGFR外显子20插入(ex20ins)突变非小细胞肺癌(NSCLC)。Zipalertinib(zipa,CLN-081,TAS6417)是一种新型EGFR-TKI,在以往的一项1/2a期研究中,Zipalertinib在含铂化疗后出现进展的ex20ins突变NSCLC患者中,显示出良好的临床活性和可控的安全性。本文报告了关键性2b期REZILIENT1研究的主要数据, 此研究评估了Zipalertinib在既往接受含铂化疗后出现疾病进展的晚期或转移性EGFR ex20ins突变NSCLC患者中的疗效 。
患者被纳入两个平行队列:既往接受过含铂化疗、既往接受过含铂化疗和埃万妥单抗治疗,并接受Zipalertinib,100mg,每日两次治疗。通过盲法独立中心审查(BICR)按照RECIST v1.1标准评估肿瘤缓解情况。稳定、无症状或已接受治疗的脑转移(mets)患者均可入组。
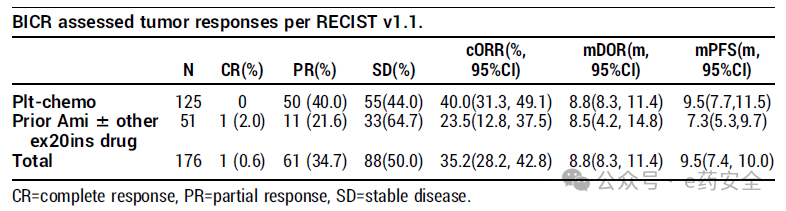
肿瘤治疗反应
研究结果: 截至2024年12月10日,共入组176例患者,其中51例既往接受过埃万妥单抗,125例接受过含铂化疗,中位随访期为9.3个月:中位年龄:65岁,既往治疗中位线数为2,既往PD1-1/PD1-L1占比56.8%,脑转移病史患者占比38.6%。在所有接受治疗的患者中, Zipalertinib组的确认ORR(cORR)为35.2%,中位DoR为8.8个月,中位PFS为9.5个月 。接受含铂化疗但未接受过埃万妥单抗患者的cORR为40.0%。在51例既往接受过埃万妥单抗的患者中,30例未接受其他针对EGFR ex20ins靶向治疗,21例接受过其他ex20ins药物(例如mobocertinib、舒沃替尼、BLU-451或poziotinib),两类患者的cORR分别为30.0%和14.3%。在所有脑转移患者中,cORR为30.9%。最常见的治疗期间不良事件(TEAE,所有级别)包括甲沟炎、皮疹、贫血、腹泻、皮肤干燥、恶心和口腔炎,大多数TEAE为1级或2级CTCAE。
研究结果:2021年5月至2024年7月期间,20家意大利中心的共计33例患者纳入分析。中位年龄62周岁,70%的患者为女性,52%为不吸烟患者。IIIa期和IIIb期患者占比分别为64%和36%。最常见的分期为T3N2 (n=8, 24%),其次是T1aN2 (n=4, 12%)、T2aN2 (n=4, 12%)、T4N0 (n=4, 12%)和T4N2 (n=4, 12%)。所有患者均完成新辅助治疗,85%(28例)的患者接受手术,其中86%(24例)为R0切除。完成手术的患者,79%(26例)的患者接受术后辅助治疗,术后辅助治疗的中位开启时间为5.1周,19%的患者完成术后辅助治疗。 全组患者MPR为46%(15例),p-CR为12%(4例),ORR为67%(22例)。经过中位15.2个月的随访,94%(31例)的患者仍然存活,中位EFS和OS尚未达到,18%(6例)的患者出现疾病进展或复发。在新辅助和辅助治疗阶段,3度以上不良反应发生率为9%和8%。
小结:ALNEO研究达到了其主要研究终点,提示阿来替尼新辅助治疗可切除的III期ALK阳性非小细胞肺癌患者可行。
KRYSTAL-7研究

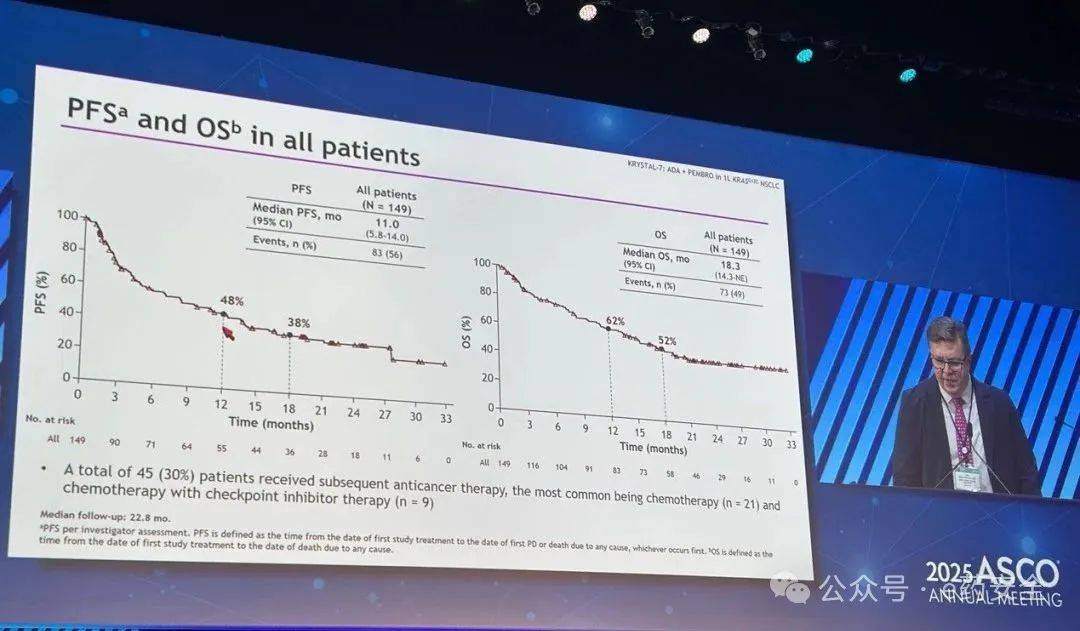
PFS和OS
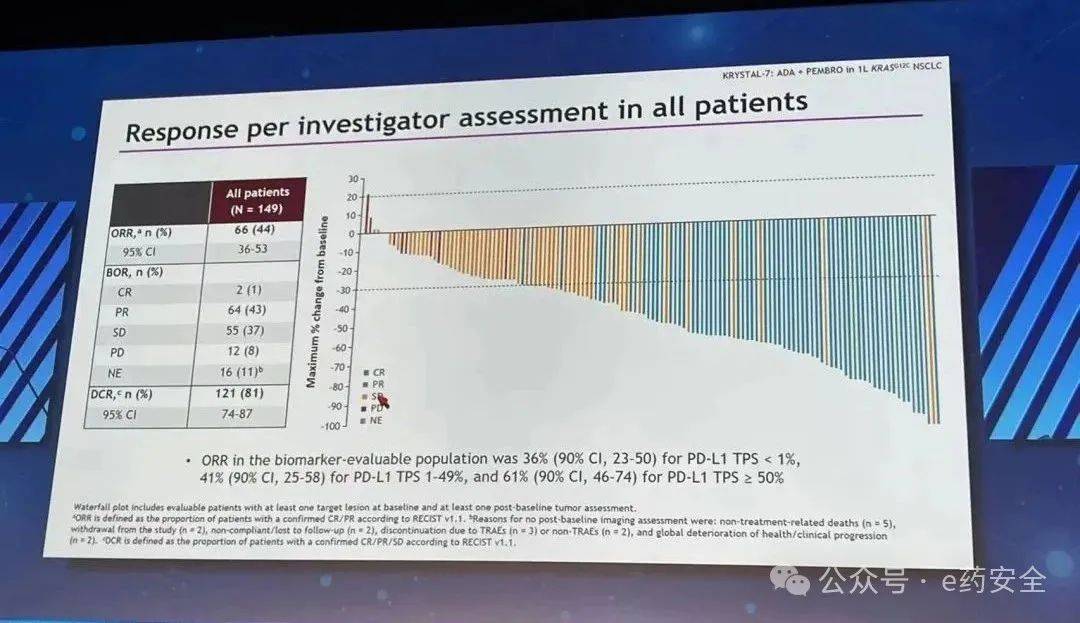
抗肿瘤反应
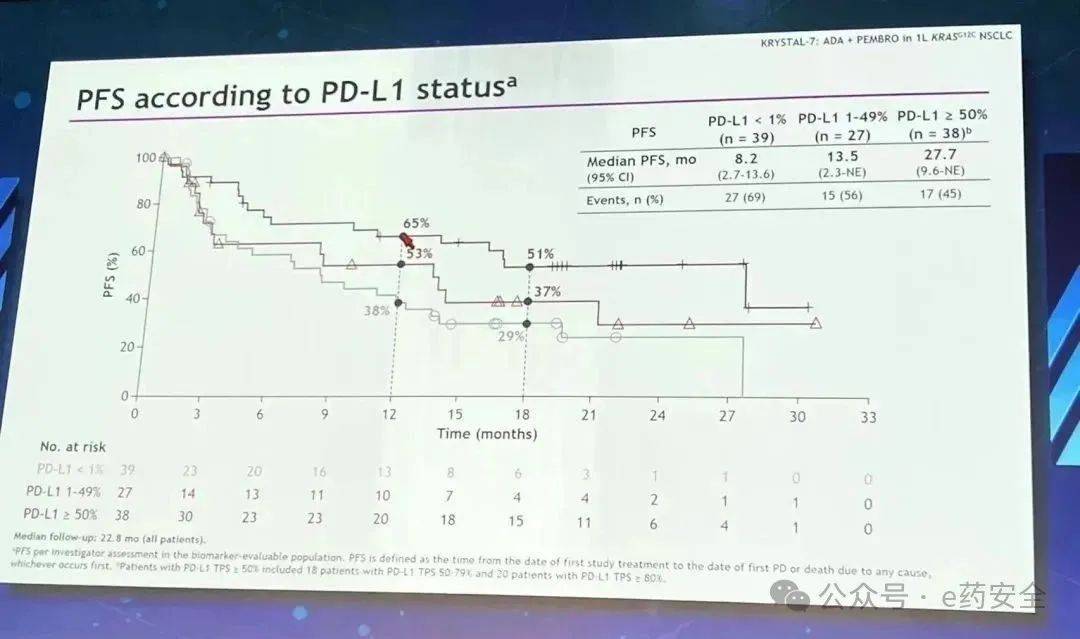
PFS【不同PDL1状态】
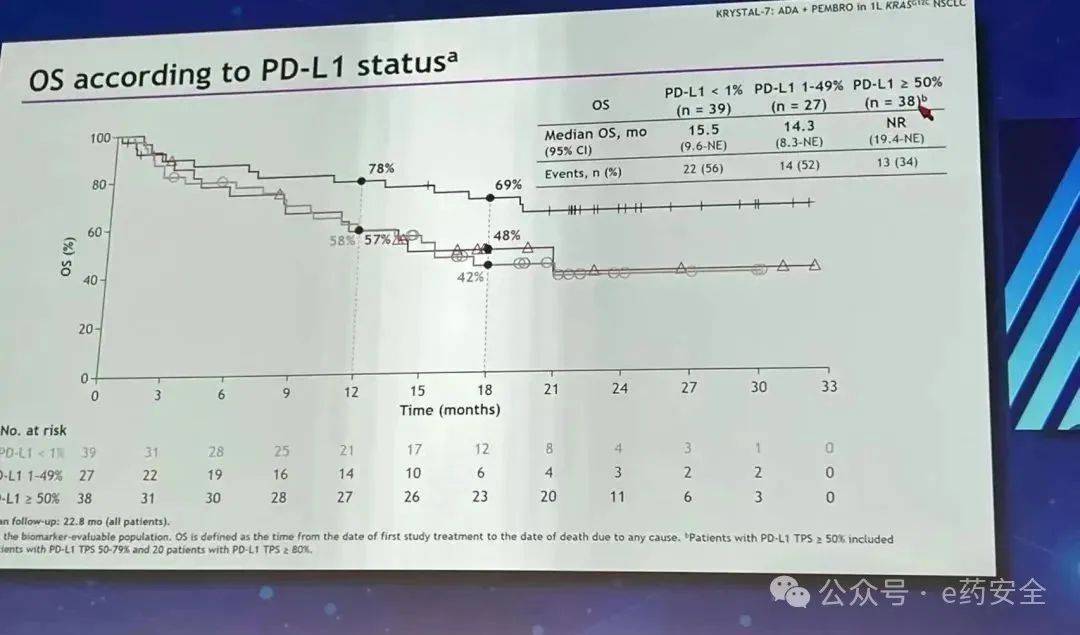
OS【不同PDL1状态】
非小细胞肺癌-免疫治疗
SWOG/NRG S1914
研究结果: 2020年8月13日至2024年9月6日,共417例患者接受随机分组,403例符合入组标准(标准治疗组 201 例,联合治疗组202例)。根据预设的OS和PFS无效性分析条件,研究在首次中期分析时提前终止入组。幸存患者的中位随访时间12 个月。中位年龄为73岁,89% 的患者为PS 0-1分。中位肿瘤直径为2.3cm。标准治疗组6例和联合治疗组8例患者未接受方案规定治疗。
主要终点OS方面,研究共发生49例死亡事件,两组OS无显著差异(HR=1.15,95%CI 0.65-2.01,p=0.63) ;2年OS率方面,标准治疗组和联合治疗组分别为 82% vs 80%。PFS结果方面,研究共发生88例PFS事件,联合治疗组PFS未显著改善(HR =1.35,95%CI 0.89-2.06,p=0.16);2年PFS率方面,标准治疗组和联合治疗组分别为71% vs 60%。
安全性方面结果显示,联合治疗组≥3级不良事件发生率更高(12% vs 2%),包括 1例5级呼吸衰竭。
CheckMate816研究
研究结果: 中位随访 68.4 个月显示, 联合治疗组5年OS率达 65.4%,显著高于化疗组的55.0%(HR,0.72;P=0.048) ,亚组分析显示获益广泛。EFS 获益同步显著(5 年EFS 率, 49.2% vs. 34.4%;HR,0.68),且远处转移风险降低45%(20.7% vs. 11.4%),尤其中枢神经系统转移率显著下降。
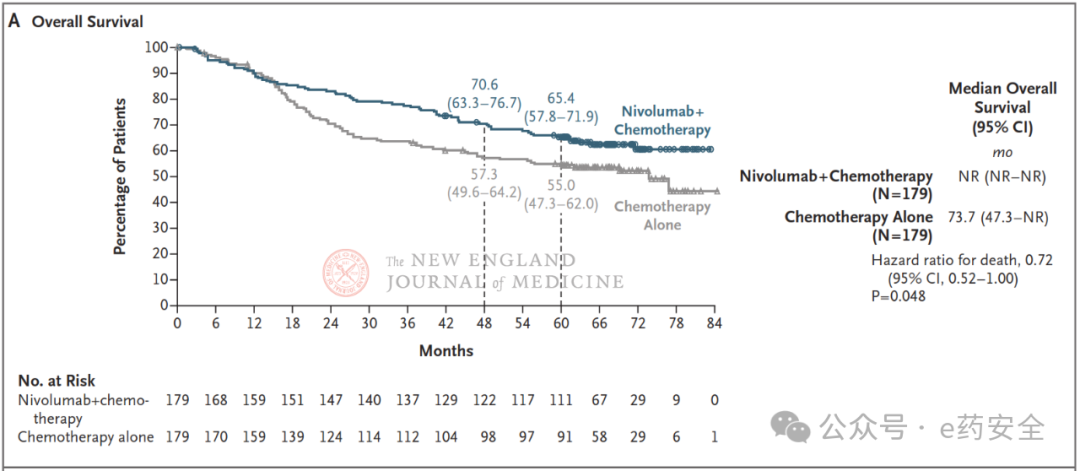
所有患者的的OS
生物标志物分析揭示 , 联合治疗组pCR患者5年OS率高达95.3%,未达pCR者仅55.7%(HR,0.11) ,与NADIM试验结果一致; 治疗后ctDNA清除患者5年OS率达75.0%,显著优于未清除者(52.6%) 。这证实pCR与ctDNA可作为预测长期生存的核心指标。
CAMPASS研究:是一项随机对照III期临床研究,旨在评估贝莫苏拜单抗联合安罗替尼与帕博利珠单抗联合安慰剂作为PD-L1阳性晚期NSCLC(aNSCLC)一线治疗的疗效与安全性。研究纳入PD-L1表达阳性的局部晚期或复发/转移性 NSCLC 受试者,以2∶1比例随机分组,分别接受“贝莫苏拜单抗联合安罗替尼”或帕博利珠单抗联合安慰剂治疗。研究的主要终点为独立评审委员会(IRC)评估的无进展生存期(PFS);次要终点包括总生存期(OS)、客观缓解率(ORR)及安全性指标等。
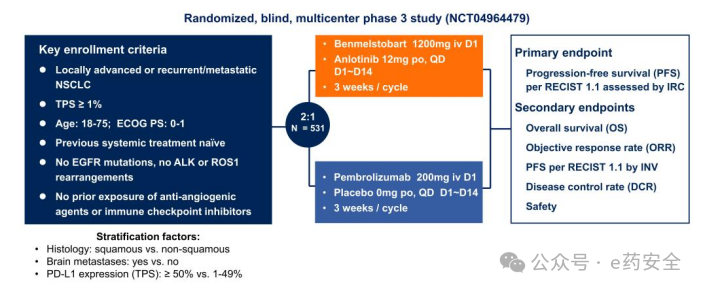
研究设计
研究结果:联合治疗组和 K 药治疗组的中位随访时间分别为 11.4 月和 10.6 月。在全人群中, 贝莫苏拜单抗联合安罗替尼治疗的中位 PFS 达到 11 个月,较 K 药治疗提升 3.9 个月,疾病进展/死亡风险降低 30%(HR=0.70)。
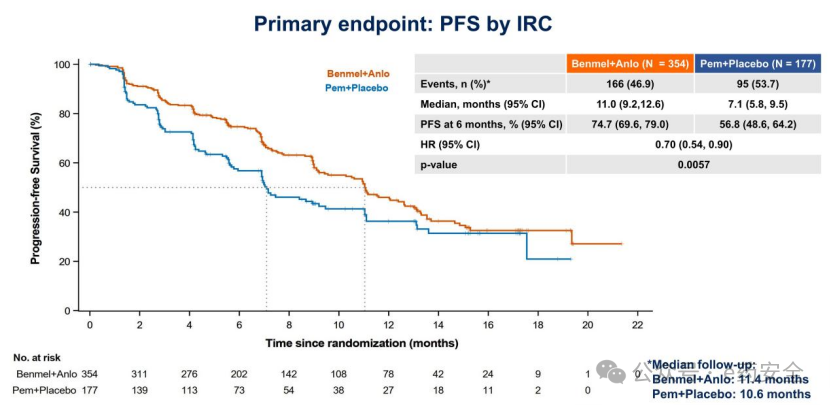
PFS
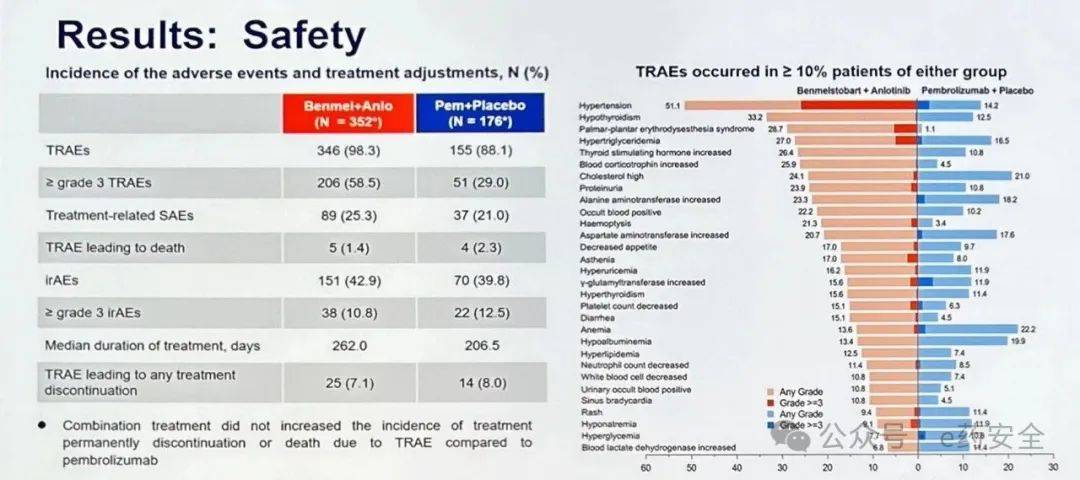
安全性
亚组分析显示,几乎所 有亚组均可从联合治疗方案中获益。特别是对于 TPS≥50% 人群,联合组较K药治疗,中位PFS提升 6.1 个月,疾病进展/死亡风险降低 40%(HR=0.60)。此外,联合治 疗经确认的肿瘤客观缓解率(ORR)和疾病控制率(DCR)分别为 57.3% 和 85.9%,均较K药治疗的 39.5% 和 79.1% 有显著提升。
安全性方面,联合组、K药组分别有98.3%和88.1%的患者发生了至少一项治疗相关不良事件,≥3级TRAE发生率分别为58.5%和29.0%。
TROPION-Lung02研究
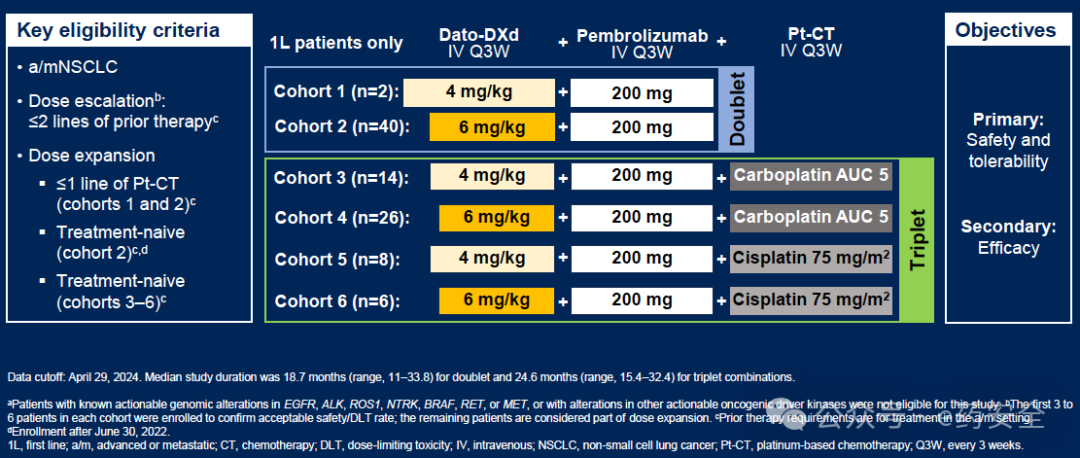
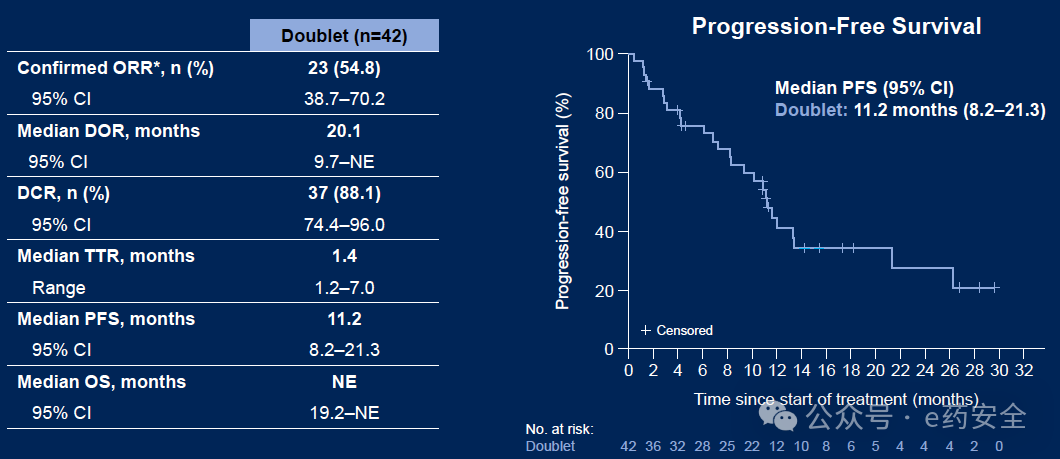
二联
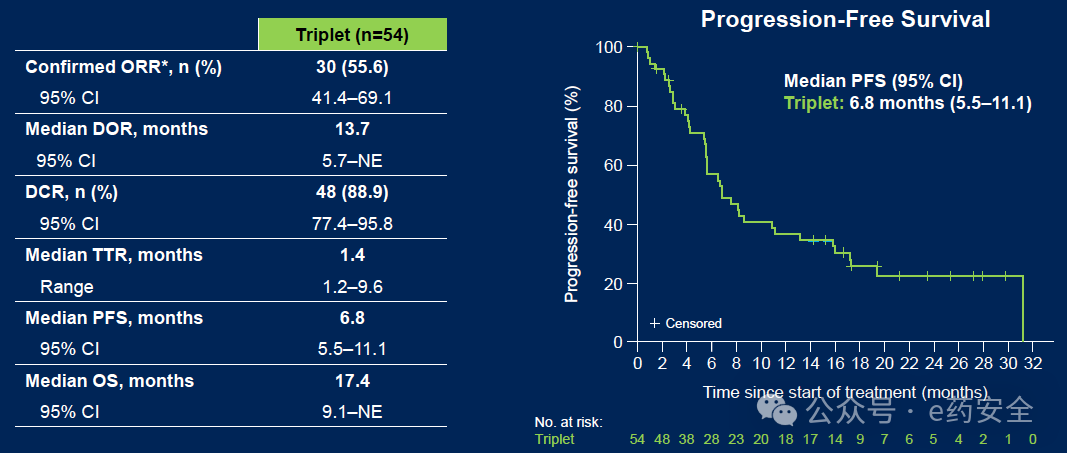
三联
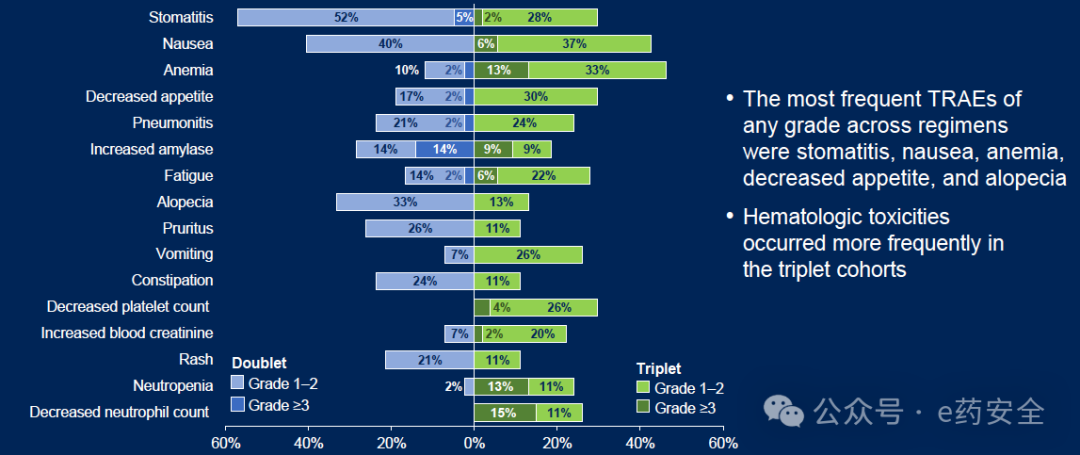
安全性方面,最常见的不良事件(AE)为口腔炎(双联57%,三联33%)和恶心(双联42%,三联48%),主要为1-2级。治疗相关严重AE发生率分别为12%(双联)和22%(三联),未发现与研究药物相关的死亡事件。
小细胞肺癌
研究设计
基线特征
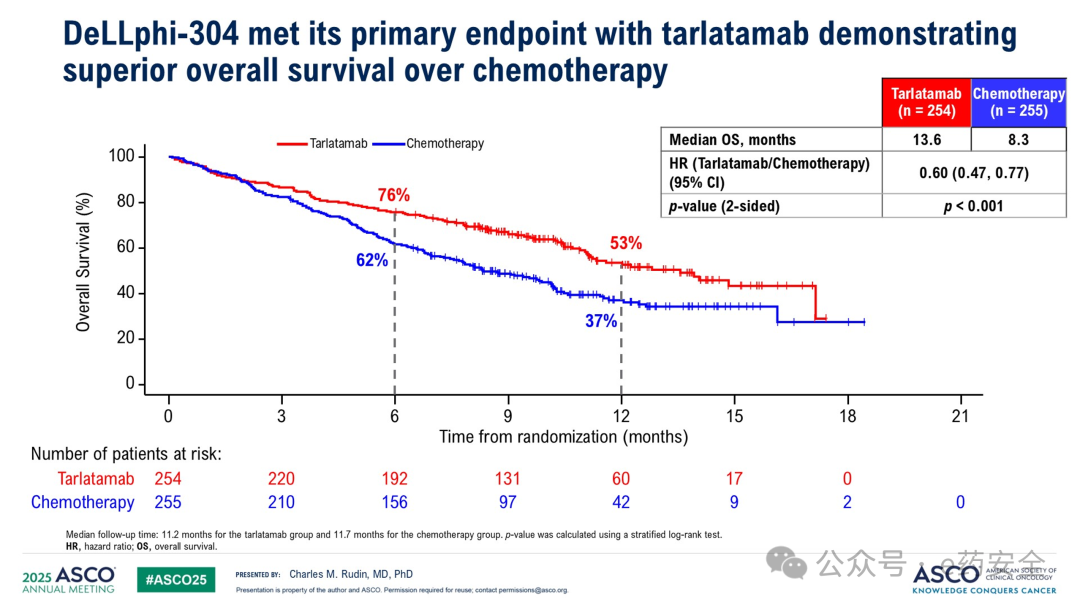
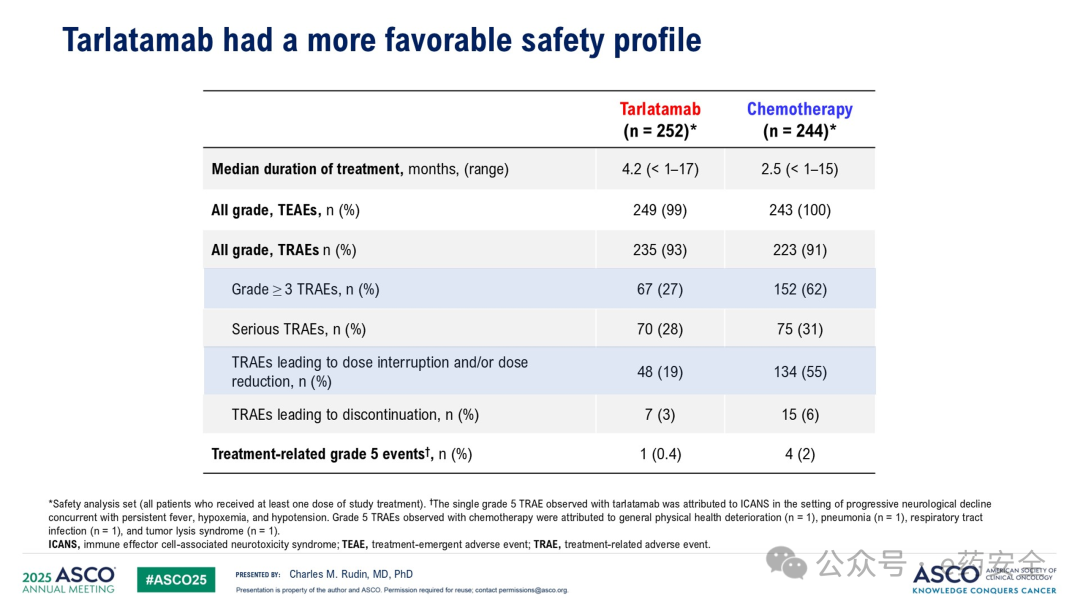
研究结果: 在 tarlatamab 组中位随访 11.2 个月、化疗组 中位随访 11.7 个月时, tarlatamab 组患者的 OS 较化疗组 显著延长( 13.6 个月 vs 8.3 个月, HR=0.60 , P<0.001 ), PFS 也显著延长( 4.2 个月 vs 3.2 个月, HR=0.72 , P<0.001 ) 。
OS
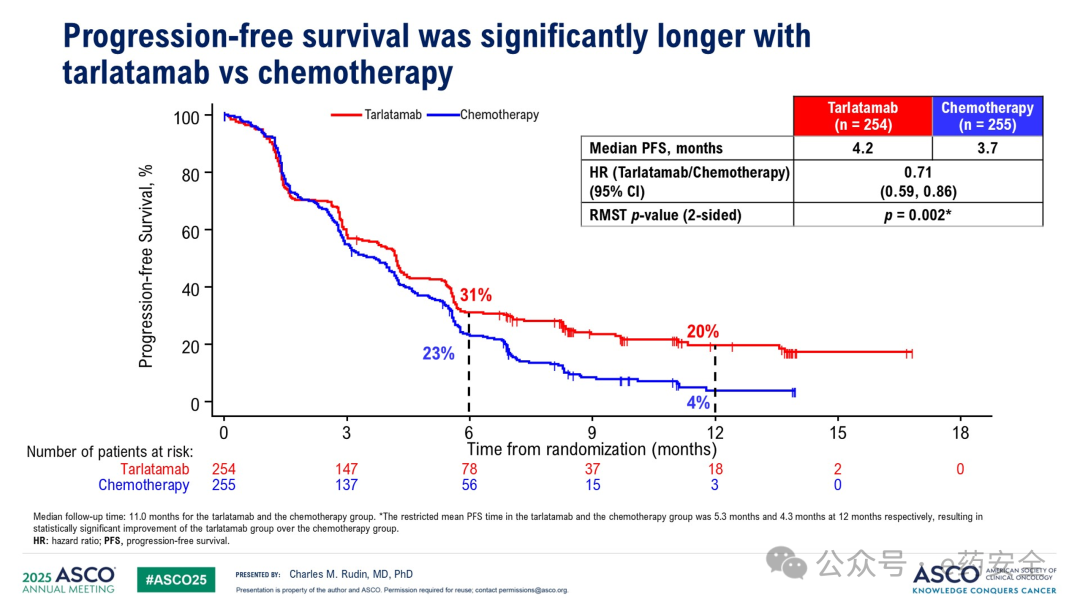
PFS
另外,Tarlatamab组的ORR为35%,而化疗组为20%。Tarlatamab组和化疗组的中位缓解时间分别为6.9个月和5.5个月。截至数据截止时,Tarlatamab组中有47%的患者仍在持续缓解,化疗组为15%。
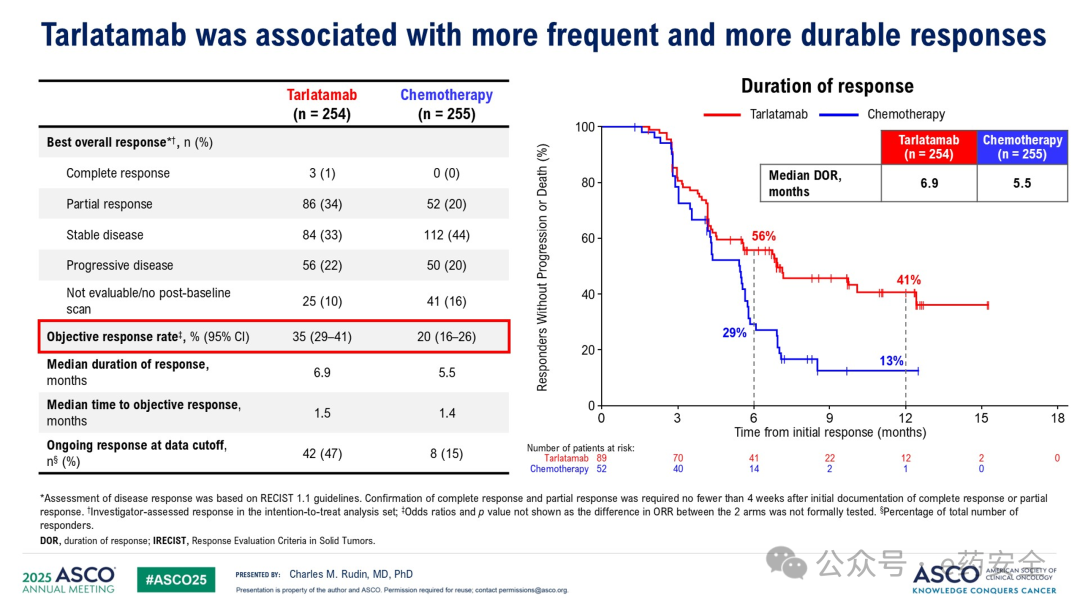
肿瘤缓解情况
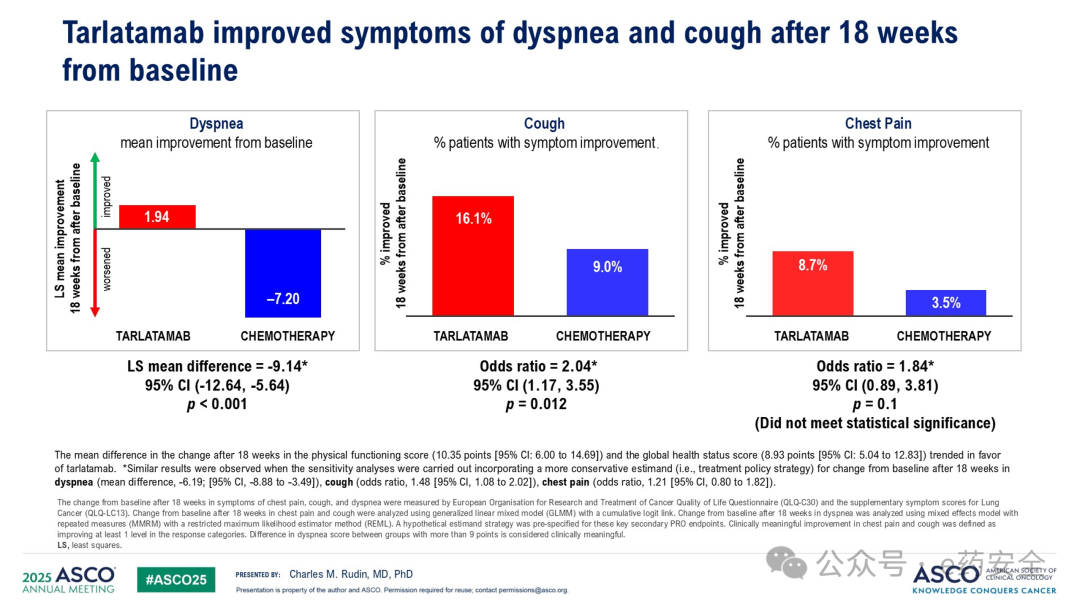
患者报告结局
在PROs方面,从基线到第18周,Tarlatamab组的呼吸困难评分平均改善为1.94,化疗组为-7.20;Tarlatamab组中有16.1%的患者报告咳嗽评分改善,化疗组为9.0%;Tarlatamab组和化疗组分别有8.7%和3.5%的患者报告胸痛改善,胸痛改善的差异未达到统计学意义。
<< 滑动查看下一张图片 >>
ZG006
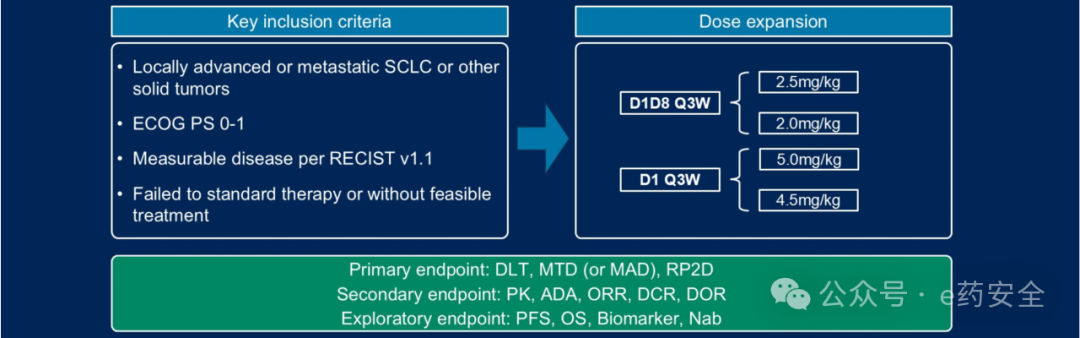
研究设计
研究结果:截至2024年12月5日,共纳入58例SCLC患者。所有接受至少一剂iza-bren治疗的患者均纳入分析。中位随访时间为16.4个月。 总体人群的总缓解率(ORR)为55.2%,确认的ORR为44.8%,中位无进展生存期(PFS)为4.0个月,中位总生存期(OS)为12.0个月。在52例接受2.5 mg/kg剂量治疗的患者中,有20例患者既往仅接受过一线PD(L)-1抑制剂联合铂类为基础的化疗(PBC)。在该亚组中,ORR为80.0%,确认的ORR为75.0%,中位缓解持续时间(DOR)为5.6个月,中位PFS为6.9个月,中位OS为15.1个月。
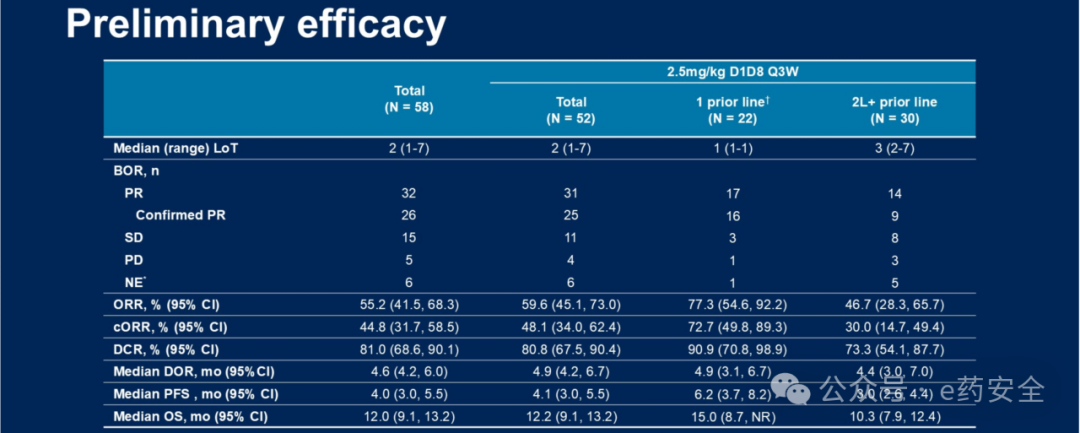
初步疗效
最常见的血液学治疗相关不良事件(TRAE,所有级别)包括贫血(84.5%)、白细胞减少(74.1%)、血小板减少(72.4%)和中性粒细胞减少(70.7%);最常见的非血液学TRAE包括乏力(41.4%)、低白蛋白血症(39.7%)、口腔炎(34.5%)、恶心(31.0%)和呕吐(31.0%)。在 iza- bren 2.5 mg/kg D1D8 Q3W 剂量治疗中,≥3级TRAEs 发生率为 75.0%,以血液学毒性为主。导致停药、减量和治疗延迟的 TRAEs 发生率分别为 13.5%、46.2% 和 63.5%。未观察到新的安全性信号。
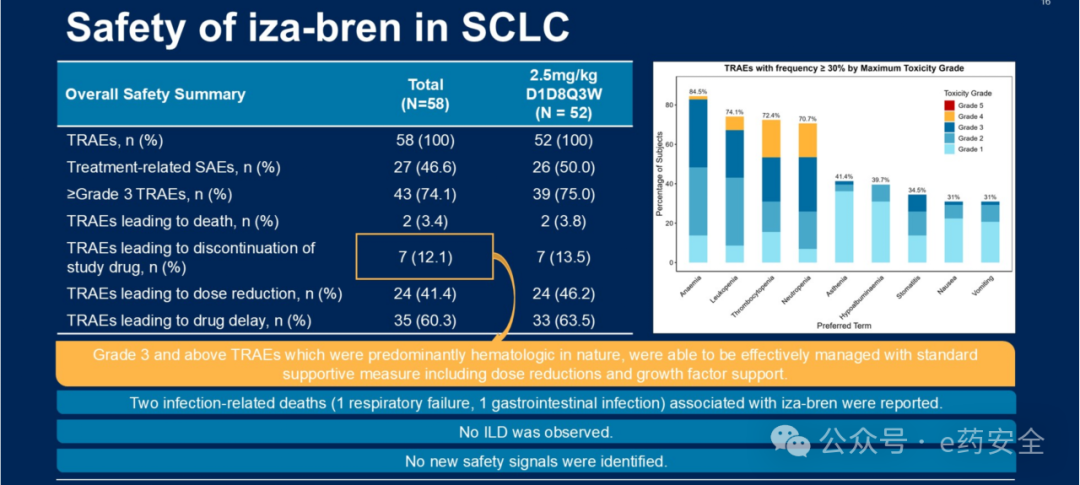
安全性















 苏公网安备32059002004080号
苏公网安备32059002004080号


