MET基因14号外显子跳跃突变(METex14跳突)作为NSCLC中的重要驱动基因,在非小细胞肺癌(NSCLC)患者中发生率约为3%-4%[1]。这类患者往往具有高侵袭性、预后不良等特点,对化疗和免疫治疗敏感性较低,且20%-40%患者可能发生脑转移,临床管理面临重大挑战[2]。近年来,靶向治疗的快速发展为METex14跳突NSCLC患者带来了新的治疗希望。以卡马替尼为代表的高选择性MET抑制剂在这类患者中展现出显著的抗肿瘤活性和良好的安全性,2025年新版CSCO非小细胞肺癌诊疗指南已将卡马替尼治疗METex14跳突NSCLC的推荐等级提升至I级,体现了专家对其临床价值的高度认可[3]。“愈见达案”专栏致力于通过真实病例分享和专家解读,为临床医生提供METex14跳突NSCLC患者的精准治疗参考。
本期“愈见达案”将探讨两例由东部战区总医院叶明翔教授提供的伴脑转移METex14跳突NSCLC患者接受靶向治疗的临床经验,并邀请南京大学医学院附属金陵医院吕镗烽教授结合最新临床证据进行深入解读并发表学术观点,以期为METex14突变NSCLC患者的个体化治疗提供有益启示,推动精准治疗在临床实践中的有效应用。
南京大学医学院附属金陵医院
呼吸与危重症医学科主任、内科教研室主任
博士生导师/博士后联系导师
中国医师协会呼吸医师分会常委
中华医学会肺癌学组委员
江苏省医学会呼吸病学分会副主任委员
江苏省抗癌协会老年肿瘤专业委员会副主任委员
美国德州理工大学访问学者
CSCO临床数据专业委员会委员
《Translational Lung Cancer Research》杂志(SCI收录)副主编
东部战区总医院呼吸内科
南京医科大学硕士生导师
中国中医药信息学会青年医师分会常务理事
江苏省医学会内科学分会青委会委员
江苏省医学会呼吸病学分会烟草学组委员
主持国家自然科学基金、江苏省基金、博士后基金3项
第一/通讯作者发表Cancer Res,Clin Cancer Res,J Immunother Cancer,J Exp Clin Cancer Res,Signal Transduct Target Ther,Cance Lett,J Med Virol,Brain Behav Immun等SCI论文10篇
病例一
基本情况
基本信息:患者男,70岁。
现病史:因“头胀痛伴左侧乏力、行走不稳5天”于2025年2月14日就诊。2025年2月9日,患者无明显诱因下出现右侧额颞部头胀痛,伴随左侧肢体乏力,行走不稳,无恶心、呕吐,无明显头晕,无晕厥,无肢体抽搐,无腹痛腹泻等。当地医院头颅MRI检查提示颅内占位性病变。
既往史: 高血压、糖尿病、脑梗塞病史。
实验室检查:
血常规:WBC 5.2×109/L,Hb 127 g/L,PLT 141×109/L;
血生化:Glu 5.0 mmol/L,BUN 6.1 mmol/L,SCR 80.5 μmol/L,AST 15 U/L,ALT 24 U/L,Na 145 mmol/L,K 3.6 mmol/L,Alb 34.7 g/L;
凝血功能:PT 11.9s,APTT 36.4s,D-dimer 0.85 mg/L,FDP 2.4 μg/ml;
肿瘤指标:CEA 4.8 ng/ml,NSE 24.6 ng/ml,CA125 58.8 U/ml,CA199 19.1 U/ml,SCC 7.3 ng/ml,Cyfra21-1 12 ng/ml。
影像学检查:
头颅MRI示:右侧额顶部占位性病变,考虑颅内转移灶,周围明显水肿。
胸部CT检查显示:左肺上叶小结节灶。进一步胸部CT增强显示左肺上叶磨玻璃结节,性质待定。
病理及分子检测:
病理诊断:“颅叶占位”,恶性肺癌,结合临床病史及免疫组化标记结果考虑肺腺癌转移。
免疫组化结果:肿瘤细胞呈CKpan(+)、CK7(+)、TTF-1(+)、NapsinA(2+)、CK5/6(散+)、P40(-)、P63(散+)、Syn(-)、Ki-67(约60%+)。
分子病理检测发现:MET基因14号外显子跳跃突变,突变丰度70.90%。
临床诊断:
左肺腺癌(cT1N0M1c,IV期)伴脑转移
METex 14跳突阳性
高血压、糖尿病、脑梗塞史
治疗经过与疗效评估
本例患者为高龄肺腺癌患者,以脑转移相关神经系统症状为首发表现。分子检测提示存在高丰度(70.90%)的METex14 跳突。因患者神经系统症状显著,颅内病灶伴严重水肿,为迅速缓解症状、降低颅内压,首先施行了颅内肿瘤切除术 。术后,基于明确的METex14跳突状态,多学科诊疗(MDT)团队讨论认为,卡马替尼靶向治疗是该患者的最佳系统治疗选择。
初始治疗策略: 给予卡马替尼400mg 口服,每日两次 。
近期疗效评估: 卡马替尼治疗1个月后,复查胸部CT显示:左肺上叶原发病灶较基线明显缩小;头颅MRI:颅内手术区域未见明确复发征象,原有水肿基本消退,其他部位未见新发病灶。患者神经系统症状完全缓解,生活质量改善显著。
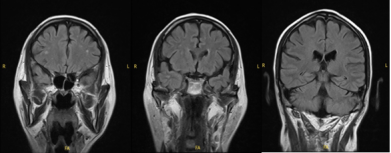
胸部CT检查结果:
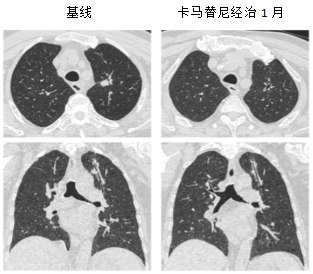
头颅MRI检查结果:
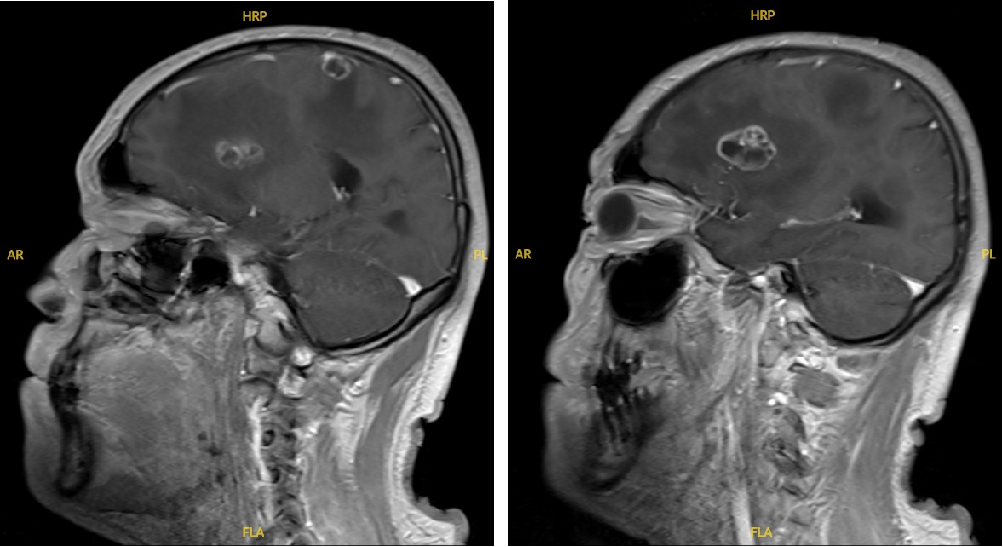
基线
病例二
基本情况
基本信息: 患者男,69岁。
现病史: 因“腰痛1月余”于2021年9月入院。患者2021年8月无明显诱因出现腰痛,腰椎CT示多发椎体破坏。门诊PET-CT发现右上肺肿块、双肺多发结节、右后胸壁肿块、双侧肾上腺结节、肠系膜及盆腔肿大淋巴结、全身多发骨骼骨质破坏、颅内多发结节,FDG代谢均增高,考虑右上肺癌伴多发转移。
既往史及个人史: 高血压,余无殊。
辅助检查:
影像学检查:右上肺占位性病变伴多发转移。
病理学检查:“右肺”穿刺活检标本确诊为浸润性腺癌。免疫组化示:癌细胞CK7(3+),TTF-1(3+),NapsinA(2+),CK5/6(散+),P40(-),P63(散+),Syn(-),Ki-67 60%(+)。
分子病理基因检测:METex14跳突,变异丰度为71.71%,同时伴有TP53突变(H179Y),变异丰度为24.47%,以及MET基因拷贝数增加(拷贝数4.68)。
临床诊断:
右肺腺癌伴双肺、胸壁、双侧肾上腺、淋巴结、骨及脑转移
METex 14跳突阳性、MET基因拷贝数增加、TP53突变
高血压
治疗经过与疗效评价
该患者为晚期NSCLC,肿瘤负荷较重,且存在显著的脑转移病灶及多发骨转移。此外,该患者呈现复杂分子病理特征,分子检测同时存在METex14跳突和MET基因扩增(拷贝数接近临界值)。MDT通过综合评估认为,尽管卡马替尼对METex14跳变具有高特异性,但考虑到当时(2021年)药物可及性因素——卡马替尼尚未在国内获批而赛沃替尼已上市及患者意愿,故启动赛沃替尼作为一线靶向治疗方案,同时定期监测肝肾功能及水肿等不良反应。
一线治疗:赛沃替尼
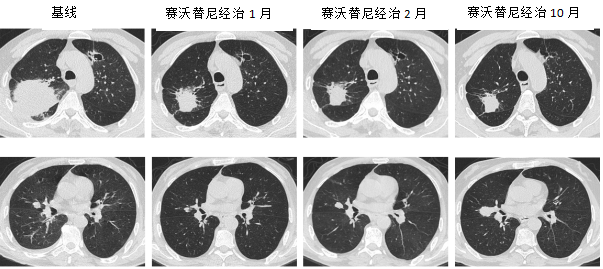
疗效:患者初始接受赛沃替尼靶向治疗1月后,胸部CT显示肺部病灶明显缩小。持续治疗期间,病情稳定,肺部及中枢神经系统病灶均较基线缩小。患者一线PFS达10个月,期间CNS病灶持续获益,但肺部病灶出现进展。
胸部CT检查结果:
头颅MRI检查结果:
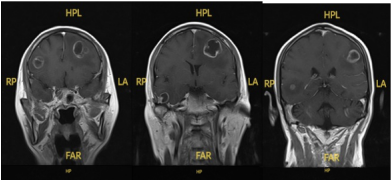
基线
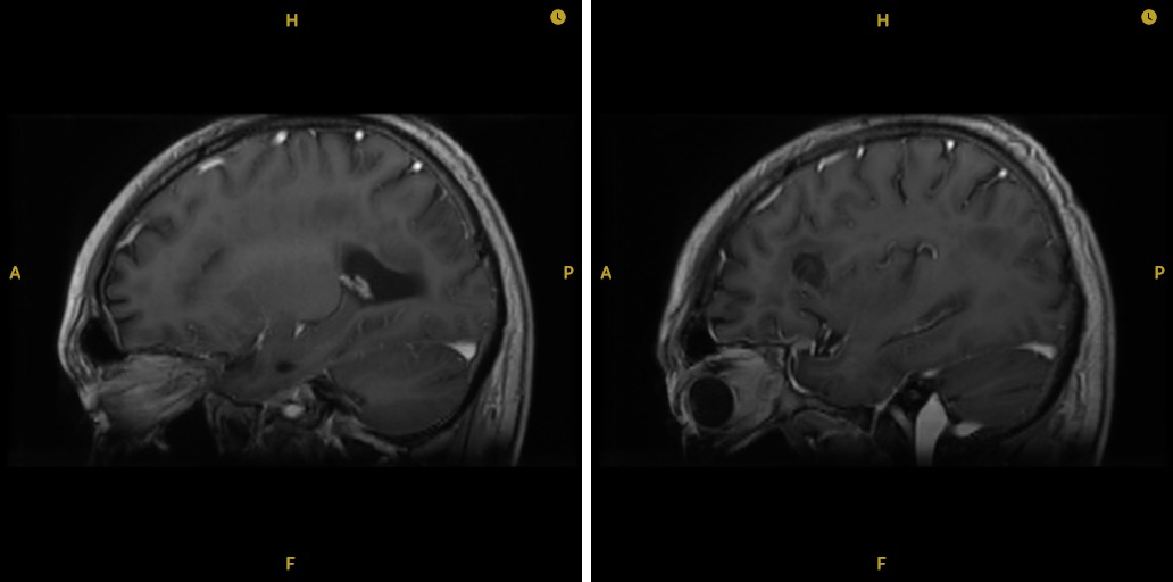
耐受性与进展:治疗期间,患者出现肌酐水平显著升高(SCRmax=226.8μmol/L),提示肾功能损害。治疗10月是,复查胸部CT发现原右肺中叶病灶增大,为疾病进展(PD)。此时头颅MRI显示病灶仍持续获益,较前退缩。
后续局部治疗与治疗策略转换:
针对进展的右肺中叶病灶,给予立体定向体部放疗(SBRT),剂量为45Gy/3次。
鉴于赛沃替尼导致的该患者显著肾功能损害以及肺部病灶进展,临床团队决定停用赛沃替尼,改为卡马替尼治疗。卡马替尼作为一种高选择性Ib型MET抑制剂,其药代动力学特点和安全性谱与赛沃替尼有所不同,特别是在肾功能不全患者中具有安全优势。
二线治疗:卡马替尼
疗效:改用卡马替尼后,患者肾功能指标逐渐改善,疾病再次获得控制。随访6个月的CT评估显示右肺中叶病灶增大,其他肺部病灶亦无明显进展,未见新发病灶。头颅MRI复查显示颅内病灶持续稳定。二线PFS达6个月。
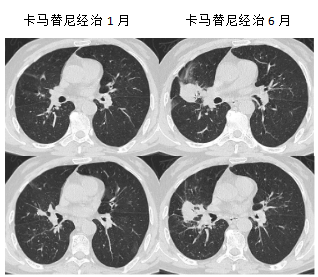
胸部CT检查结果:
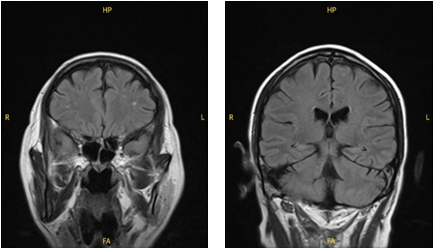
二线卡马替尼经治后头颅MRI检查结果:
后续治疗:
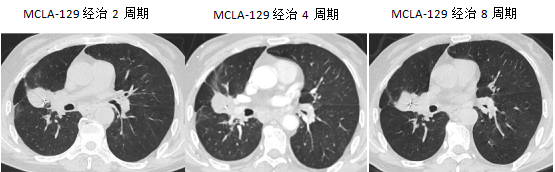
卡马替尼治疗6个月后患者再次出现疾病进展。患者后续入组临床试验,接受MCLA-129(EGFR/c-MET双特异性抗体)治疗。疗效评估显示,治疗2周期、4周期后病灶稳定(SD),但8个周期后新发骨转移,评估为PD。PFS为2个月。
胸部CT检查结果:
1. Reale, M.L., et al., MET exon 14 skipping mutations in non-small-cell lung cancer: real-world data from the Italian biomarker ATLAS database. ESMO Open, 2024. 9(9): p. 103680.
2. Patel, J.D., et al., Intracranial activity of tepotinib in patients (pts) with MET exon 14 (METex14) skipping NSCLC enrolled in VISION. Journal of Clinical Oncology. 39(15_suppl): p. 9084-9084.
3. 中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南 2025.
4. Pan, K., et al., Emerging therapeutics and evolving assessment criteria for intracranial metastases in patients with oncogene-driven non-small-cell lung cancer. Nat Rev Clin Oncol, 2023. 20(10): p. 716-732.
5. Wolf, J., et al., Capmatinib in <em>MET</em> exon 14-mutated non-small-cell lung cancer: final results from the open-label, phase 2 GEOMETRY mono-1 trial. The Lancet Oncology, 2024. 25(10): p. 1357-1370.
6. Wu, Y.L., et al., 388P Capmatinib in Chinese adults with EGFR wt, ALK rearrangement negative (ALK-R−), MET exon 14 skipping mutation (METex14), advanced NSCLC: Results from the phase II GEOMETRY-C study. Annals of Oncology, 2022. 33: p. S1593.
7. Illini, O., et al., Real-world experience with capmatinib in MET exon 14-mutated non-small cell lung cancer (RECAP): a retrospective analysis from an early access program. Ther Adv Med Oncol, 2022. 14: p. 17588359221103206.
8. Nishio, M., et al., Management of Peripheral Edema in Patients with MET Exon 14-Mutated Non-small Cell Lung Cancer Treated with Small Molecule MET Inhibitors. Target Oncol, 2022. 17(5): p. 597-604.
9. Yao, Y., et al., Mutations in the MET tyrosine kinase domain and resistance to tyrosine kinase inhibitors in non-small-cell lung cancer. Respiratory Research, 2023. 24(1): p. 28.
10. Fujino, T. and T. Mitsudomi, Acquired Resistance Mechanism for MET Tyrosine Kinase Inhibitor. JTO Clinical and Research Reports, 2021. 2(3).
11. Bahcall, M., et al., Combination of Type I and Type II MET Tyrosine Kinase Inhibitors as Therapeutic Approach to Prevent Resistance. Mol Cancer Ther, 2022. 21(2): p. 322-335.
排版编辑:CYX











 苏公网安备32059002004080号
苏公网安备32059002004080号


