随着精准医学的发展,FGFR2b作为胃癌治疗的新兴靶点备受关注。然而,真实世界中的FGFR2b过表达率及其与HER2、PD-L1的共表达模式仍缺乏系统数据。2025年国际胃癌大会(IGCC)上公布了一项丹麦单中心回顾性研究(摘要号P607),为这一领域提供了更多证据。本期特别邀请中国医学科学院肿瘤医院病理科薛丽燕教授深度解读研究结果及其临床启示。
国家癌症中心/中国医学科学院肿瘤医院病理科
胸部肿瘤病理亚专业组长,亚专业方向:胸部和上消化道肿瘤病理
中国抗癌协会肿瘤病理专业委员会食管癌协作组组长
中国抗癌协会肿瘤病理专业委员会大数据学组副组长
中国研究型医院学会病理学专业委员会常委
中国抗癌协会肿瘤病理专业委员会委员
中华医学会病理学分会消化学组委员
中国研究型医院学会超微与分子病理学分会肺与纵隔专业组委员
中华病理学杂志通讯编委、诊断病理学杂志、临床与实验病理学杂志编委
在Nature Medicine、 Nature Communications、 Journal of Pathology、Modern Pathology、STTT、Theranostics、British Journal of Cancer、Gastric Cancer、JNCC等国内外专业学术期刊发表第一/通讯(含共同)论文70余篇
中国医师协会病理科医师分会2020年度“杰出青年病理医师
一、研究题目:
胃/胃食管结合部癌患者中FGF2b蛋白过表达和HER2&PD-L1共表达情况
二、研究设计:
1、 目的:确认FGFR2b蛋白过表达在真实世界队列中的阳性率,并确定其与HER2&PD-L1的共表达情况。
2、 方法:本研究为丹麦单中心回顾性队列研究,纳入2017~2021年确诊的胃/胃食管结合部癌患者(n=215),通过FFPE样本检测FGFR2b、PD-L1表达,并收集HER2表达数据。肿瘤分期采用TNM分期标准,局限期定义为N=0和M=0,晚期定义为N=1~3和M=0~1。
三、主要研究结果:
1、FGFR2b过表达阳性率
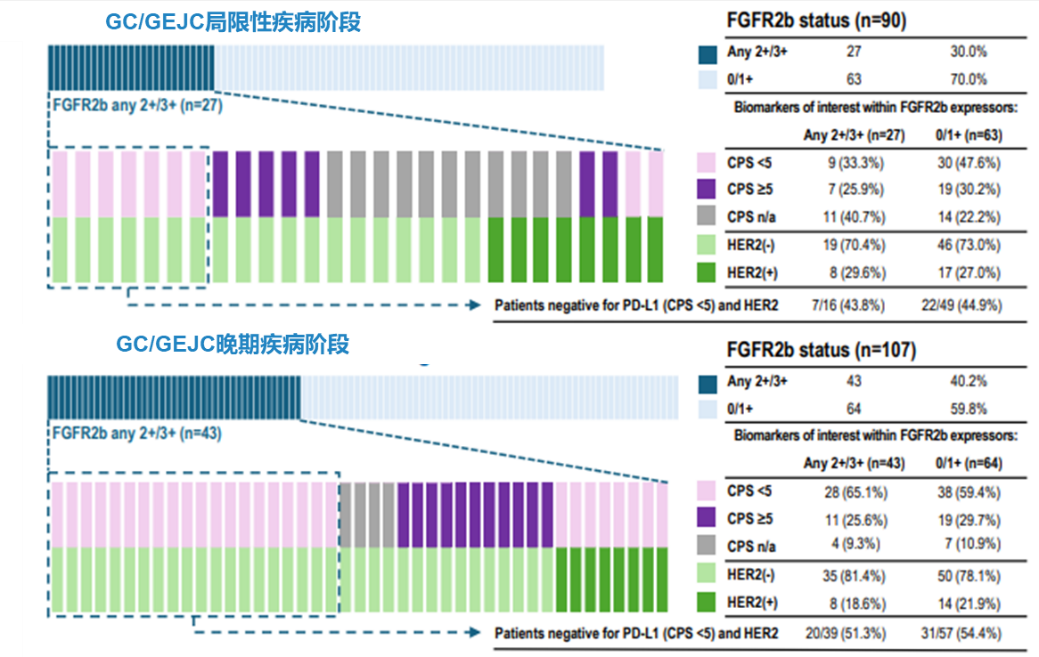
·在局限期疾病患者中,FGFR2b任意2+/3+的阳性率为30.0%(n=27/90,95%CI:21%~41%),而在FGFR2b ≥ 10% 2+/3+中,阳性率为7.8%(n=7/90,95%CI:3%~15%)
·在晚期疾病患者中,FGFR2b任意2+/3+的阳性率为40.2%(n=43/107,95%Cl:30.8%~50.1%),而FGFR2b ≥ 10% 2+/3+的阳性率为10.3%(n=11/107,95%CI:5.2%~17.7%)。
2、FGFR2b和HER2、PD-L1的共表达情况
·在可评估FGFR2b数据的队列中,HER2阳性率为23.9%(47/197),PD-L1 CPS≥5阳性率为34.8%(56/161;仅限于有PD-L1 CPS数据的患者)。
·在FGFR2b任意2+/3+的患者中,超过一半(51.3%;20/39)的晚期患者和近一半(43.8%;7/16)的局限期患者既不是HER2阳性,也没有PD-L1 CPS≥5。
·在共表达FGFR2b任意2+/3+和HER2和/或PD-L1 的晚期患者中,18.6%(8/43)为HER2阳性,28.2%(11/39)为PD-L1 CPS≥5。
薛丽燕教授采访:
问题1:本研究的主要结果及临床意义是什么?
本研究是来自丹麦单中心的一项回顾性分析,首次揭示了FGFR2b蛋白在不同分期胃癌患者中的过表达情况。在纳入的215例患者中,晚期患者FGFR2b任意2+/3+的阳性率达到40.2%,显著高于局限期的30.0%。若以≥10% 2+/3+为阈值,晚期的阳性率也高于局限期,分别为10.3%和7.8%。值得一提的是,既往也有研究显示相对于早期患者,FGFR2b过表达比例在晚期患者中可能更高,而本研究中比较了局限期胃癌和晚期胃癌的FGFR2b的表达比例,也进一步印证了这一结论。这表明FGFR2b过表达在胃癌中可能存在时间异质性,患者初诊时的检测结果可能无法反映复发后的状态,比如部分初诊手术切除后阴性的患者可能在疾病进展后转为阳性。因此,我们建议:对于复发的晚期胃癌患者,无论既往手术标本检测结果如何,都应尽可能通过复发或转移病灶的活检标本再次检测FGFR2b,以免错失潜在的治疗机会。
问题2:对于晚期胃癌患者推荐什么样的检测策略?
对于晚期胃癌患者,我们推荐多靶点同步检测。
从病理科医生的角度来说,靶点的预后价值非常重要,它不仅可以反映肿瘤的生物学特征,也可以帮助临床医生在为患者选择治疗方案时提供更多信息。既往研究表明,FGFR2b过表达与胃癌预后差、免疫治疗疗效不佳相关,是在胃癌具有潜在预后价值的靶点,因此我认为FGFR2b具有检测的必要性。
此外,本研究还发现在FGFR2b任意2+/3+阳性的晚期患者中,18.6%为HER2阳性,25.6%为CPS≥5,而超过半数(51.3%)的患者既非HER2阳性也无PD-L1高表达,这意味着FGFR2b是个相对独立的靶点,但也存在与其他生物标志物共表达的情况。这类仅有FGFR2b过表达而其他标志物阴性的患者很可能对现有的靶向治疗和免疫治疗响应不佳,而针对FGFR2b的药物,如贝玛妥珠单抗,未来可能为这类患者的治疗提供新方向。
因此,我们建议晚期胃癌患者初诊时就检测FGFR2b,将其与HER2、PD-L1等靶点同步检测,评估预后风险分层与靶向治疗可行性。
作为病理科医生,我们需要尽快推动FGFR2b检测的临床普及,助力胃癌精准分型,让更多患者能从个体化治疗中获益。相信未来结合多靶点的检测也将进一步提升晚期胃癌治疗策略的精准化。
问题3:本研究存在哪些局限性?给FGFR2b检测的临床实践和科研工作带来哪些启示?
这个我们可以从研究设计以及方法学的角度来分析。
第一,本研究只是丹麦单中心的回顾性分析,并且样本量较小,因此研究结论未来还需要在更大样本、多中心队列,尤其是中国人群中进一步验证;
第二,本研究使用的FFPE样本保存时间较长,可能会影响检测的阳性率。因为蛋白质的稳定性会随时间推移逐渐下降,尽管福尔马林固定可部分保存抗原,但长期储存仍可能导致FGFR2b蛋白降解或抗原表位破坏,从而降低免疫组化检测的敏感性,造成假阴性率升高。这一点在既往标志物(如PD-L1)的研究中已被证实。由此也提示我们检测FGFR2b应尽量选择新鲜或近期内存档的标本。
所以总的来说,本研究存在单中心、回顾性设计、样本量少,以及样本时效性等问题,因此对于FGFR2b的过表达阳性率,我认为本研究的数据可以作为参考,但更多的还是应该以前瞻性大样本临床研究中的数据为准。比如在III期FORTITUDE 101研究中,任意2+/3+的阳性率为37.8%,≥10% 2+/3+的阳性率也达到了16.2%。
问题4:当前CSCO胃癌指南中关于FGFR2b检测的推荐是什么?
2025版CSCO胃癌指南在分子诊断领域迎来了重要更新,首次将FGFR2b检测纳入推荐,尽管目前其推荐级别为III级,但这一突破标志着FGFR2b正式进入临床实践视野,为精准治疗开辟新路径。具体而言,指南在“分子诊断”章节中新增了FGFR2b检测为III级推荐,并在注释中说明了以下几点:一是推荐使用免疫组化来进行检测;二是建议判读标准参考临床研究数据制定,如 FORTITUDE-101 研究,FGFR2b 过表达定义为≥10%肿瘤细胞中等或强膜染色(≥10% 2+/3+)。
问题5:病理科目前对于FGFR2b的检测存在哪些难点?如何解决?
当前FGFR2b检测在临床病理实践中面临的核心挑战是缺乏规范化标准。
首先,检测流程尚未统一,对于抗体选择、样本处理方式和结果的判读标准都亟需建立标准化的操作流程;其次,缺乏完整的质控体系来确保检测结果的可靠性;再有就是样本时效性的影响还未被充分重视,FFPE样本长期储存可能导致抗原降解,而保存时长对于FGFR2b阳性率的具体影响究竟如何,目前还未被系统研究。
因此,我认为作为病理科医生,我们应加快推动FGFR2b 免疫组化检测共识指南的制定,明确标本处理、抗体克隆号、判读标准和质控流程,真正建立标准化的临床检测体系。同时也要开展更多靶点相关的探索性研究,如建立不同保存时间(1年、3年、5年)的样本队列,量化FGFR2b表达衰减规律,明确检测有效期;开展多中心研究,验证抗体性能阈值及判读标准的普适性;还可以通过配对活检-手术样本、原发灶-转移灶样本,来解析FGFR2b表达的时空异质性。
最后我想强调,规范化是精准检测的基石。只有建立从样本处理到结果报告的全流程SOP,才能让FGFR2b检测真正服务于临床决策。
相关文章回顾(点击可查看详情):
1. GC云讲堂 | 张小田教授:2025 CSCO 胃癌诊疗指南——晚期转移性胃癌的药物治疗和分子诊断更新要点
2. 盛伟琪教授:2025 CSCO胃癌指南新增“FGFR2b过表达检测”推荐,驱动胃癌精准诊疗新引擎
3. 沈琳教授:2025 CSCO胃癌指南框架性更新,指引胃癌精准诊疗新方向
4. GC云讲堂丨邱红教授:贝玛妥珠单抗解锁胃癌精准治疗新篇章
5. 【临床-病理大咖共话】新兴靶点FGFR2b开启胃癌精准“诊”“疗”新征程
1. Stephen Puntis, Jeanette B. Georgsen, Lars Pedersen, et al. FGFR2b protein overexpression and HER2 and PD-L1 overlap in gastric and gastroesophageal junction cancer patients. IGCC P607
2. Soomin Ahn, Jeeyun Lee, Mineui Hong, et al. FGFR2 in gastric cancer: protein overexpression predicts gene amplification and high H-index predicts poor survival. Mod Pathol. 2016 Sep;29(9):1095-103.
3. Ilya Tsimafeyeu, Gunel Musayeva, Mahmudova Samira, et al. Efficacy and safety of nivolumab and CapeOX in patients with previously untreated FGFR2-positive, PD-L1-positive advanced gastric cancer: A single-arm, multicenter, phase 2 study NIVOFGFR2. 2024 ASCO. Abstract # 4042.
4. Heonwoo Lee, Min-Hee Ryu, In-Seob Lee, et al. Low positivity rate of fibroblast growth factor receptor 2b is associated with heterogeneous expression in gastric cancer. Gastric Cancer. 2025 Apr 11.
5. S. Sato, S.L. Rhodes, Y. Aoki, et al. Fibroblast growth factor receptor 2 isoform IIIb (FGFR2b) protein overexpression and biomarker overlap in patients with advanced gastric or gastroesophageal junction cancer (GC/GEJC). 2024 ESMO. Presentation Number #1420P.
6. Wainberg, Z.A., Kang, YK., Lee, KW. et al. Bemarituzumab as first-line treatment for locally advanced or metastatic gastric/gastroesophageal junction adenocarcinoma: final analysis of the randomized phase 2 FIGHT trial. Gastric Cancer 27, 558–570 (2024).
7. Sun Young Rha, Yanqiao Zhang, Anneli Elme, et al. Prevalence of FGFR2b Protein Overexpression in Advanced Gastric Cancers During Prescreening for the Phase III FORTITUDE-101 Trial. JCO Precis Oncol. 2025 Jan;9:e2400710.
排版编辑:王俊澔












 苏公网安备32059002004080号
苏公网安备32059002004080号


