激素受体阳性(HR+)/人表皮生长因子受体2阴性(HER2-)是乳腺癌最常见的分子亚型。尽管(新)辅助治疗可显著降低HR+/HER2-早期乳腺癌的复发和死亡风险,但仍有部分患者面临短期和长期复发风险,进展为不可治愈疾病。因此,充分认识具有高复发风险的患者,并予以分层治疗,对改善患者预后和提高生存质量至关重要。2025年欧洲肿瘤内科学会乳腺癌年会(2025 ESMO BC)公布多项HR+/HER2- 早期乳腺癌复发风险的真实世界研究分析引人注目。【肿瘤资讯】特别邀请湖北省肿瘤医院吴新红教授解读相关研究,探讨HR+/HER2-早期乳腺癌复发风险的精准识别。
湖北省肿瘤医院副院长
湖北省肿瘤医院乳腺中心主任
湖北省乳腺癌临床医学研究中心主任
湖北省乳腺病防治研究中心
中国抗癌协会乳腺癌专委会常委
国家肿瘤质控中心乳腺癌专家委员会委员
中国抗癌协会肿瘤整形外科专委会常委
中国整形美容协会肿瘤整复分会常委
湖北省抗癌协会乳腺癌专委会主委
武汉市医学会肿瘤学分会副主委
2025 ESMO BC HR+/HER2-早期乳腺癌复发风险相关真实世界研究解读
1. Real-world risk of recurrence (ROR) and health care resource utilization (HCRU) in patients (pts) with HR+/HER2- early breast cancer (EBC) from a UK cancer registry
英国癌症登记数据中HR+/HER2-早期乳腺癌(EBC)患者的真实世界复发风险(ROR)及医疗资源使用(HCRU)
摘要号:144P
本研究纳入了2016-2021年英国癌症分析系统中≥18岁、I-III期HR+/HER2- EBC患者(主要队列)。根据淋巴结状态分析了主要队列和NATALEE类似亚组(II/III期淋巴结阳性;或N0且T2[G2/3]、T3、T4)的术后ROR,并评估了NATALEE类似患者的HCRU。
结果显示,主要队列(84,506例)中37,446例为NATALEE类似患者。中位随访时间(60.8 vs 58.8月)、年龄(62 vs 61岁)及辅助ET启动时间(1.9 vs 2.4月)在两组间相似。NATALEE类似患者中5772例复发(转移性占56%)。NATALEE类似亚组的N0患者的ROR高于主要队列N0患者(7年无浸润性疾病生存率:75% vs 83% )。NATALEE类似N0患者的7年无远处复发生存率为84%,与主要队列N1患者(82%)相近。敏感性分析支持上述结果。
表1. 主要队列和NATALEE类似亚组中,不同淋巴结受累状态患者的ROR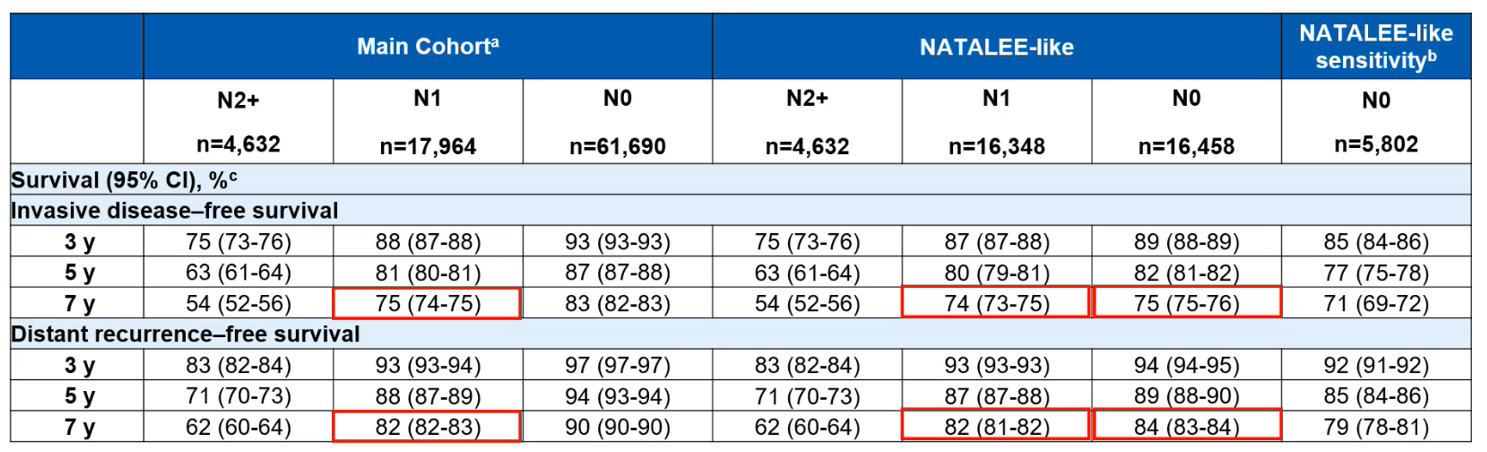
此外,NATALEE类似患者复发后年均医疗资源使用显著增加,且转移性复发患者资源消耗更高。复发后次级医疗成本显著上升。
表2. 主要队列和NATALEE类似亚组中,复发前后年均HCRU的花费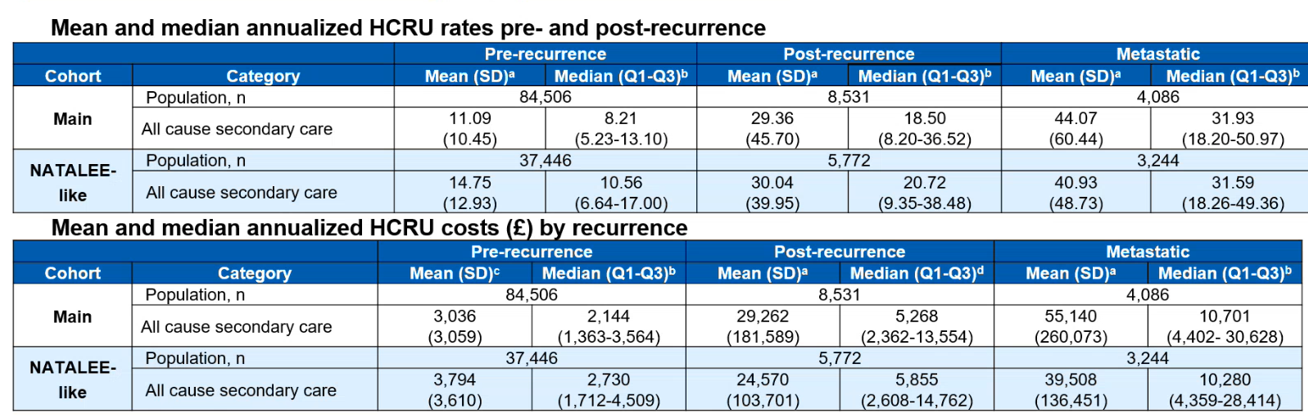
研究表明,NATALEE类似亚组的N0患者ROR与主要队列N1患者相近。鉴于转移性复发显著增加HCRU,降低ROR的治疗对减轻HR+/HER2- EBC的疾病负担至关重要。
2. Risk of recurrence (ROR) among patients (pts) with HR+/HER2- early breast cancer (EBC) involving 1-3 axillary lymph nodes (N1): A real-world evaluation
HR+/HER2-早期乳腺癌(EBC)伴1-3枚腋窝淋巴结转移(N1)患者的真实世界复发风险(ROR)评估
摘要号:211P
本研究回顾性分析了美国2012-2018年II/III期HR+/HER2- EBC中N1患者数据,通过Kaplan-Meier法评估N1-R/A(同时符合瑞波西利和阿贝西利治疗条件,N1伴高危因素)和N1-R(仅符合瑞波西利治疗条件,N1不伴高危因素)患者的ROR。
结果显示,在入组II/III期HR+/HER2- EBC患者中,678例为N1疾病,其中241例(35.5%)为N1-R/A,437例(64.5%)为N1-R。N1-R/A和N1-R队列的中位诊断年龄分别为53岁和57岁,常见组织学分级分别为G3(73.4%)和G2(72.3%),基因检测高危分别为45.0%和12.4%,中位随访时间分别为6.3年和6.4年。两组患者5年ET持续率相近(N1-R/A 68.3% vs N1-R 72.5%)。N1-R/A患者接受(新)辅助化疗比例更高(85.1% vs 62.9%)。Kaplan-Meier曲线图显示,N1-R/A和N1-R组患者随时间推移的累积ROR显著升高,5年和7年iDFS分别为88.1% vs 89.4% 和82.9% vs 84.6%,5年和7年DDFS分别为 89.8% vs 90.1%和84.6% vs 85.3%,并且多变量cox回归分析显示,在调整患者的人口统计学和临床特征(包括绝经状态和是否接受化疗)后,N1-R/A和N1-R队列的iDFS(HR=1.27;95% CI 0.83-1.95;P=0.2644)和DDFS(HR=1.22;95% Cl 0.78-1.90; P=0.3903)没有显著差异。
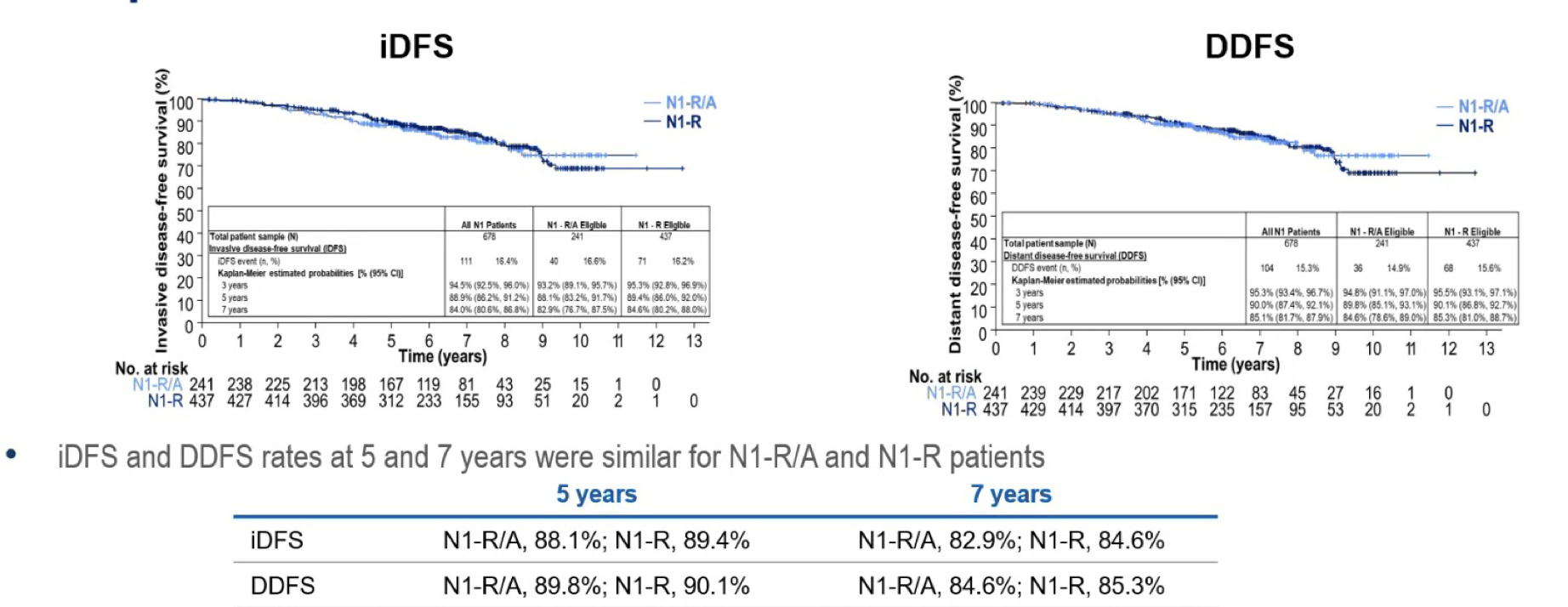
研究表明,II/III期HR+/HER2-EBC中N1-R/A和N1-R患者即使接受了标准辅助内分泌治疗,但5年和7年iDFS和DDFS相似且较高,因此所有N1患者均存在早期和远期复发风险。
3. Real-world (RW) risk of recurrence in pre- and postmenopausal patients (pts) with HR+/HER2- early breast cancer (EBC) eligible for NATALEE
真实世界(RW)中符合NATALEE试验条件的绝经前与绝经后HR+/HER2-早期乳腺癌(EBC)患者的复发风险
摘要号:219P
研究使用美国Flatiron Health电子健康记录数据库(2011-2023年)数据,纳入了≥18岁、AJCC I-III期HR+/HER2- EBC、接受过手术并开始辅助内分泌治疗(ET)的患者,并按绝经状态分析患者特征及临床结局(无复发生存期[RFS]、无远处复发生存期[DRFS]、总生存期[OS])。
研究共入组7,481例患者,中位年龄分别为46岁(绝经前)和66岁(绝经后)。在符合NATALEE条件的队列中,绝经前患者Ki-67≥20%的比例更高(72.5% vs 63.2%),Oncotype DX复发评分>26的比例相近(25.1% vs 25.5%)。绝经前与绝经后患者中,解剖分期II/III期占比分别为71.4%/28.6% vs 73.2%/26.8%,淋巴结阳性比例分别为79.1% vs 75.4%。绝经前与绝经后患者接受(新)辅助化疗的比例分别为67.0% vs 47.4%。
临床结局数据显示,绝经前与绝经后患者的5年RFS(83.2% vs 81.1%)、5年DRFS(84.9% vs 82.8%)和5年OS(93.4% vs 88.4%)在两组间相近。
表3. 符合NATALEE条件中绝经前和绝经后患者的5年RFS、DRFS、DRFI和OS
真实世界分析表明,尽管临床特征存在差异,但符合NATALEE条件的HR+/HER2- EBC患者在标准ET治疗下仍存在显著的未满足复发风险需求。
从N+到N0,多因素共筑HR+/HER2-早期乳腺癌复发风险分层,精准识别方能实现治愈
在中国,乳腺癌是女性常见的恶性肿瘤,超过90%的患者在诊断时处于疾病早期阶段,即I-III期1。HR+/HER2-是乳腺癌中占比最高的亚型,高达70%1。辅助内分泌治疗是HR+/HER2-早期乳腺癌患者术后的标准治疗方案,但遗憾的是,即使是经过标准辅助内分泌治疗后,仍有部分患者会发生复发转移,进展为不可治愈的疾病。因此,如何精准识别HR+/HER2-早期乳腺癌的复发风险,并予以分层治疗,实现更多患者的临床治愈成为临床医生特别关注的问题。
超95%HR+早期乳腺癌的复发高峰为术后3年,且复发风险持续累积终身存在
据报道,HR+早期乳腺癌患者中短期复发(<5 年)率为 20%~30%,且超95%的HR+早期患者复发风险在术后3年达到高峰,而远期复发(诊断后 5 年以上)在临床上也很常见2。其中,一项美国真实世界研究显示,II 期 HR+/HER2- 早期乳腺癌患者 5 年复发率、10 年复发率分别为 22%、44%,III 期患者 5 年复发率和 10 年复发率分别为 40%、63%3。同时,HR+/HER2- 早期乳腺癌的复发风险在治疗后 20 年乃至终身仍存在,并不会随着时间延长而消失4。此外,需要注意的是,相较于美国乳腺癌患者,中国乳腺癌的发病年龄更为年轻(45-55岁 vs 64岁)5和确诊时分期更晚(II-III期: 68% vs 45%)6,这也就意味着中国患者的复发风险更高,预后更差,更为需要精准识别不同患者的复发风险。
多因素共筑HR+乳腺癌复发风险,N+和N0伴高危因素的患者均具有较高复发风险
在 HR+/HER2-乳腺癌患者中,复发风险的评估依赖于多种临床病理学特征,包括淋巴结状态、肿瘤大小、组织学分级、Ki-67 表达水平和基因组风险等。其中,淋巴结转移是影响早期乳腺癌复发风险非常重要的独立预后因素。2025 ESMO BC公布的英国真实世界研究结果7显示,在经标准辅助治疗后的HR+/HER2-早期乳腺癌中,N2+患者的7年远处复发风险可达38%,而N1患者的7年远处复发风险也达到了18%。研究结果证实,随着淋巴结转移数量增多,患者复发风险随之升高,且所有N+患者均存在较高的复发风险。而同期公布的另一项美国真实世界研究8还将N1患者划分为N1-R/A亚组(N1伴高危因素)和N1-R亚组(N1不伴高危因素)以评估复发风险,结果显示,随着时间推移两组患者的累积复发风险明显升高,7年iDFS为82.9% vs 84.6%,多变量cox回归分析提示两组的iDFS无显著差异。研究结果进一步证实,无论是否伴有高危因素,N1患者均存在较高的复发风险。
值得注意的是,在多种临床病理学特征中,淋巴结转移并非唯一需要考虑的风险因素。上述英国真实世界研究7中,同样证实NATALEE类似亚组的N0患者(伴高危因素)的复发风险高于所有N0患者,7年无远处复发生存率为84% ,与N1患者相近(82%)。这与既往中国真实世界研究结果不谋而合。中国国家癌症中心的研究9证实,N+和N0伴高危因素的患者(NATA组)均存在不可忽视的复发风险,与N0不伴高危因素的患者(non-NATA组)相比,NATA组患者的5年复发风险高达3倍。与此同时,进一步分层分析证实,N0伴高危因素患者复发风险是N0不伴高危因素患者的2倍,且N0伴高危因素患者复发风险与N1患者相似。
综上所述,本次ESMO BC公布的多项真实世界研究再次提示,HR+/HER2-早期乳腺癌患者存在未被满足的治疗需求。无论是N+还是N0伴高危因素的患者,即符合NATALEE研究入组标准的所有高复发风险的HR+/HER2-早期乳腺癌患者均需要临床关注复发风险,瑞波西利的辅助治疗方案可助力中国患者走上治愈之路。
1. Huppert LA, et.al. Systemic therapy for hormone receptor-positive/human epidermal growth factor receptor 2-negative early stage and metastatic breast cancer. CA Cancer J Clin. 2023;73(5):480-515.
2. Sheffield, Kristin M et al. A real-world US study of recurrence risks using combined clinicopathological features in HR-positive, HER2-negative early breast cancer. Future oncology (London, England) vol. 18,21 (2022): 2667-2682.
3. Zhou J, et al. Population-based recurrence rates among older women with HR-positive, HER2-negative early breast cancer: Clinical risk factors, frailty status, and differences by race. Breast. 2021;59:367-375
4. Pan H, et al. 20-Year Risks of Breast-Cancer Recurrence after Stopping Endocrine Therapy at 5 Years. N Engl J Med. 2017;377(19):1836-1846.
5. Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China. Lancet Oncol. 2014 Jun;15(7):e279-89.
6. Hess KR, et al. Breast Cancer Res Treat. 2003 Mar;78(1):105-18.
7. Real-world risk of recurrence (ROR) and health care resource utilization (HCRU) in patients (pts) with HR+/HER2- early breast cancer (EBC) from a UK cancer registry. 2025 ESMO BC abstract 144P.
8. Risk of recurrence (ROR) among patients (pts) with HR+/HER2- early breast cancer (EBC) involving 1-3 axillary lymph nodes (N1): A real-world evaluation. 2025 ESMO BC abstract 211P.
9. Li Q, Jiang MX, Liu JX, et al. Clinicopathologic Features, Adjuvant Treatment Patterns and Clinical Outcomes of HR+/HER2- Early Breast Cancer in China. 2025 SGBCC abstract, P265.
审批码KIS0046538-99891,有效期为2025-05-16至2026-05-15,资料过期,视同作废
排版编辑:肿瘤资讯-CYX











 苏公网安备32059002004080号
苏公网安备32059002004080号


