急性髓系白血病(AML)尽管在诱导治疗与缓解后治疗方面已取得一定进展,但复发风险依然居高不下,成为阻碍患者长期生存的关键难题之一[3]。维持治疗作为 AML 整体治疗策略的重要组成部分,旨在进一步清除残留白血病细胞、抑制克隆演化从而降低复发率、延长患者生存期[3]。近年来,随着医学研究的不断深入,AML 维持治疗领域涌现出诸多创新疗法与药物。靶向治疗药物以其精准打击癌细胞特定分子靶点的独特优势,逐渐崭露头角,为 AML 患者带来新的希望曙光。尤其是 IDH1 抑制剂,其在维持治疗中的应用价值与潜力正不断被挖掘与证实。本文特邀苏州大学附属第一医院的唐晓文教授梳理 AML维持治疗的核心要点,深度剖析靶向治疗药物尤其是 IDH1 抑制剂在其中的卓越表现与发展前景。
AML 复发阻碍疗效,维持治疗刻不容缓
AML是一种来源于造血干细胞的血液系统恶性疾病,以髓系来源的异常分化原始细胞克隆性扩增为特征,年龄<60岁患者的长期生存率约35%-45%,而≥60岁患者则降至10%-15%[1]。尽管新诊断(ND)AML患者规范接受强化诱导和巩固治疗,依然有约50%的年轻患者及80%-90% 的老年患者出现复发[2]。即使患者达到深度缓解(可测量残留病灶[MRD]阴性状态),5年内复发率仍可达40%[3]。复发患者预后极差,5年生存率不足10%[4]。当前,复发已成为提高AML疗效的主要瓶颈[1]。
缓解后维持治疗是预防AML复发的有效手段之一[3],适用于具有不良生物学特征(如复杂核型、TP53突变等[7])、以及巩固治疗后仍微小残留病(MRD)阳性的患者[5]。维持治疗旨在助力免疫系统克服残留白血病细胞所带来的负担,同时阻止克隆演化和生长,最终目的是改善患者的无病生存期(DFS)和/或总生存期(OS)[5]。缓解后维持治疗已成为AML标准治疗之一[8]。
精准靶向、适用性佳,靶向治疗是维持治疗的理想选择
自 20 世纪 60 年代起,研究者就对不同的维持治疗策略展开了研究。在早期,AML缓解后维持治疗策略主要基于白介素、干扰素及化疗,但它们通常与诱导和巩固治疗期间使用的药物相同或相似,其延长完全缓解(CR)时间的作用较为有限[5]。近年来,随着分子靶向治疗的快速发展, AML缓解后的有效维持治疗策略已逐渐转变为以去甲基化药物(HMA)及靶向治疗药物为主的方案[3]。
靶向治疗药物是理想的、权威认可的AML
维持治疗方案
理想的AML维持治疗方案应满足以下要求[3]:
可有效抑制易复发残留白血病细胞的进化,且不会引发与治疗相关的基因组不稳定
不应增加感染风险和输血需求,不应降低患者生活质量
易于给药且所需的监测频次和医院就诊次数较少
若为HSCT后维持治疗,需不增加移植物抗宿主病(GVHD)风险、不影响移植物抗白血病(GVL)效应和不干扰移植后免疫抑制药物的使用
基于上述要求,目前部分药物在使用时需谨慎考量:化疗药物的治疗相关毒性可导致频繁的药物减量和提前停药 [5];HMA,尤其是与维奈克拉等药物联合使用时,可引发血细胞减少,进而增加感染风险和输血需求[3];免疫调节剂有增加GVHD的风险[3];免疫检查点抑制剂可诱发自身免疫性肝炎和结肠炎等免疫毒性[3]。与之不同的是,靶向治疗药物可精准作用于白血病细胞表面的特定靶点或干扰异常信号通路,选择性地抑制白血病的发展[9]。由于其作用机制不杀伤正常细胞,与传统细胞毒药物相比,靶向治疗药物具有更高的特异性与选择性,安全性和耐受性也更为出色[9]。
MD安德森研究者汇总了AML常用维持治疗策略,并结合现有数据对这些方法当前的临床适用性进行了评估(表1)。研究者指出,相较于其他AML维持治疗药物,针对"驱动基因"设计的特异性靶向治疗药物(如FLT3抑制剂、IDH抑制剂)在疗效、安全性、给药便利性及精准性方面表现突出,是临床适用性整体较好的维持治疗方案[3]。最新版NCCN指南也认可靶向治疗药物的维持治疗价值,推荐其用于存在基因突变史患者的化疗后及异基因HSCT后维持治疗[8]。
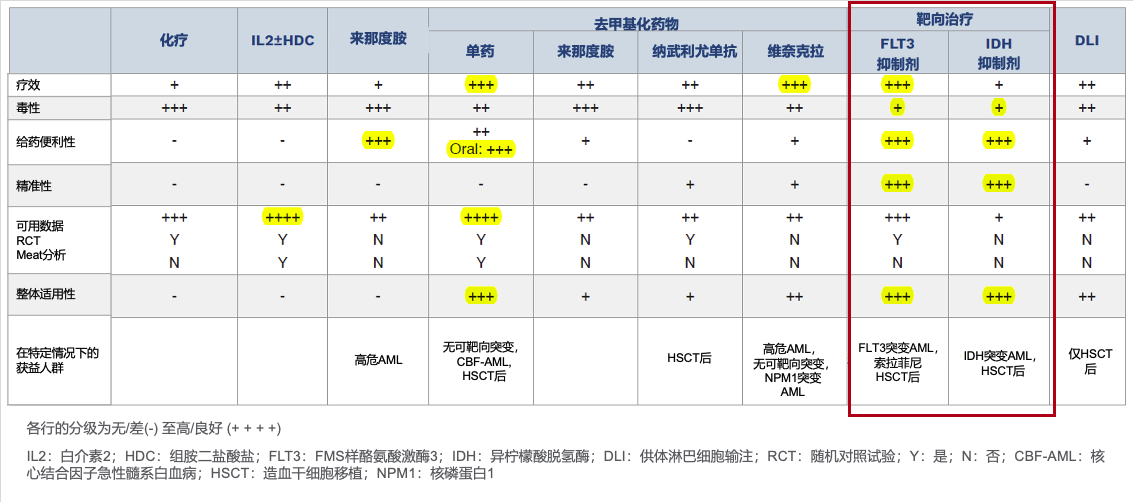 表1. 不同的维持治疗方法和MD安德森临床使用经验汇总[3]
表1. 不同的维持治疗方法和MD安德森临床使用经验汇总[3]
IDH1抑制剂维持治疗潜力可观
在AML靶向治疗药物领域,FLT3抑制剂在维持治疗中的作用已得到充分验证[3];维奈克拉联合HMA用于非HSCT和HSCT后维持治疗的研究也在稳步推进 [3];特别值得一提的是,IDH抑制剂也正积极开展维持治疗相关研究[3]。
IDH1是AML的关键治疗靶点,在中国成人AML患者中,约2%-16%会出现 IDH1 突变[10-13]。这种突变常与AML预后不良密切相关,严重影响AML患者的OS 和 无事件生存期(EFS)[14]。IDH1抑制剂,如艾伏尼布(IVO)可抑制突变的IDH1酶,阻断肿瘤代谢物2-羟戊二酸(2-HG)的产生,恢复α-酮戊二酸(α-KG)的正常生理功能,从而纠正癌变细胞的代谢异常,抑制肿瘤细胞的生长和发展[16]。鉴于IDH1抑制剂在IDH突变白血病中的疗效、安全性和使用便利性,其在AML维持治疗中具有巨大的发展潜力[3]。
深度缓解、延长生存,IDH1 抑制剂维持治疗彰显潜力
IDH1 抑制剂用于化疗后维持治疗的最新进展
一项开放标签、多中心Ⅰ期研究报告了IDH抑制剂与强化疗联合治疗ND IDH1/2突变AML患者的治疗反应和生存结果。60例ND IDH1突变AML患者接受诱导化疗(多柔比星或伊达比星+阿糖胞苷)联合IVO治疗;诱导治疗结束时,疗效至少达到部分缓解的患者接受巩固治疗(中大剂量阿糖胞苷或米托蒽醌/依托泊苷),并持续IVO给药;巩固治疗结束时仍处于缓解期的患者可接受IVO单药维持治疗。结果显示,78.3%的患者获得完全缓解(CR)+CR伴不完全血液学恢复(CRi)/CR伴不完全血小板恢复(CRp)(表2),其中39.0%实现IDH1突变清除,80.0%达到MRD阴性。中位随访36.3个月时,36个月OS率达67%(表2)[17]。
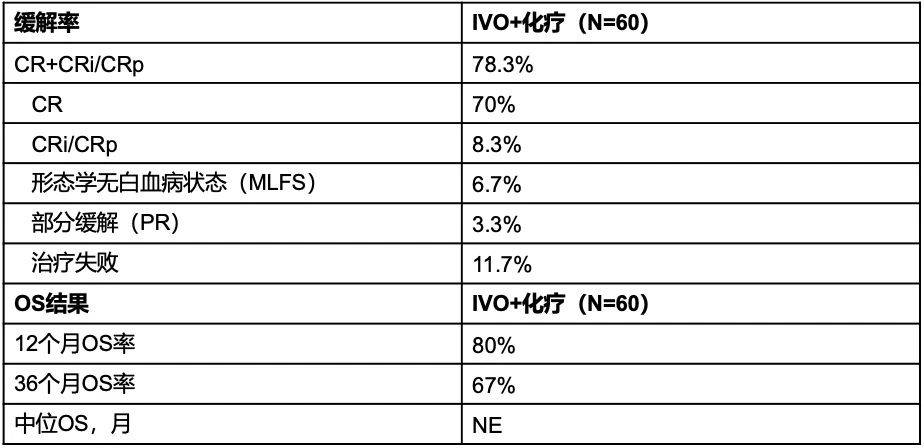 表2. 最佳总体缓解率及OS结果[17]
表2. 最佳总体缓解率及OS结果[17]
2024年ASH大会报道的一项II期研究探索了IVO+CPX-351在ND或复发/难治性(R/R)IDH1突变 AML和高危骨髓增生异常综合征(MDS)患者中的疗效和安全性。患者接受CPX-351联合IVO治疗。IVO则从诱导第1天开始给药,持续至巩固治疗,然后继续作为口服维持治疗,持续长达2年。在ND AML亚组中,75%的患者获得CR+CRi/p/h,MRD阴性率更是高达100%。生存获益同样表现优越,中位缓解持续时间(DoR)、EFS及OS分别达16.3个月、17.5个月和29.3个月(图1)[18]。即使是R/R AML患者,也有43%获得CR+CRi/p/h和MRD阴性,中位EFS及OS也分别可达4.2个月和12个月[18]。
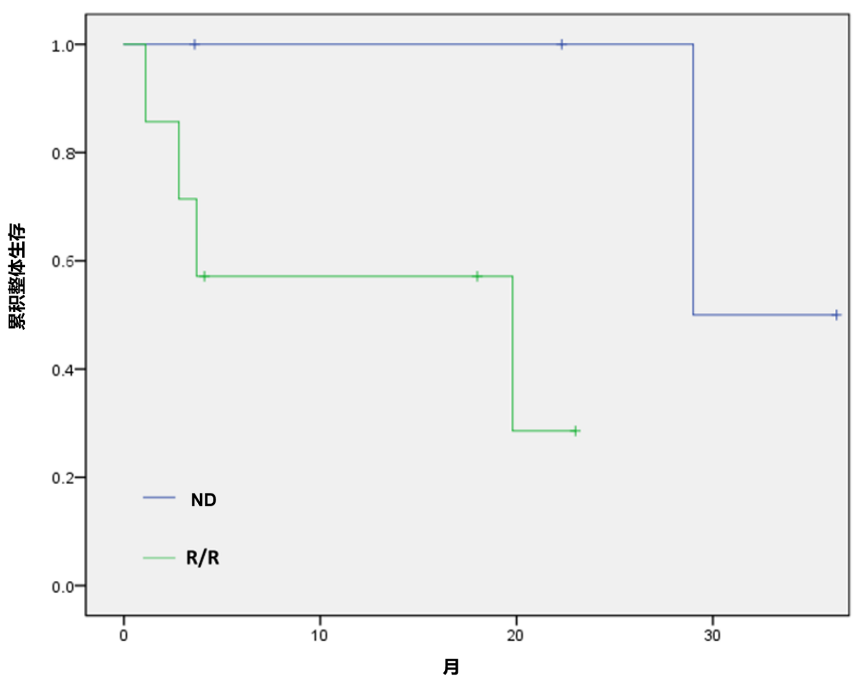 图1. IVO+CPX-351治疗IDH1突变 AML的OS曲线[18]
图1. IVO+CPX-351治疗IDH1突变 AML的OS曲线[18]
2024 年ASH大会报道的一项病例集中有1例患者的诊治经历同样体现了IVO的维持治疗价值。该患者是一例65岁伴DNMT3A、IDH1、NPM1共突变的女性患者(IDH1 VAF 15.7%),经7+3方案诱导达CR后,应用中剂量阿糖胞苷巩固治疗,并在第三天加入IVO,同时维持治疗期间继续接受IVO治疗。该患者在诱导治疗开始后的第5个月即实现 MRD转阴,截至报告发布时间,患者已持续CR超过18个月且IDH1突变已完全清除[19]。
IDH1 抑制剂用于移植后维持治疗的最新进展
一项多中心、I期临床试验首次披露了IDH1突变AML患者HSCT后使用IVO维持治疗的效果。共16例患者在 HSCT 后使用IVO进行维持治疗,开始维持治疗的中位时间为 HSCT 后第66天。结果显示,接受IVO维持治疗的患者展现出良好的生存获益:2年非复发死亡率(NRM)为0%,2年无进展生存(PFS)率和OS率分别达到81%和88%(图2)。移植后6个月内II-IV级急性GVHD的累积发生率仅6.3%,未出现III-IV级急性GVHD病例,且治疗相关不良事件多为1-2级。此研究表明,IVO用于AML移植后的维持治疗,可为IDH1突变AML患者提供颇具前景的生存获益[20]。
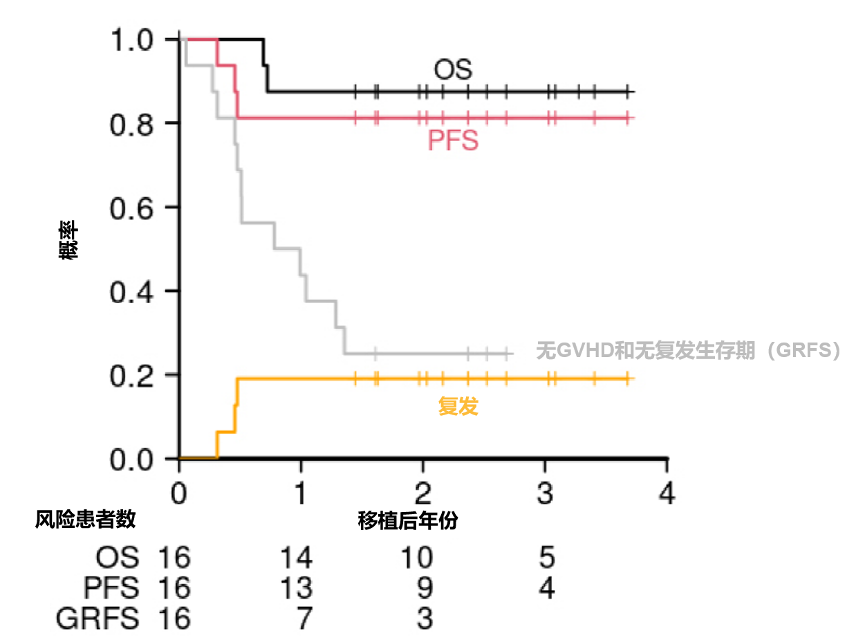 图2. 患者整体生存情况[20]
图2. 患者整体生存情况[20]
总结
靶向治疗药物用于AML维持治疗可精准识别并攻击AML细胞的特定分子靶点,在高效杀伤癌细胞的过程中,可最大程度降低对正常细胞的损害。这一特性在保障患者安全性的基础上,显著降低AML复发风险、有效延长患者生存期。此外,靶向治疗药物使用便利,是理想的AML维持治疗方案[3]。
随着IDH1突变对AML预后影响的逐步明确,IDH1抑制剂在 AML 治疗领域的应用日益广泛,以IVO为代表的多项数据证实了IDH1抑制剂在AML维持治疗领域具有可观的疗效和临床价值[20]。基于此,IDH1 抑制剂有望成为极具前景的AML维持治疗药物。
专家简介
血液内科主任医师、科室行政副主任、教授、博士生导师
研究方向:造血干细胞移植和细胞免疫治疗的临床和基础研究
中国医师协会血液学分会全国委员
中华医学会血液学分会造血干细胞移植学组副组长
海峡两岸医药卫生交流协会血液病学专业委员会副主任委员
江苏省研究性医院学会造血干细胞移植和免疫治疗分会主任委员
江苏省医学会血液学分会常委
江苏省医师协会血液医师分会副会长
江苏省医学会血液学分会造血干细胞移植和细胞治疗学组组长
江苏省“科教兴卫”和“科教强卫”重点医学人才
江苏省333高层次人才,六大高峰人才,姑苏重点医学人才
中华血液杂志编委
国际输血及血液学杂志编委
中华器官移植杂志编委
JHO、Annals of Hematology和BMT等杂志的特约审稿人
法国南特大学医院中心、美国MD. Anderson癌症中心和Fred Hutchinson癌症研究中心访问学者
长期从事恶性血液病的移植和免疫治疗的临床和基础研究,作为第一负责人承担国家自然基金联合专项重点项目1项、面上项目3项、国家血液系统疾病临床医学研究中心转化医学重点项目1项、江苏省社会发展临床前沿技术重点项目以及其他省厅市级课题26项;作为主要研究者获国家科技进步二等奖1项、江苏省科学技术奖一等奖1项、其他省部级厅市级科技进步奖和新技术引进奖20项;创新性开展了16项新技术和新疗法,作为第一发明人获得国家发明专利授权1项,参编专著9部,参与制定全国造血干细胞移植和CAR-T相关专家共识和指南14项。
· 以第一/通讯作者在JCO、JHO等杂志发表SCI论文43篇,IF累计335分,其中一区9篇,二区15篇,单篇最高IF为42.1分;单篇最高引用335次,被列为全球1%之内被高引用论文。
[1].中华医学会血液学分会实验诊断学组.中华血液学杂志, 2021, 42(11) : 889-897.
[2].Schlenk RF, et al. Leukemia. 2017 May;31(5):1217-1220.
[3].Senapati J, et al. Haematologica. 2023 Sep 1;108(9):2289-2304.
[4].中华医学会血液学分会白血病淋巴瘤学组. 中华血液学杂志, 2023, 44(9) : 713-716.
[5].Molica M, et al. Am J Hematol. 2019 Nov;94(11):1254-1265.
[6].Patel SA, et al. Blood Rev. 2021 Nov;50:100863.
[7].中国临床肿瘤学会(CSCO)恶性血液病诊疗指南2024.
[8].NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®).Acute Myeloid Leukemia. Version 2.2025.
[9].蔡少芬,孔繁聪,李菲等 输血与检验,2024(01):76-80.
[10].米瑞华等.华中华血液学杂志,2011,32(09):610-610.
[11].王蓉娴等.中华医学杂志,2013,93(10):751-751.
[12].吴瑞盈等.中华血液学杂志,2021,42(01):39-39.
[13].Lin J, et al. Ann Hematol, 2012 Apr;91(4):519-25
[14].Qin H,et al.Medicine(Baltimore).2024 Dec 6;103(49):e40565.
[15].Zeidner J,et al.2024 EHA. Poster 541.
[16].Dhillon S.2018 Sep;78(14):1509-1516.
[17].Stein EM, et al. 2021 ASH, Abstract 1276.
[18].Croden J,et al.2024 ASH. Poster 4271.
[19].Zhao LM, et al.2024 ASH. Blood (2024) 144 (Supplement 1): 6055.
[20].Fathi AT, et al. Clin Cancer Res. 2023 Jun 1;29(11):2034-2042.
免责声明:
本内容仅供医学科学事务部科学沟通使用,不用做药品推广。医疗卫生专业人士在作出任何与治疗有关的决定时,应根据患者具体情况,参考药监局核准的药品说明书。
本文转自:CCMTV
排版编辑:肿瘤资讯-Olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


