冬去春来,乍暖还寒,万物悄然复苏。在这个季节交替的关键时刻,血液学领域的研究创新也如同春芽般蓬勃发展。过去一个月内,NEJM、Blood、Leukemia等顶级期刊发表了多项重要研究成果,从抗体疗法的新进展到微环境探索的深度剖析,呈现出血液学领域蓬勃的生机与活力。【肿瘤资讯】特整理此文,与您分享前沿突破,共同见证血液学研究的春天!
NEJM
Fixed-Duration Acalabrutinib Combinations in Untreated Chronic Lymphocytic Leukemia
基于阿可替尼的固定疗程联合方案治疗初治慢性淋巴细胞白血病
既往,化学免疫治疗是慢性淋巴细胞白血病(CLL)的标准治疗,但现已被靶向治疗所替代。Brown等研究者开展了三期AMPLIFY临床试验,评估固定疗程阿可替尼-维奈克拉(有或无奥妥珠单抗)与化学免疫治疗的对比疗效。研究纳入867例初治CLL患者,随机分配接受阿可替尼-维奈克拉(AV,291例)、阿可替尼-维奈克拉-奥妥珠单抗(AVO,286例)或化学免疫治疗(FCR或BR,290例)。
中位随访40.8个月后,AV组、AVO组和化学免疫治疗组的36个月无进展生存(PFS)率分别为76.5%、83.1%和66.5%。AV组与化学免疫治疗组相比,疾病进展或死亡风险降低35%(HR 0.65,P=0.004);AVO组效果更佳(P<0.001)。36个月总生存(OS)率分别为94.1%、87.7%和85.9%。不良反应方面,3级或更高级别中性粒细胞减少症在三组中分别为32.3%、46.1%和43.2%。Covid-19死亡病例在三组中分别为10、25和21例。
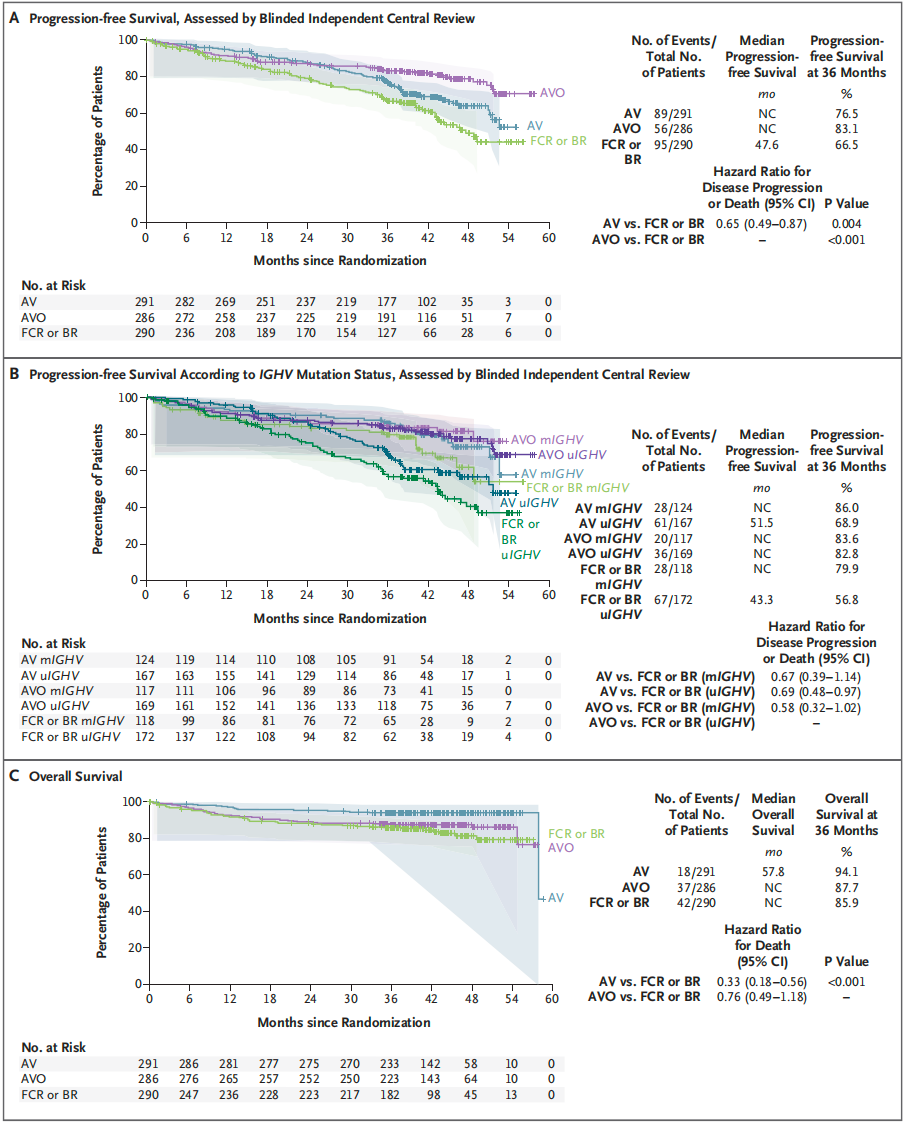
结论:对于初治CLL患者,固定疗程阿可替尼-维奈克拉(有或无奥妥珠单抗)治疗与化学免疫治疗相比,显著延长了PFS。
Blinatumomab in Standard-Risk B-Cell Acute Lymphoblastic Leukemia in Children
贝林妥欧单抗在儿童标准风险B细胞急性淋巴细胞白血病中的应用
B细胞急性淋巴细胞白血病(B-ALL)是儿童最常见的恶性肿瘤。尽管总体治愈率较高,但复发的B-ALL仍是儿童癌症相关死亡的主要原因。过去几十年,B-ALL的治愈率显著提高,但传统化疗强化方案的进展已经放缓。Gupta等研究者开展了一项国际性、随机对照的儿童肿瘤学组临床试验,探究在新诊断的标准风险B-ALL儿童中,将贝林妥欧单抗添加到标准化疗中是否能改善预后。
研究纳入了具有中等或高复发风险的标准风险B-ALL儿童患者,随机分组接受单纯化疗或化疗加两个非连续性28天周期的贝林妥欧单抗治疗。主要终点是无病生存(DFS)率。
共纳入1440例患者(722例单纯化疗组,718例贝林妥欧单抗联合化疗组)。在中位随访2.5年后,贝林妥欧单抗联合化疗组的3年DFS率为96.0±1.2%,而单纯化疗组为87.9±2.1%(限制性平均生存时间差异72天;P<0.001)。中等复发风险患者中,两组的3年DFS率分别为97.5±1.3%和90.2±2.3%;高复发风险患者中,相应数值为94.1±2.5%和84.8±3.8%。
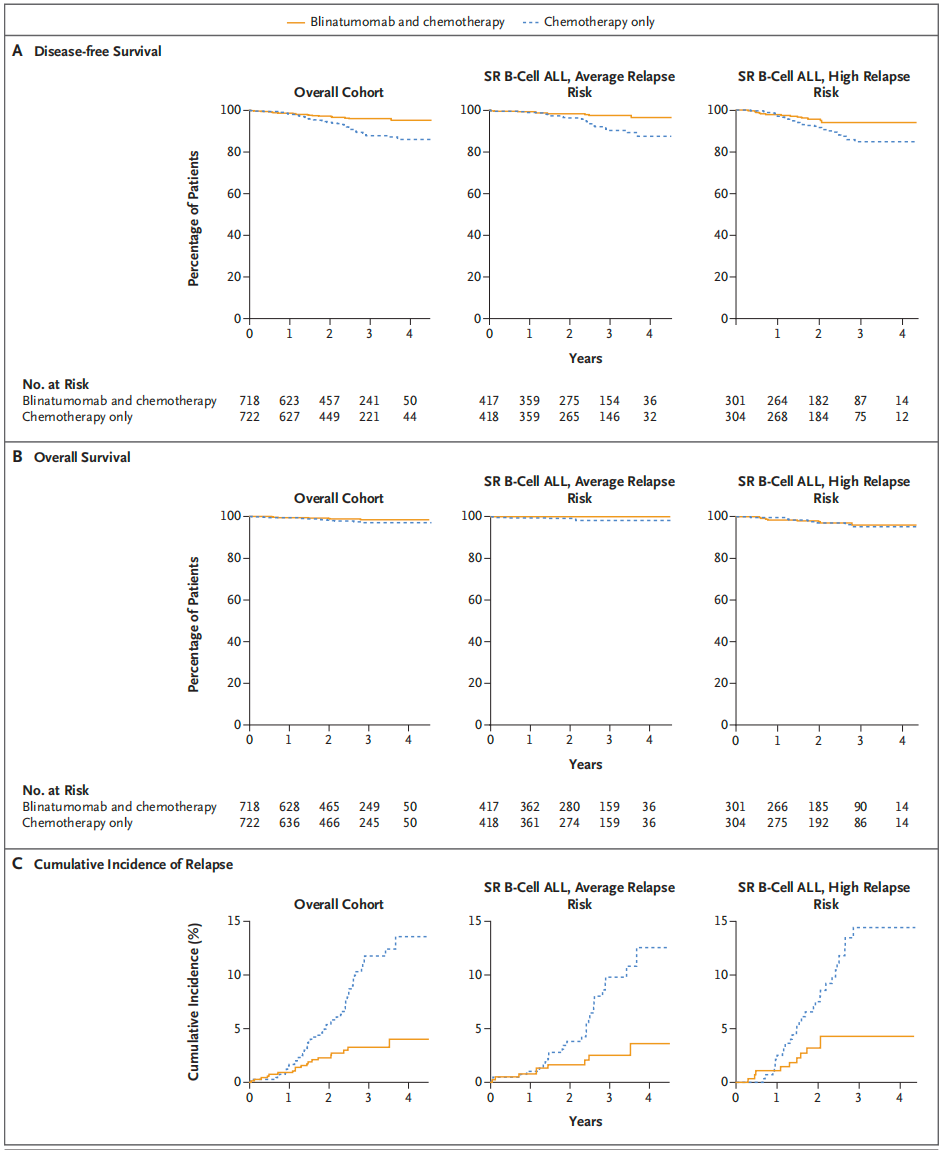
在贝林妥欧单抗周期中,高级别的细胞因子释放综合征(CRS)、癫痫发作和败血症罕见,但中等复发风险患者中,贝林妥欧单抗组非致命性败血症和导管相关感染的发生率显著高于单纯化疗组。
结论:在具有中等或高复发风险的标准风险新诊断儿童B-ALL患者中,贝林妥欧单抗联合化疗显著改善了DFS率。
Blood
Long-term 3-year follow-up of mosunetuzumab in relapsed or refractory follicular lymphoma after ≥2 prior therapies
经过≥2线前线治疗后复发或难治性滤泡性淋巴瘤应用莫妥珠单抗的长期3年随访
滤泡性淋巴瘤(FL)是全球第二常见的淋巴瘤类型。尽管总体生存率持续改善,但许多患者会经历多次复发,后续治疗的PFS逐渐减短。莫妥珠单抗是首创的CD20×CD3 T细胞双特异性抗体,能够重定向T细胞消除恶性B细胞。
Sehn等人在90例经过≥2线治疗的R/R FL患者中评估了固定疗程莫妥珠单抗的疗效和安全性。在中位随访37.4个月后,完全缓解(CR)率和客观缓解率(ORR)分别为60.0%和77.8%。中位缓解持续时间(DOR)为35.9个月。54例达到CR的患者中,49例在治疗结束时维持CR;中位持续CR时间未达到;30个月中位持续CR率为72.4%。36个月ORR为82.4%,中位PFS为24.0个月。莫妥珠单抗治疗8个周期后,CD19+ B细胞恢复的中位时间为18.4个月。在延长随访期间未报告新的CRS事件或严重不良事件。
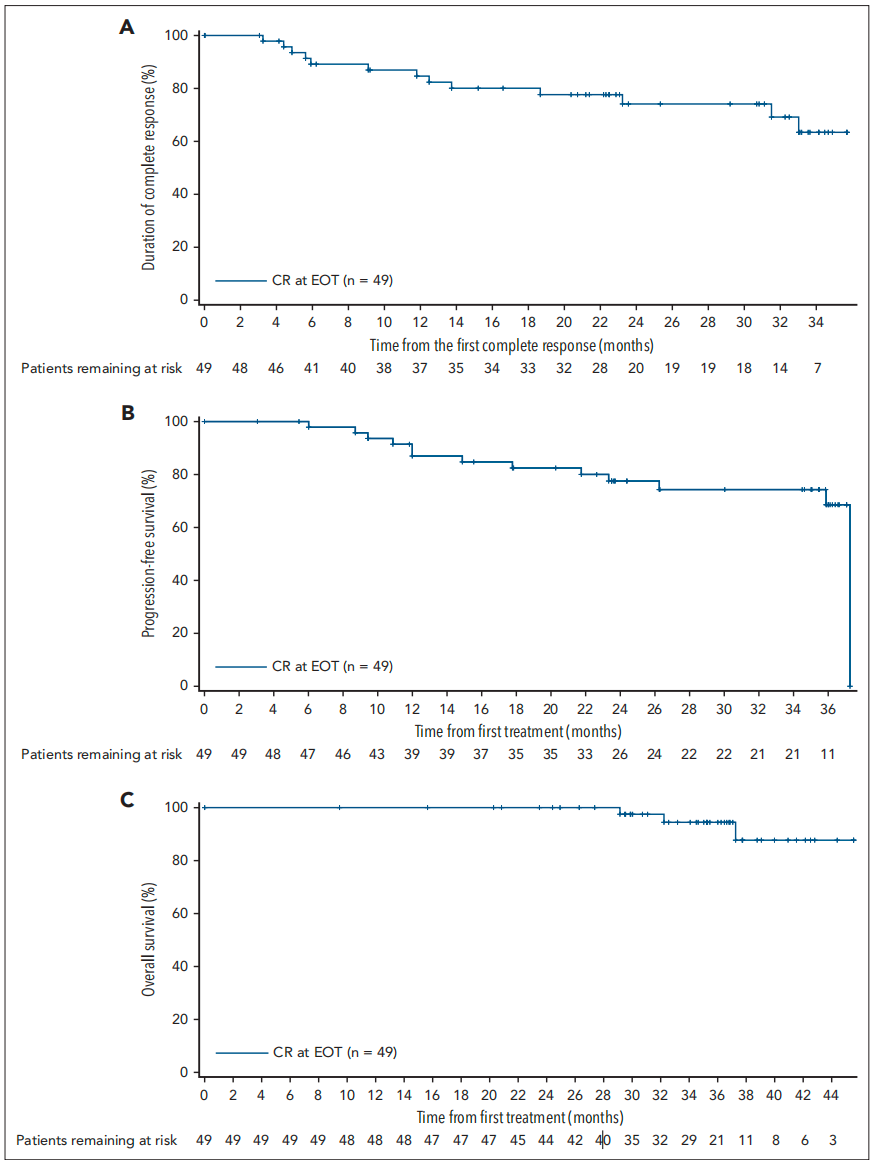
结论:经过长期随访,莫妥珠单抗在R/R FL患者中展现了高缓解率、持久缓解和可控的安全性,无长期安全性问题。这支持莫妥珠单抗作为现成可用、固定疗程、安全有效的门诊治疗方案,适用于R/R FL患者,包括高风险患者。
Asciminib plus dasatinib and prednisone for Philadelphia chromosome-positive acute leukemia
阿思尼布联合达沙替尼和泼尼松治疗费城染色体阳性急性白血病
费城染色体阳性(Ph+)急性淋巴细胞白血病(ALL)是由BCR::ABL1融合基因驱动的侵袭性白血病。虽然达沙替尼等酪氨酸激酶抑制剂(TKIs)显著改善了患者预后,但部分患者会发展出耐药性,尤其是通过获得T315I突变。阿思尼布是一种别构抑制剂,与ATP竞争性TKI结合位点不同,可能通过双重抑制机制深化反应并预防耐药克隆出现。
Luskin等人开展了一项I期临床试验(NCT02081378),共纳入24例成人患者(Ph+ ALL 22例,CML-LBC 2例),采用3+3剂量递增设计评估阿思尼布联合达沙替尼和泼尼松的安全性和有效性。患者年龄中位数为64.5岁。
研究确定阿思尼布80mg每日一次是推荐II期剂量。限制性毒性为无症状性3级胰腺酶升高,但无临床胰腺炎。在新诊断的ALL患者中,84天时的血液学完全缓解率和细胞遗传学缓解率均为100%,89%通过流式细胞术达到可测量残留病灶(MRD)阴性(<0.01%),74%和26%患者分别达到BCR::ABL1 RT-PCR <0.1%和<0.01%。
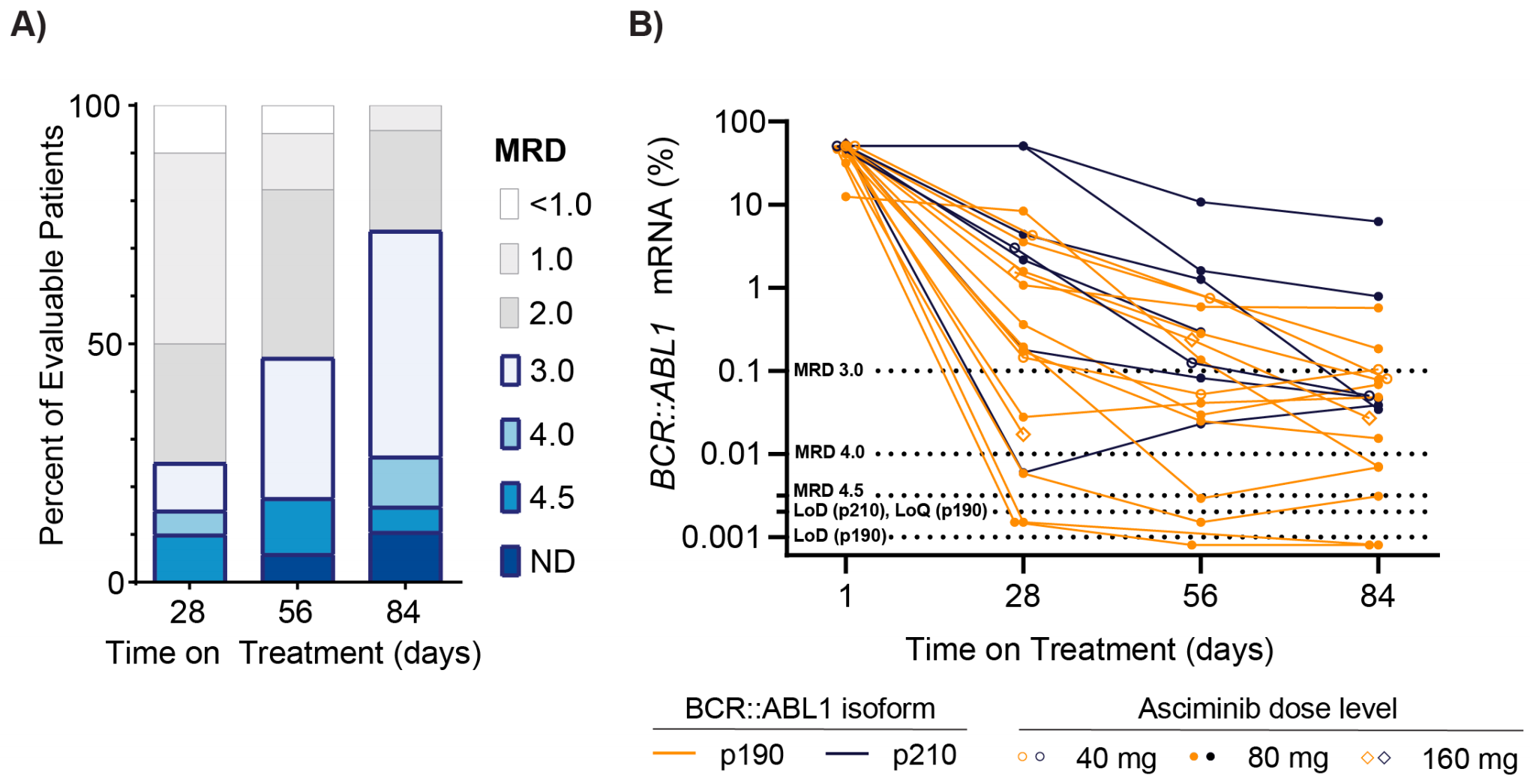
结论:达沙替尼与阿思尼布双重BCR::ABL1抑制在新诊断Ph+ ALL患者中安全有效,分子学缓解随时间加深,这种联合方案为高龄或不适合强烈化疗的患者提供了新的治疗选择。
The Lancet Haematology
Isatuximab, bortezomib, lenalidomide, and limited dexamethasone in patients with transplant-ineligible multiple myeloma (REST): a multicentre, single-arm, phase 2 trial
艾沙妥昔单抗、硼替佐米、来那度胺和限制性地塞米松用于不适合移植的多发性骨髓瘤患者(REST):一项多中心、单臂、II期临床试验
抗CD38单克隆抗体联合标准疗法可改善多发性骨髓瘤(MM)患者预后,但长期使用皮质类固醇会增加感染风险。Bugge Askeland等进行了这项II期试验,评估艾沙妥昔单抗、每周硼替佐米、来那度胺和限制性地塞米松在不适合自体造血干细胞移植(ASCT)的新诊断MM患者中的安全性和有效性。
研究纳入51例患者(27例女性,24例男性),中位年龄77岁。患者接受28天为一疗程的治疗:艾沙妥昔单抗10mg/kg静脉注射(第1疗程每周一次,第2-18疗程每两周一次);硼替佐米1.3mg/m²皮下注射(第1-8疗程的第1、8、15天);来那度胺25mg口服(第1-21天,持续至疾病进展);地塞米松20mg口服(仅限前两个疗程)。主要终点是治疗18个疗程期间或之后的MRD阴性的CR率。
在中位随访27.0个月后,19例患者(37%)达到MRD阴性的CR。51例患者中有18例(35%)发生疾病进展或死亡,8例(16%)患者死亡。最常见的3~4级不良事件为中性粒细胞减少(55%)、感染(41%)和血小板减少(22%)。14例(27%)患者在19个疗程前停止治疗,主要因疾病进展(16%)和不良事件(8%)。2例死亡(肺炎和败血症)被评估为可能与研究治疗相关。
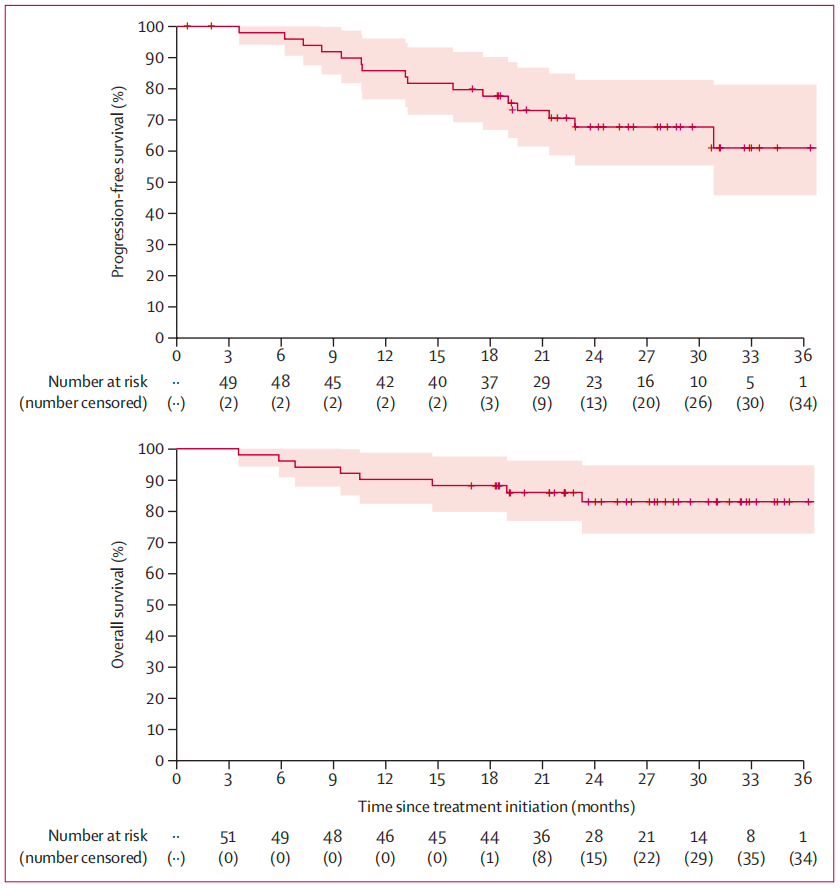
结论:对于不适合ASCT的老年MM患者,艾沙妥昔单抗、每周硼替佐米和来那度胺联合限制性地塞米松作为初始治疗安全有效。在这类患者群体中,可使用两个疗程后就停用地塞米松的修改型四药联合方案。
[1] Brown JR, Seymour JF, Jurczak W, et al. Fixed-Duration Acalabrutinib Combinations in Untreated Chronic Lymphocytic Leukemia. N Engl J Med. 2025;392(8):748-762. doi:10.1056/NEJMoa2409804
[2] Gupta S, Rau RE, Kairalla JA, et al. Blinatumomab in Standard-Risk B-Cell Acute Lymphoblastic Leukemia in Children. N Engl J Med. 2025;392(9):875-891. doi:10.1056/NEJMoa2411680
[3] Sehn LH, Bartlett NL, Matasar MJ, et al. Long-term 3-year follow-up of mosunetuzumab in relapsed or refractory follicular lymphoma after ≥2 prior therapies. Blood. 2025;145(7):708-719. doi:10.1182/blood.2024025454
[4] Luskin MR, Murakami MA, Keating J, et al. Asciminib plus dasatinib and prednisone for Philadelphia chromosome-positive acute leukemia. Blood. 2025;145(6):577-589. doi:10.1182/blood.2024025800
[5] Askeland FB, Haukås E, Slørdahl TS, et al. Isatuximab, bortezomib, lenalidomide, and limited dexamethasone in patients with transplant-ineligible multiple myeloma (REST): a multicentre, single-arm, phase 2 trial. Lancet Haematol. 2025;12(2):e120-e127. doi:10.1016/S2352-3026(24)00347-8
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


