病史摘要
患者,女性,32岁,因"确诊多发性骨髓瘤3年余,反复腰骶部疼痛1年半"入院。患者于2019年3月因乏力伴腰痛于外院就诊,诊断为多发性骨髓瘤(IgA-λ型,DS ⅢB期,ISS Ⅲ期,R-ISS Ⅲ期)。VAD(硼替佐米+多柔比星+地塞米松)诱导达sCR后行自体造血干细胞移植,伊沙佐米维持治疗1年后出现髓外复发。先后予D-RDE(达雷妥尤单抗+来那度胺+地塞米松+依托泊苷)、BPD(苯达莫司汀+泊马度胺+地塞米松)、DKD(达雷妥尤单抗+卡非佐米+地塞米松)、PSD(泊马度胺+塞利尼索+地塞米松)等方案治疗,症状反复。2022年8月至本院就诊。
症状特征
专科检查:神清,皮肤黏膜未及瘀点瘀斑,全身浅表淋巴结未及明显肿大,腹软,无压痛、反跳痛,肝、脾肋下未触及,肝区轻扣痛,移动性浊音(−),双下肢抬腿因腰骶部疼痛受限,余神经体征阴性,双下肢无水肿。
诊断方法
免疫固定电泳、游离轻链、骨髓MRD、FISH皆阴性。腰骶椎MRI增强、PET/CT示骶2~4水平椎管内外病变,较前进展。上腹部MRI增强石肝脏S7、8段包膜下小结节病灶。
治疗方法
患者比较虚弱,予以营养支持,泊马度胺联合小剂量激素治疗骨髓瘤,泊沙康唑治疗肝脏脓肿。5周后,肝脏脓肿消失,予VP-DECP方案1个疗程,后序贯骶尾部放疗3周。2022年12月评估提示疾病进展。2022年12月15日行同胞半相合异基因造血干细胞移植,移植后疗效评估为完全缓解。
临床转归
2023年7月开始泊马度胺单药维持治疗,目前疗效评估仍为完全缓解。目前无病生存时间已达9个月,仍在随访中。
关键词
多发性骨髓瘤;髓外病变;复发难治;异基因造血干细胞移植;肝结节
多发性骨髓瘤(multiple myeloma,MM)是第二常见的血液系统恶性肿瘤,约占所有肿瘤的1%,约占血液系统恶性肿瘤的10%。MM起源于浆细胞,恶性克隆性浆细胞的增殖及其产生的单克隆免疫球蛋白(M蛋白)导致了贫血、肾功能不全、广泛溶骨破坏、高钙血症等临床表现。新药时代由于免疫调节剂、蛋白酶体抑制剂、抗CD38单克隆抗体的广泛应用以及CAR-T治疗、造血干细胞移植的不断开展,该病缓解率和缓解深度大幅提高,但仍不能被治愈,绝大多数患者终将复发。髓外复发尤为棘手,常出现耐药,多药治疗联合放疗仍不能控制,给患者带来严重危害。我科收治了1例自体移植后出现广泛髓外复发患者,经过多线联合免疫靶向治疗和化疗仍持续进展(progress disease,PD),予同胞半相合异基因造血干细胞挽救性移植后,患者得到完全缓解(complete remission,CR),生活质量显著改善。现将本例患者诊治经过报道如下,并结合国内外文献进行复习,为MM髓外复发/难治性患者的治疗提供借鉴。
一、一般资料
患者,女性,32岁,因"确诊MM3年余,反复腰骶部疼痛1年半"入院。患者于2019年3月因乏力伴腰痛于外院就诊,免疫固定电泳示IgA-λ型,骨穿涂片示浆细胞约占86%,FISH示1q21扩增,PET/CT示全身骨骼多发低密度灶,诊断为MM(IgA-λ型,DS Ⅲ B期,ISS Ⅲ期,R-ISS Ⅲ期)。
外院予4个疗程VAD方案治疗达严格意义的完全缓解(stringent complete remission,sCR),2019年9月予马法兰预处理后行自体造血干细胞移植,移植后评估为sCR,予伊沙佐米维持治疗。
2020年10月出现腰骶处疼痛,PET/CT示骶前条块状软组织肿块伴S3左侧椎管内软组织影(82 mm×29 mm),穿刺病理提示浆细胞累及,评估病情为髓外复发。先后予D-RDE、BPD、DKD、PSD等方案治疗,病情控制不佳。2022年8月至本院就诊,为进一步治疗收入我科。
专科检查:神清,皮肤黏膜未及瘀点瘀斑,全身浅表淋巴结未及明显肿大,腹软,无压痛、反跳痛,肝、脾肋下未触及,肝区轻扣痛,移动性浊音(−),双下肢抬腿因腰骶部疼痛受限,余神经体征阴性,双下肢无水肿。患者自起病以来,精神可,胃纳可,大便如常,小便如常,睡眠尚可,饮食未见异常,体重无明显变化。
既往史:2021年7月因阑尾炎行阑尾切除术。否认高血压、糖尿病既往史,否认外伤史、家族史、冶游史、烟酒史。
二、检查
1.M蛋白:
免疫固定电泳示IgA-κ带痕迹,M蛋白0.15 g/L,IgA 0.28 g/L,IgG 6.9 g/L,IgM 0.2 g/L,血清游离κ轻链5.85 mg/L,血清游离λ轻链8.47 mg/L,κ/λ 0.691。
2.CRAB及生化:
血红蛋白103g/L,Scr 73μmol/L,β2-MG 2.9mg/L。
3.BM:
增生正常,浆细胞0.5%;MRD<10−6,FISH(−)。
4.影像学:
(1)腰骶椎MRI增强提示骶2~4水平椎管内外病变,较2022年6月8日进展。(2)PET/CT提示MM化疗后,多发脊椎椎体内骨质密度增高,骶骨骨质密度不均匀,FDG代谢未见异常。肝脏多发低密度结节,FDG代谢增高,建议增强MRI检查。(3)上腹部MRI增强提示肝脏S7、8段包膜下各一处小结节病灶,S8段病灶旁肝包膜皱缩凹陷伴带状强化,结合患者影像学表现及临床病史,考虑非肿瘤性病变可能大,如感染性病灶(尤需警惕念珠菌感染)所致的微脓肿等,此外肝结核亦不能完全除外;目前考虑肿瘤性病变可能性不甚大,如MM肝脏浸润等;扫及范围腰椎形态及信号未见明显异常。
三、诊断与鉴别诊断
1.诊断:
(1)MM(IgA-λ型,DS Ⅲ B期,ISS Ⅲ期,R-ISS Ⅲ期)髓外复发;(2)自体造血干细胞移植状态;(3)肝结节(念珠菌感染可能);(4)阑尾术后
2.鉴别诊断:
MM髓外复发诊断明确。肝结节需要鉴别恶性和良性。恶性肝结节需考虑原发性肝癌、骨髓瘤肝脏累及;良性肝结节有肝腺瘤、肝硬化结节、肝血管平滑肌脂肪瘤、肝脏感染性结节。患者在肝包膜下的结节呈椭圆形,边缘整齐,甲胎蛋白正常,呈良性结节的表现。虽然未行肝穿刺明确病理,但患者抗真菌治疗后肝结节消失也间接证明了为肝脏真菌感染形成的肝结节。
四、治疗
患者比较虚弱,予以营养支持,2022年8月予PD(泊马度胺+地塞米松)治疗原发病,予泊沙康唑抗真菌治疗。10月24日上腹部MRI增强提示肝结节消失(图1)。但患者腰骶部疼痛进一步加重,腰骶椎MRI增强示骶2、3左后方神经走形处结节状增粗伴明显强化,骶2~4椎体异常信号,评估病情为PD。遂予VP-DECP方案治疗(硼替佐米+泊马度胺+地塞米松+依托泊苷+环磷酰胺+顺铂)联合骶骨放疗,续予泊沙康唑抗真菌感染。
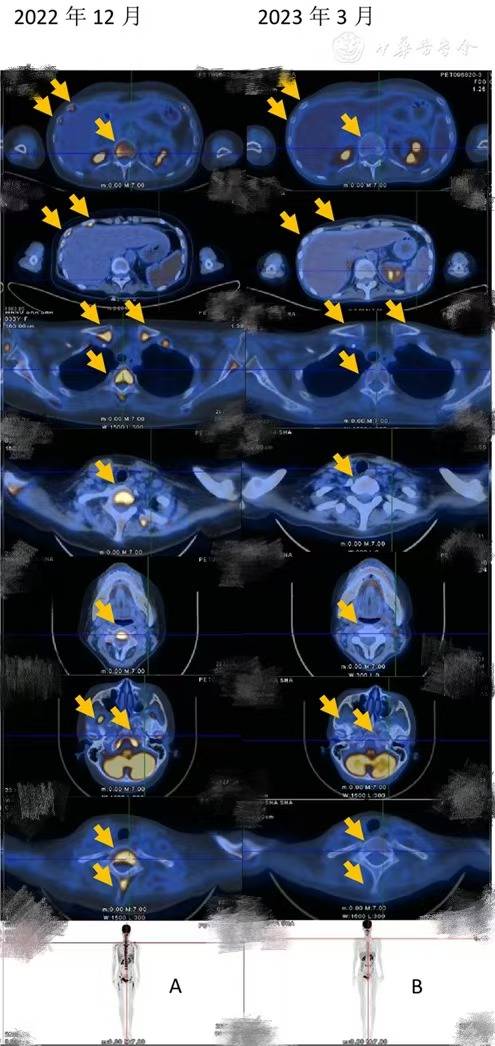
2022年12月评估疗效为SD,免疫固定电泳IgA弱阳性、λ痕迹,M蛋白0.66 g/L,游离轻链正常,骨穿示浆细胞0%,MRD阴性,FISH阴性。PET/CT示骶管及左侧骶孔软组织密度伴FDG代谢增高,考虑肿瘤活性残留可能;全身多发骨骼及脾脏FDG代谢弥漫性增高。L5及骶骨FDG代谢减低,考虑放疗后改变。
2022年12月15日起予塞替派+氟达拉滨+马法兰方案预处理,行同胞半相合异基因造血干细胞移植,并予抗人T细胞球蛋白+环磷酰胺+环孢素+吗替麦考酚预防抑制物抗宿主病(graft versus host disease,GVHD)。
2023年3月,经PET/CT和骨穿等检查疗效评估为CR(图2)。移植后患者未出现GVHD,先后出现肺部混合感染、新冠感染、下肢皮肤软组织感染,和CMV感染予抗感染等对症支持治疗后感染控制。2023年7月,患者状态良好,开始泊马度胺(3 mg)维持治疗,目前MM疗效评估仍为CR。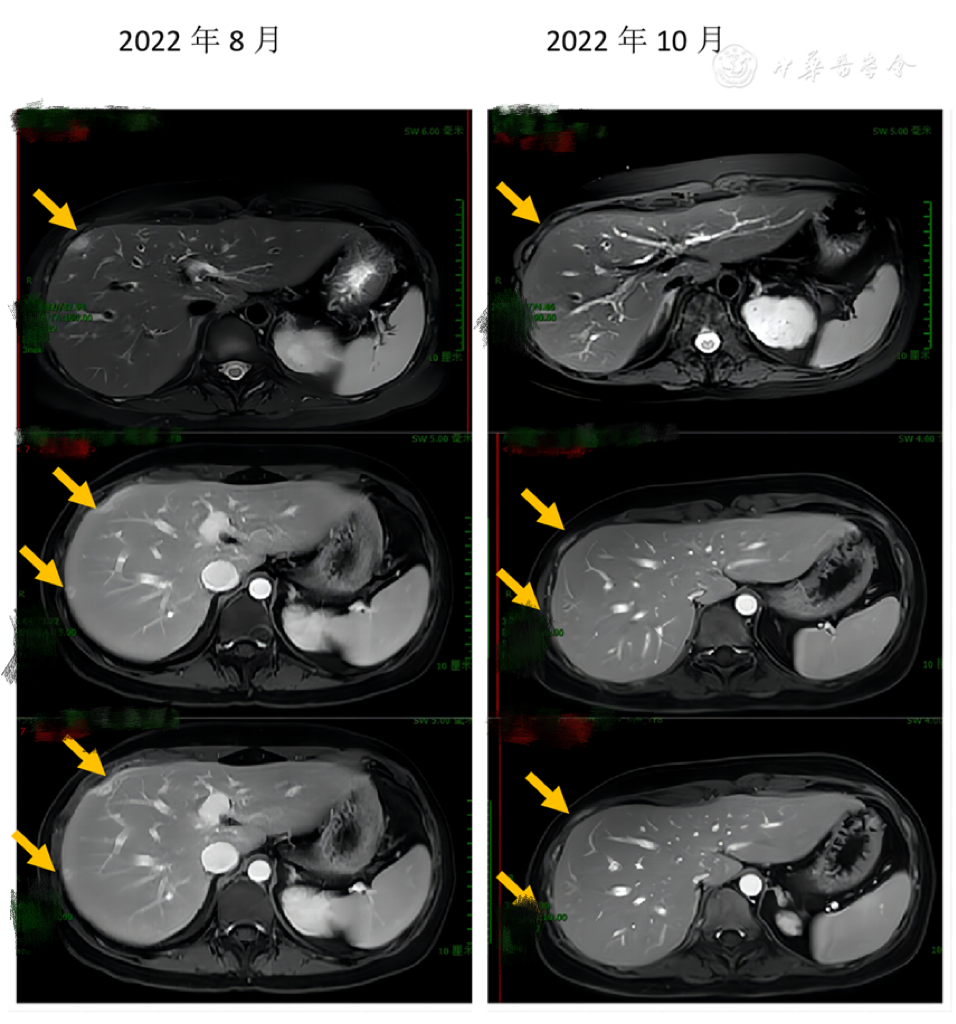
五、治疗结果、随访及转归
目前疗效评估为CR,泊马度胺维持治疗中。无病生存时间(DFS)已达9个月,仍在随访中。
讨论
MM可以出现生长于骨髓之外的亚克隆,导致骨髓瘤细胞在髓外生长,称为MM髓外病变(extramedullary multiple myeloma,EMD)。EMD可以在MM初发时出现,即原发性EMD(primary EMD);也可以在复发时出现,称为继发性EMD(secondary EMD)。Kumar等从预后和治疗角度出发将EMD分为孤立性浆细胞瘤无骨髓浸润、孤立性浆细胞瘤伴微小骨髓浸润、骨相关EMD伴MM(Bone associated EMD with MM,EMM)、非骨依赖性EMD伴MM、器官浸润性EMD和浆细胞白血病。其中85%为骨相关EMD,从初诊到发生EMM的中位时间为19~23个月。
EMD的发病机制仍不清楚,原发性EMD与高危染色体易位t(14;16)、t(14;20)相关。EMD的高危因素还包括骨质破坏、高钙血症、治疗史(>两线治疗 ±治疗时间>6个月)和自体造血干细胞移植。目前EMD尚没有标准的治疗方案,患者受益于基于强化疗的诱导治疗方案,缓解后可接造血干细胞移植;CAR-T细胞治疗也可为复发/难治性的EMD患者提供缓解的可能,以桥接造血干细胞移植。但这些患者预后仍然很差,是MM治疗的临床难题。
本例为MM年轻女性患者,在VAD诱导达sCR行自体移植后维持治疗1年时出现髓外复发,表现为骨相关的继发性EMD。本例患者出现EMD的可能高危因素有骨质破坏和自体造血干细胞移植。复发后外院予DRDE、BPD、DKD、PSD等≥4线的基于强化疗、靶向免疫的方案治疗,疗效不佳。在病程中,患者还出现肝结节,怀疑肝脏侵袭性真菌感染。至本院就诊后,予泊沙康唑抗感染治疗后肝结节消失,但也由于肝脏真菌病,暂缓了强化疗,患者又出现病情进展,予VP-DECP+放疗后疗效评估为SD。在EMD未缓解状态下,予塞替派+氟达拉滨+马法兰强化疗方案预处理行异基因造血干细胞移植挽救性治疗后,患者终于达到CR。
EMD是MM的高危因素之一,预后差,死亡率高,中位OS为36个月。目前尚没有EMD指南或共识来指导治疗,急需开展大型前瞻性随机化临床研究开发新的治疗方案并为指南制定提供依据。本例EMD患者整个治疗过程可谓一波三折,最终靠异基因造血干细胞挽救性移植达到了CR,至今DFS达7个月,目前在随访中,希冀为MM髓外复发/难治性患者的治疗提供借鉴。
上海交通大学医学院附属仁济医院血液科
国际骨髓瘤工作组(IMWG)委员
中华医学会血液学分会常委及浆细胞病学组组长
中国抗癌协会血液病转化专委会 常委
中国医师协会血液科分会常委及骨髓瘤专委会 副主委
中国医药创新促进会药物临床研究专委会 副主委
中国康复医学会血液病康复专委会 主任委员
CSCO中国抗淋巴瘤专家委员会 常委
中国免疫学会血液免疫分会 常委
上海医学会第10届血液学分会 主委
上海免疫学会血液免疫专委会 主委
医学博士、硕士生导师
上海造血干细胞移植联盟--委员
欧洲血液和骨髓移植协会(EBMT)--成员
上海市医学会血液学专科分会第十一届委员会青委会--副主委
上海市医学会血液学专科分会造血干细胞移植学组--委员
上海抗癌协会抗肿瘤药物安全管理专业委员会--委员
上海市中西医结合学会血液病专业委员会--委员
中国抗癌协会淋巴瘤整合康复专委会--委员
中国抗癌协会血液肿瘤专业委员会第二届青年委员会--委员
目前,新型药物序贯自体造血干细胞移植(ASCT)显著延长了MM的总体生存期,但仍不可治愈。该患者接受了ASCT一年后就出现髓外复发。历经几乎所有可及的临床抗MM药物挽救性治疗后持续进展,中枢多部位累及,且伴有肝脏真菌感染,不符合所有临床试验的入组条件,此时新技术CAR-T细胞疗法尚未上市,所以患者后续的治疗选择极有限。
异基因造血干细胞移植是潜在的MM治愈手段,但绝大多数患者为老年起病,有较高的移植相关死亡率(传统清髓性预处理,可高达15%-30%)和并发症风险,临床应用受到极大限制,全国年使用率不到50例。近年来,随着非清髓(RIC)方案、半相合移植技术和GVHD预防策略的进步,异基因造血干细胞移植的安全性和疗效逐步提高,国内外指南将其作为年轻高危或复发/难治性MM患者的可选推荐。
针对该患者,我们制定了全疗程管理方案:包括选用较高肝脏浓度的泊沙康唑清除肝脏病灶;合适剂量的放疗降低肿瘤负荷;3周后采用RIC预处理方案;选择半相合供者以期获得持续GVM效应;移植后计划在合适时机进行药物维持,以等待CAR-T细胞治疗的序贯机会,来平衡疗效和不良事件的风险。该患者移植后6个月开始受泊马度胺的单药维持治疗,较长时期处于MRD-CR且无感染状态,属于较为成功的挽救案例。
总之,异基因造血干细胞移植的适用人群、时机和预处理方案等都在探索优化阶段,有待更多的临床实践推进其临床合理应用。半相合移植技术的进步(如PTCy的应用)显著降低了GVHD风险,避免了长期免疫抑制剂使用诱发细菌、病毒(如CMV)或其他机会性感染。对于高危年轻MM患者可一线应用争取治愈的机会。对于复发/难治性MM患者,RIC方案降低了移植相关毒性,具有可接受的移植相关死亡率,增加了合并症较多患者的移植机会。通过异基因造血干细胞可获得肿瘤负荷的快速下降,免疫重建,相当多的患者有望获得治愈。本中心于20多年前就已开始在高危和复发/难治性MM患者中尝试异基因造血干细胞移植路径的改良,10年无病生存率可达50%。
方怡,沈莉菁,倪蓓文,侯健 等.同胞半相合移植治疗髓外广泛侵犯多发性骨髓瘤1例.中国临床案例成果数据库,2024,06(01):E1146-E1146.DOl:10.3760/cma.j.cmcr20230930-02859.











 苏公网安备32059002004080号
苏公网安备32059002004080号


