“近年来,急性髓系白血病(AML)的诊断和治疗正在迈入精准医学时代。从首次发现IDH1突变与AML的关联性至今,虽然仅仅过去了短短的15年,但针对这一突变的相关认识和研究已经取得了显著进展,可以看到靶向药物研发日趋成熟。接下来的一周,我们将详细介绍IDH1突变的机理、对髓系肿瘤预后的影响、相关抑制剂的开发及其临床数据。希望通过这次深入探讨,能够为临床专家和科研人员提供有价值的参考,凝心聚力,攻克疾病,实现白血病的治愈未来。”
——马军 教授
本期目录
关于IDH和IDH突变
IDH突变对癌症发生发展的调控机制
IDH1突变在AML中的意义
IDH1抑制剂
19世纪20年代,德国生理学家和医学家Otto Warburg教授观察到肿瘤细胞能量代谢的异常特征:“正常细胞依赖氧化磷酸化(主要途径为三羧酸循环)供能,这种方式产生的ATP比糖酵解多,然而肿瘤细胞依赖于糖酵解方式,即使在氧气充足的情况下”1,2,这一观察结果在后来被命名为Warburg效应,该发现为理解代谢重编程如何促进肿瘤的发生发展奠定了基础,并在其问世至今的百年间激励无数研究者投身于肿瘤代谢研究领域,在生物学和医学领域产生了深远影响。

2000年,瑞士Agora转化癌症研究中心的Hanahan教授和麻省理工学院Weinberg教授提出了肿瘤的6大特征性标志理论3,这些肿瘤特征性标志凝练了过去近百年的肿瘤研究,为深入理解癌症搭建了一个基础逻辑框架,被认为是肿瘤研究者的“圣经”。2011年,Hanahan 和 Weinberg教授将此理论更新为肿瘤10大标志4,两位学者认为突变型异柠檬酸脱氢酶1/2(mIDH1/2)等导致的代谢重编程是一条单独的癌症特征性标记,了解其相关机制对于解决一些尚存的问题非常重要。
1、关于IDH和IDH突变
1.1 IDH基因突变的发现
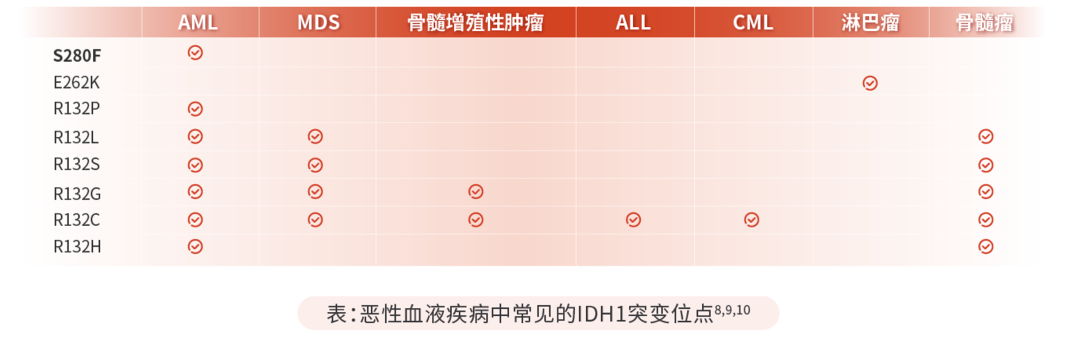
IDH突变最早于2006年在结直肠癌中被报道,但未被重视,2008年由阎海教授及其合作伙伴在成人胶质母细胞瘤(一种恶性脑肿瘤)患者中发现了IDH突变5,6,该成果分别刊登于Science和NEJM,从此让IDH进入了癌症基因组学科学家们的视野。在此后的研究报道中,IDH1/2基因突变的临床意义逐渐在肝内胆管癌、软骨肉瘤、甲状腺癌、前列腺癌、副神经节瘤以及黑色素瘤等在内的众多癌症中被发现。在恶性血液疾病中,IDH突变与急性髓系白血病(AML)的关联在2009年被首次描述7,在骨髓增生异常综合征,急性淋巴细胞白血病,骨髓瘤,淋巴瘤等疾病中也有相关报道。
1.2 IDH家族
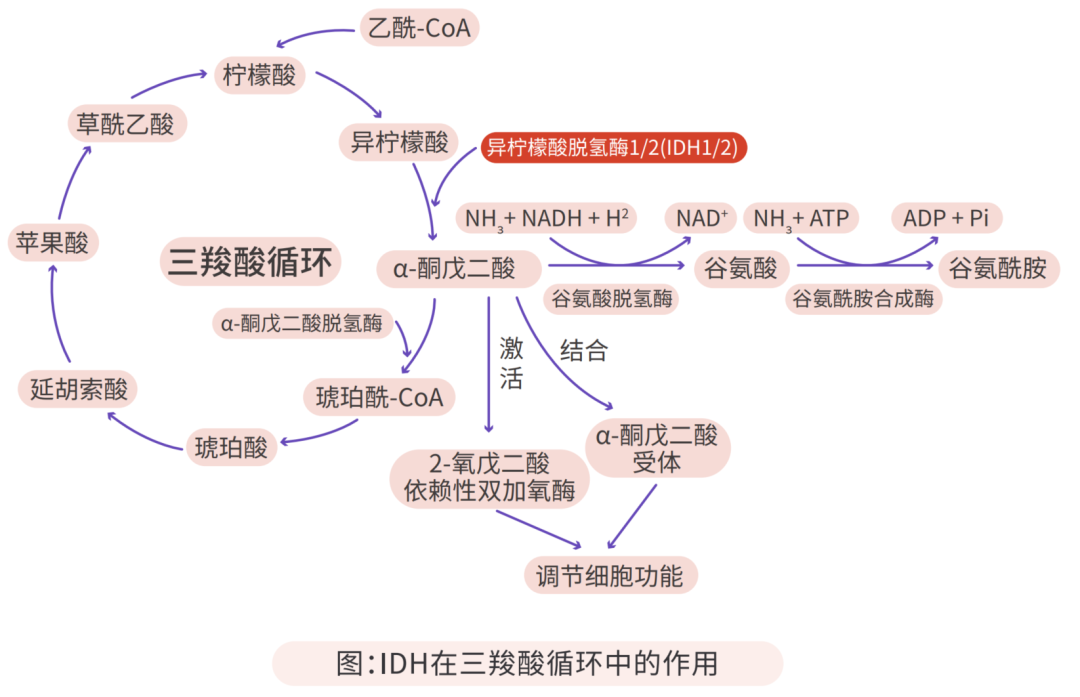
IDH是三羧酸循环中催化异柠檬酸(Isocitrate)氧化脱羧为α-酮戊二酸(α-KG)的代谢酶。哺乳动物组织中存在的三种IDH,IDH 1位于细胞质,而IDH2和IDH3位于线粒体。
三羧酸循环是需氧生物体内普遍存在的代谢途径,分布在线粒体,是糖类、脂类、氨基酸的最终代谢通路,也是糖类、脂类、氨基酸代谢联系的枢纽11。IDH是三羧酸循环的限速酶,能够催化异柠檬酸使之氧化脱羧生成 α-KG和CO2。
结构上,IDH1和IDH2是结构高度相似的同工异构酶,其在细胞内均以同源二聚体的形式存在,而IDH3是一个异源四聚体结构。
IDH1和IDH2是同源二聚体酶,每个二聚体包含2个活性位点。IDH1由2个大结构域、2个小结构域和1个clasp结构域组成,而IDH2包含1个额外的线粒体靶向序列12。
1.3 IDH突变的特性
IDH1和IDH2突变与肿瘤的发生和发展有密切的关系,但缺乏IDH3突变的相关报道13。
就具体突变位点而言,IDH1突变多发生在第132位的精氨酸残基,而IDH2突变则主要发生在R172、R140这两个位点(IDH3突变不常见)8。IDH突变是“功能获得型”突变14。在所有肿瘤中检测到的IDH突变,其类型大多数为杂合突变15。
2、IDH突变对癌症发生发展的调控机制
IDH突变酶作为多种癌症的重要代谢酶,被认为是癌症治疗的重要靶点。突变的IDH1通过影响代谢重编程、表观遗传学、肿瘤免疫微环境和肿瘤表型等方面来促进癌症的发生发展。
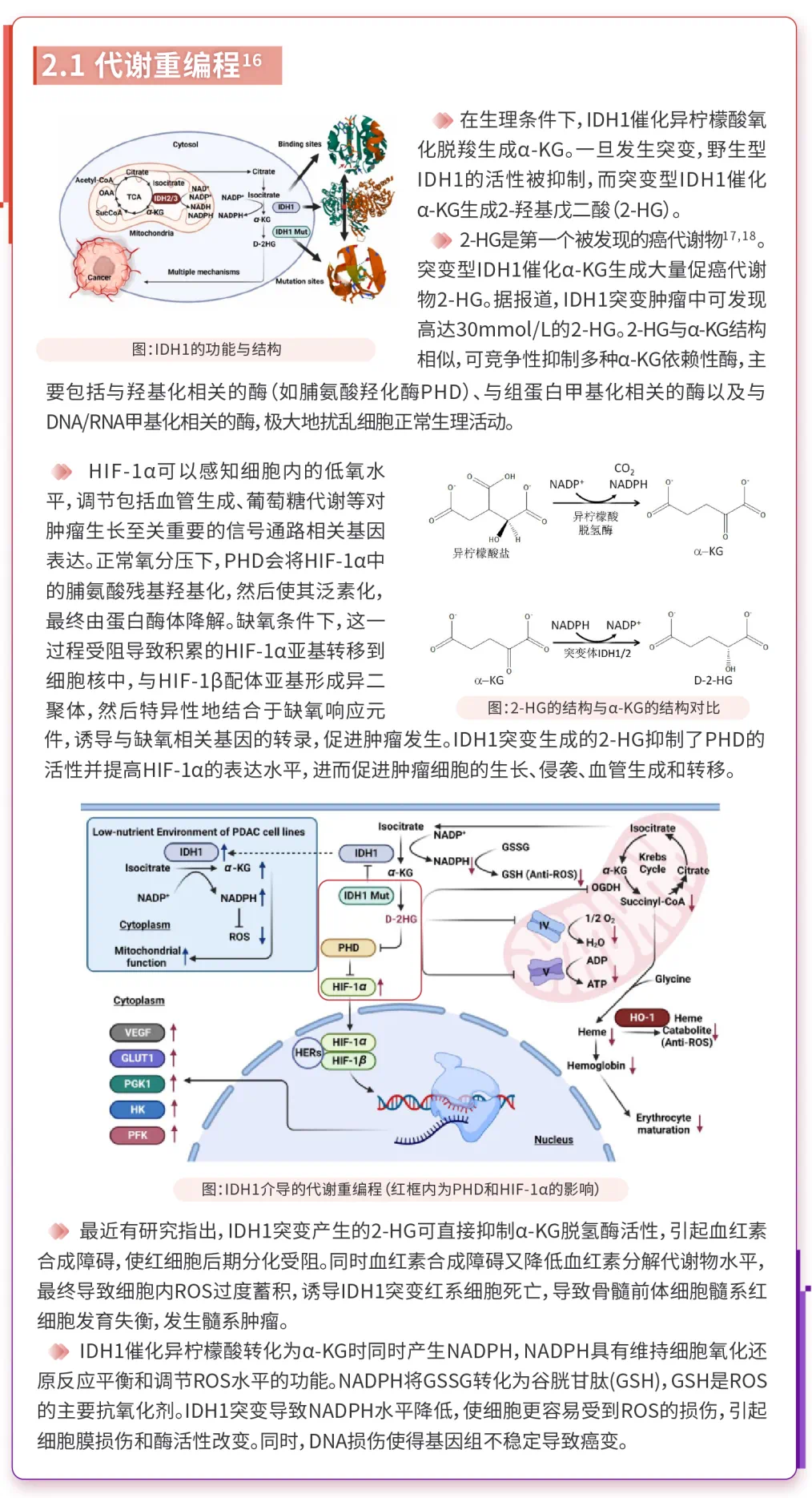
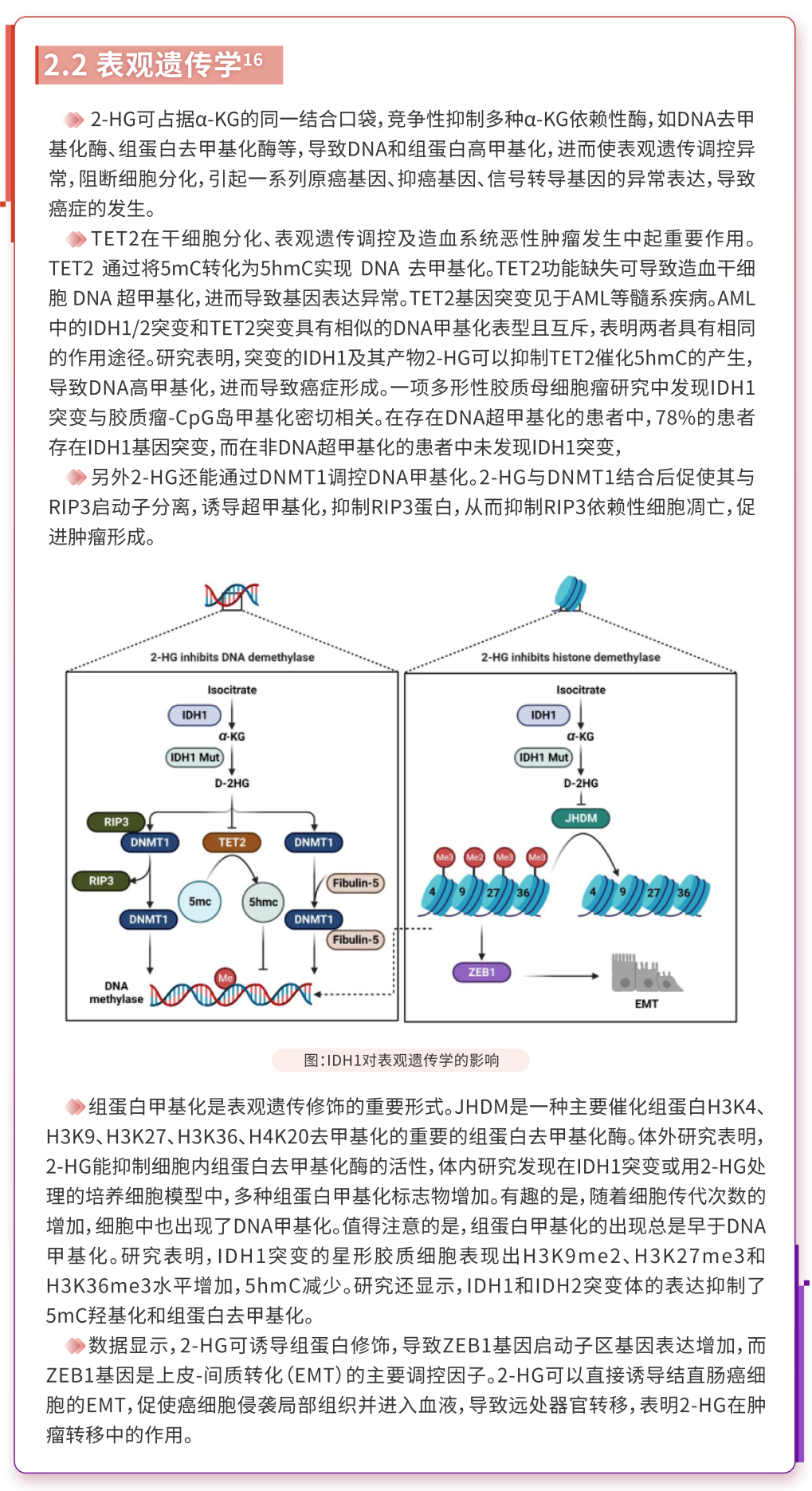
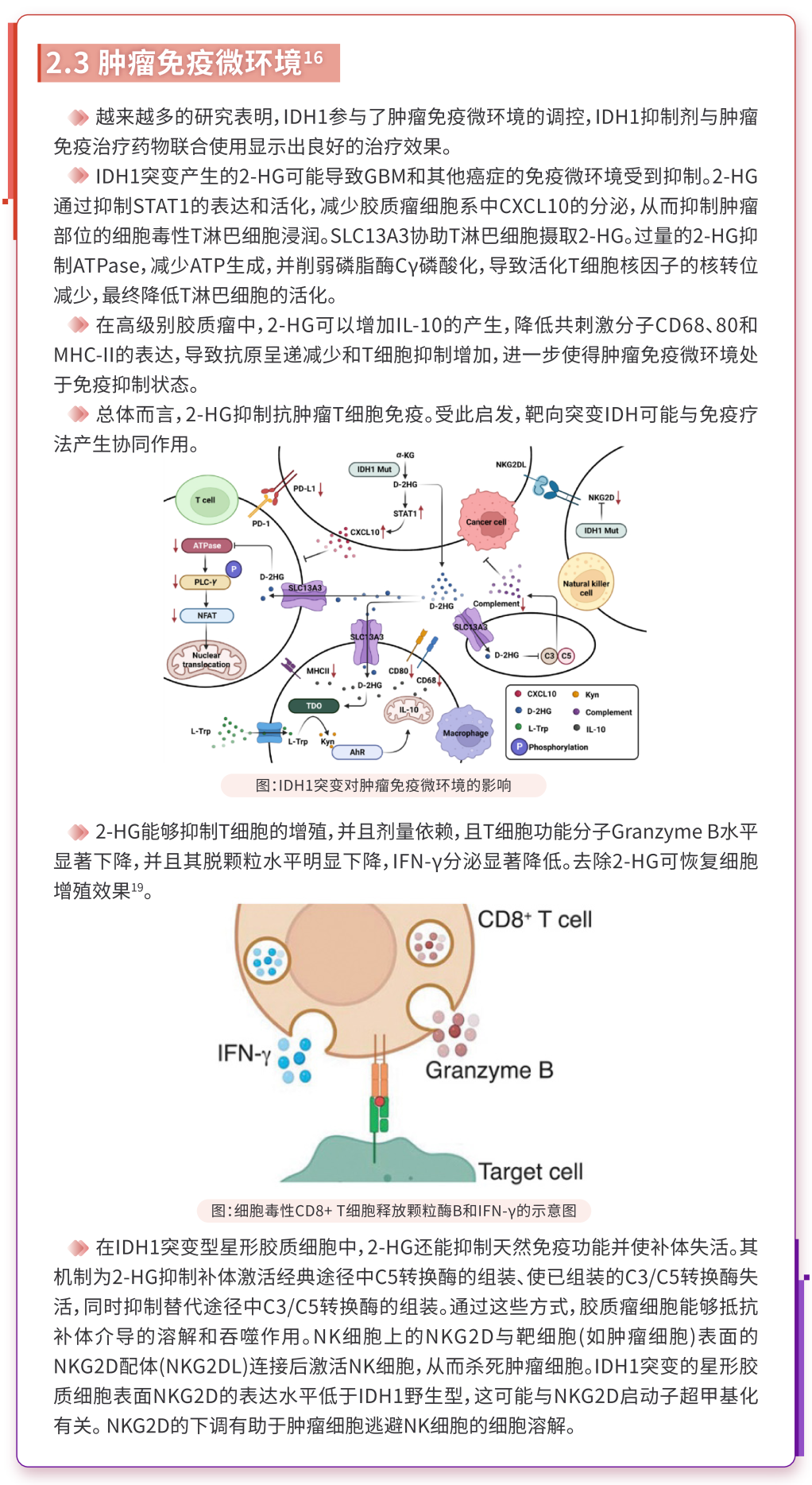
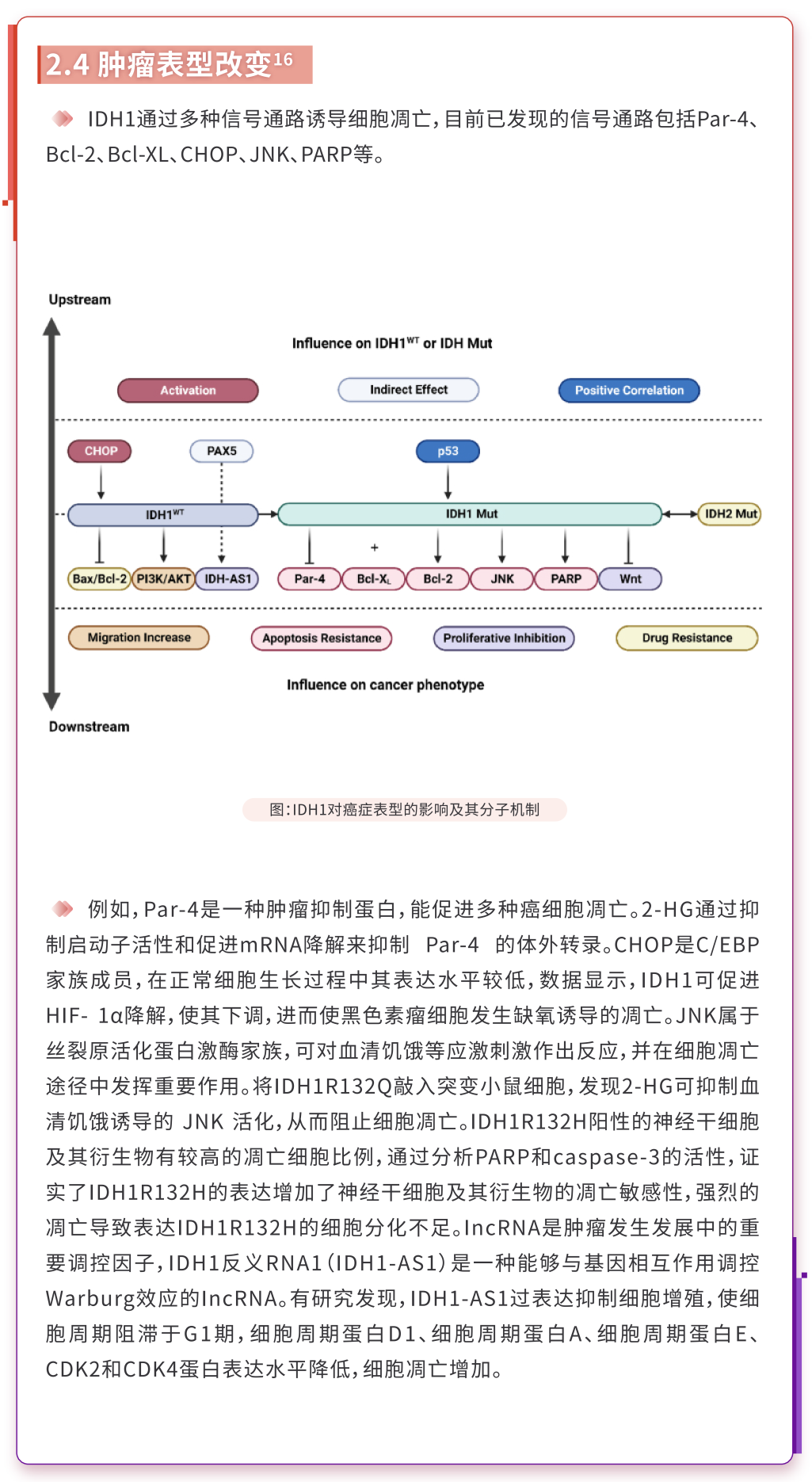
3、IDH1突变在AML中的意义
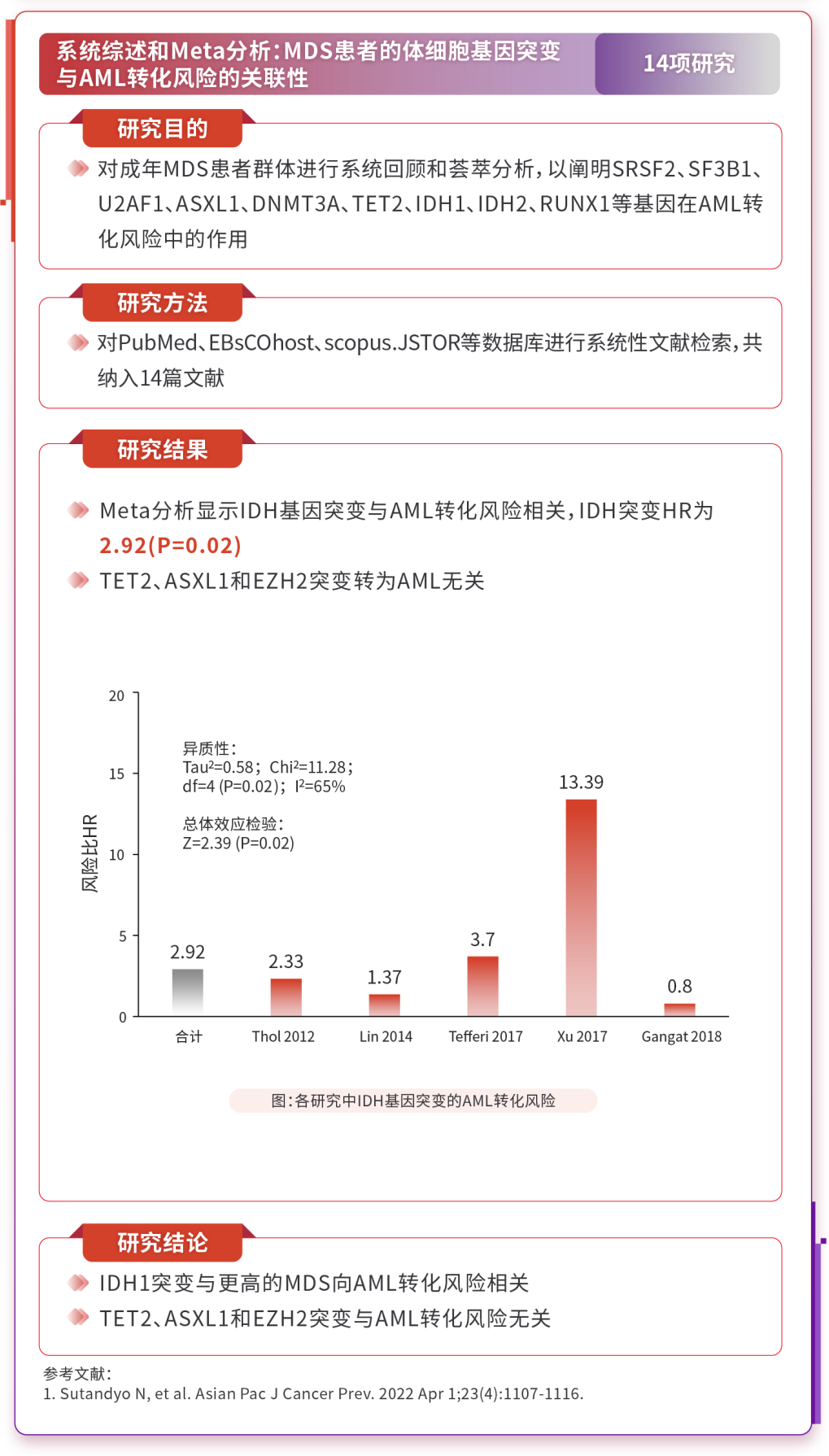
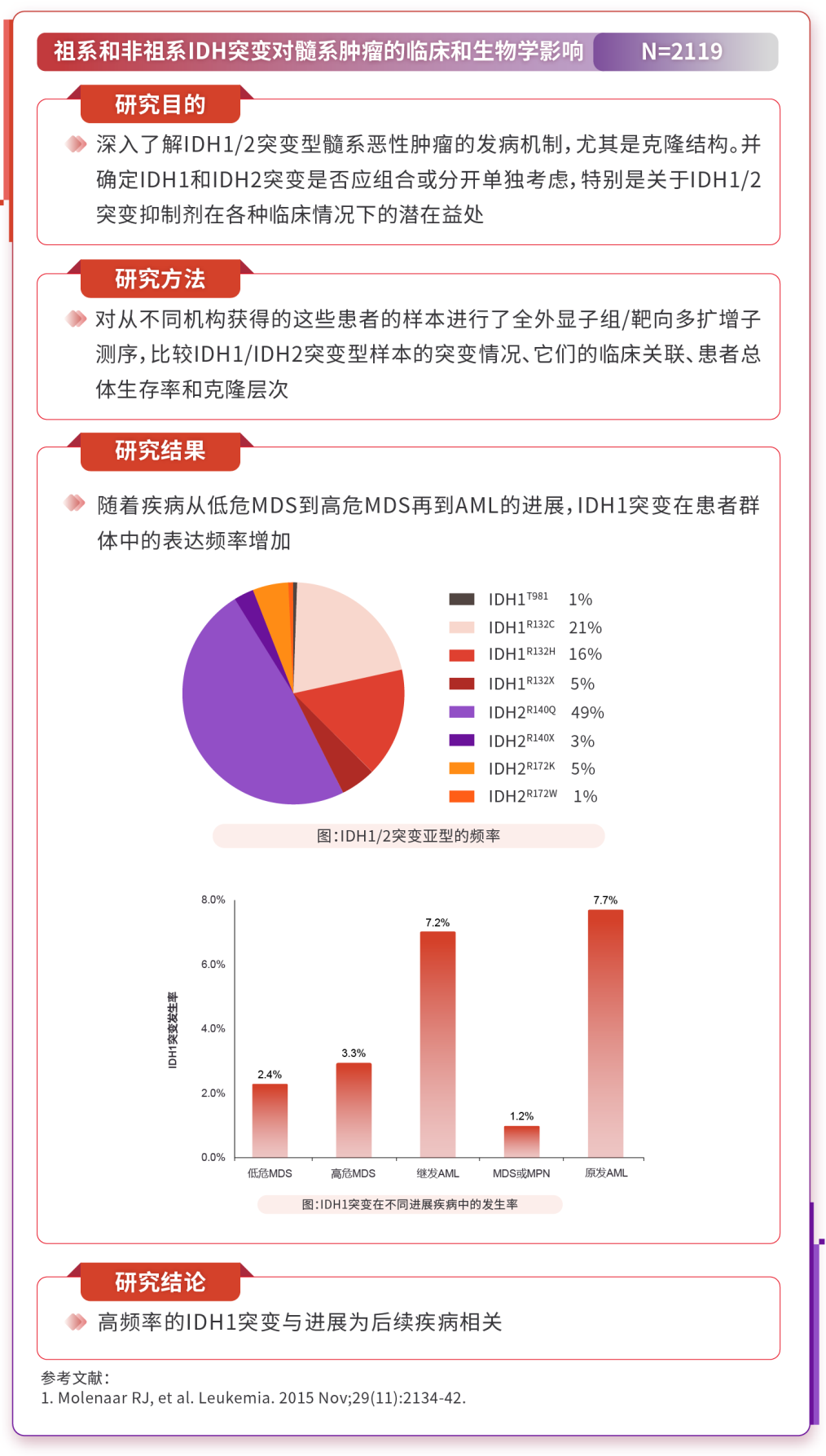
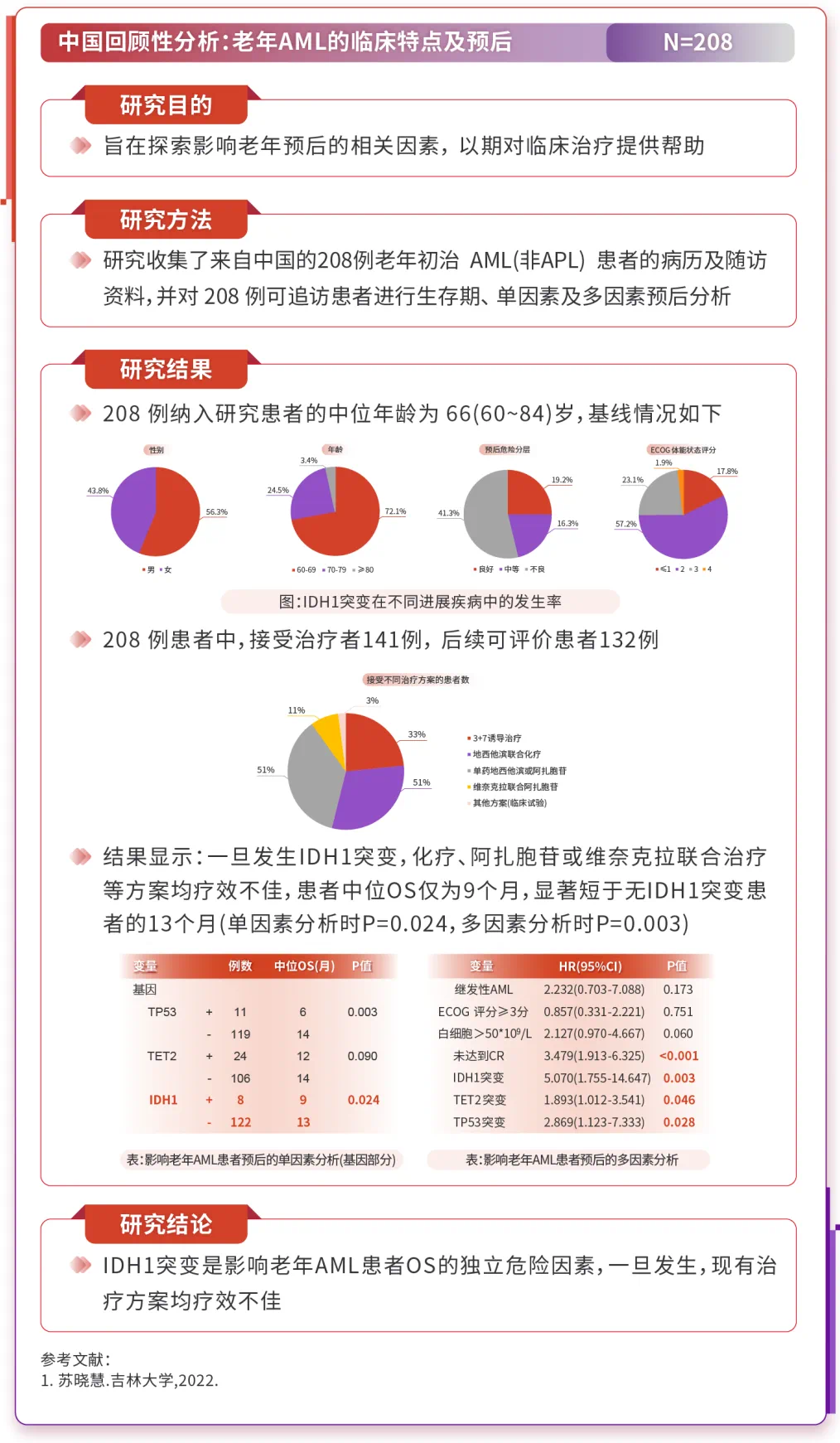
3.1 IDH1基因突变导致MDS转化为AML的风险增高
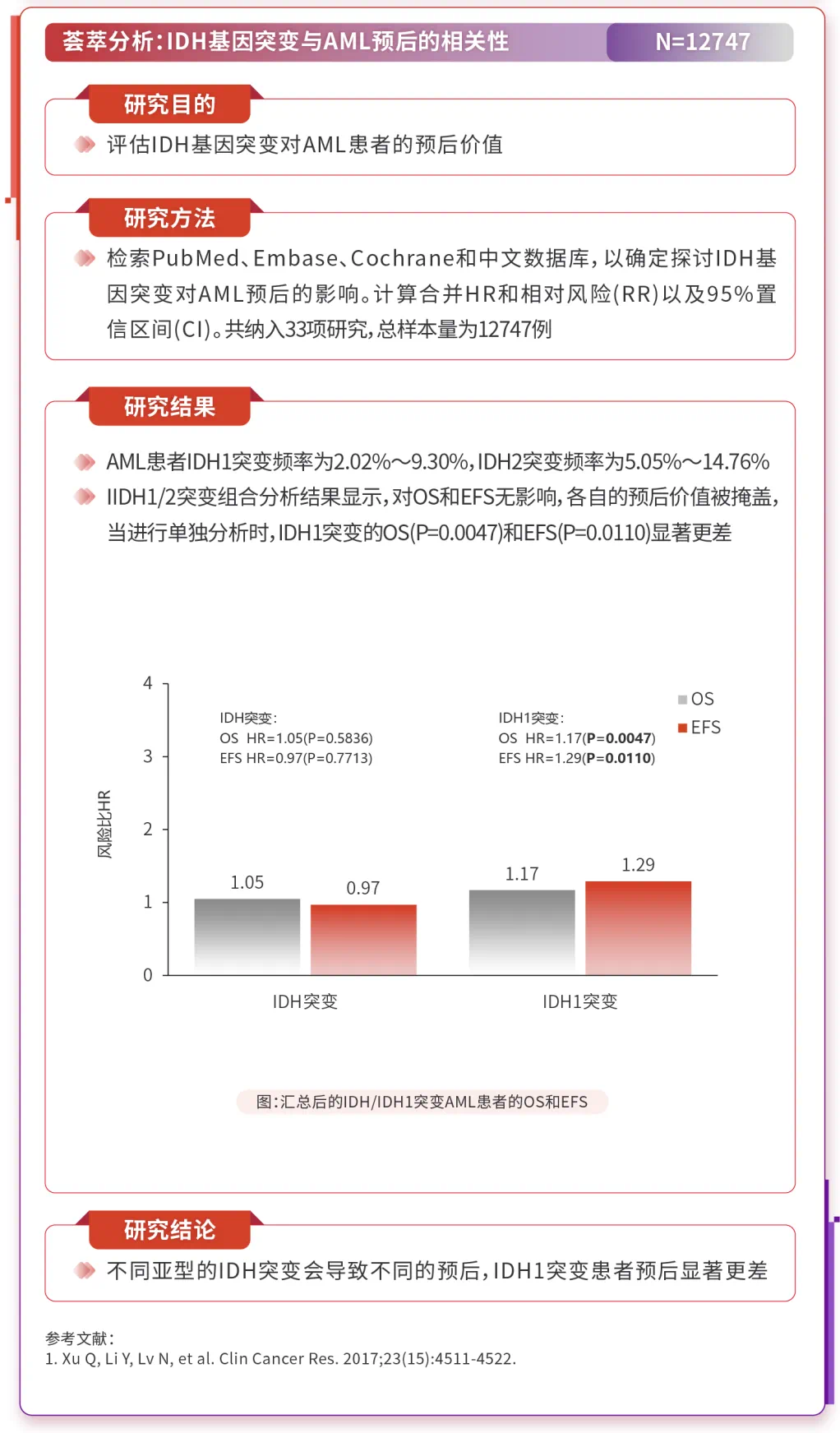
Meta分析显示20,DNMT3A和IDH基因突变与AML转化风险相关,IDH突变的风险比(HR)为2.92(p=0.02);而TET2、ASXL1和EZH2突变与AML转化无关。横断面分析显示21,IDH1和IDH2突变从低风险疾病到高风险疾病的发生率增高,提示它们在疾病进展中起作用。
3.2 高级别证据显示,IDH1突变对AML患者预后有负面影响
传统治疗模式下,AML中IDH突变对预后的影响尚存争议。多种因素可调节IDH突变对AML和MDS预后的影响,包括22-26:亚型(IDH1、IDH2),共突变(NPM1、DNMT3A、FLT3-ITD),患者年龄(<60岁、>60岁),特定位点(R132C、R132H、R172、R140),研究设计等
4、IDH1抑制剂
IDH抑制剂通过作用于肿瘤细胞中的IDH突变位点,将2-HG浓度降为正常水平,2-HG蓄积减少使得α-KG可以与α-KG依赖性酶结合,从而恢复恢复了α-KG依赖性酶对DNA和组蛋白的去甲基化功能,并允许参与分化的基因表达,抑制肿瘤生长。
根据作用靶点不同,可将IDH抑制剂分为IDH1抑制剂、IDH2抑制剂和IDH1/2抑制剂3种。
4.1 全球首个IDH1突变特异性药物艾伏尼布27,28
为了鉴定IDH1的小分子抑制剂,对R132H IDH1突变蛋白同源二聚体进行了高通量筛选(HTS)筛选后确认化合物1的活性符合要求。详细的动力学作用机制研究表明,化合物1的结合是可逆的,对α-KG具有竞争性,对NADPH没有竞争性。鉴于其化学结构和明确的抑制特性,选择该化合物作为进一步优化的起点。
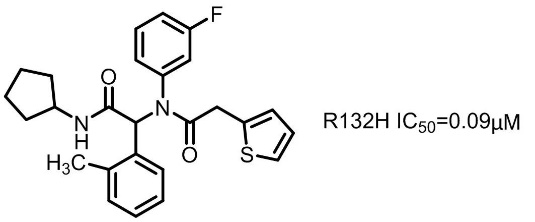
对化合物1的几个关键部位进行其他基团取代,研究其关键结构元件,最终优选出mIDH1-R132H高效抑制剂AGI-5198(R132H IC50=0.07μM)。
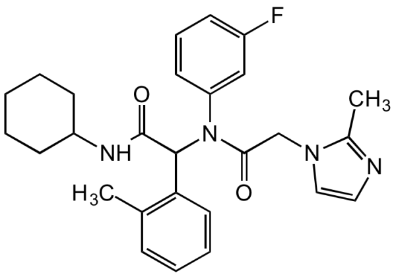
AGI-5198的体外动力学溶解度和肝微粒体分析表明,其理化性质合理,但跨物种代谢稳定性较差。因此需要继续对AGI-5198进行改善代谢性能的优化研究。
继续经过一系列旨在改善代谢清除率的药物化学优化步骤后,发现了在酶活水平和细胞水平具有个位数nM活性和代谢稳定性的化合物AGI-14100。
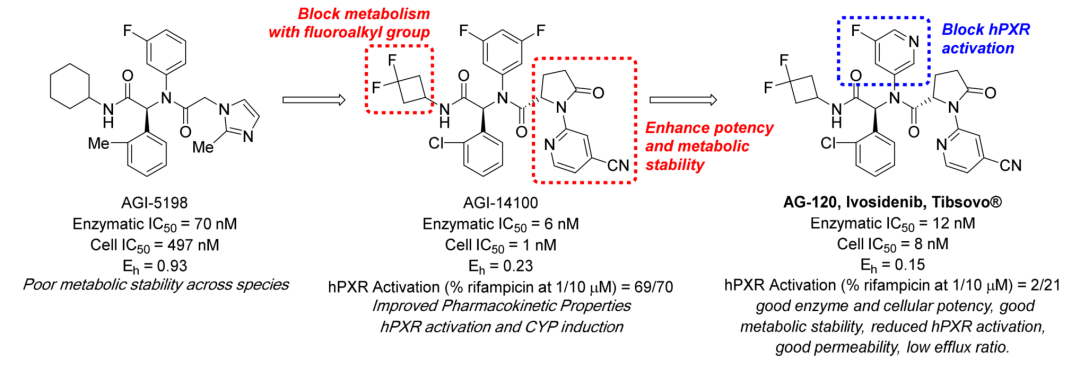
AGI-14100在多种物种(小鼠、大鼠、狗、食蟹猴、人)的微粒体孵育中显示低清除率,在大鼠、狗和食蟹猴中显示良好的体内清除率和口服药代动力学特性。但遗憾的是,AGI-14100在进行人孕烷X受体(hPXR)筛选试验评价时,发现其具有细胞色素P450(CYP)3A4诱导激活作用。于是需要继续对AGI-14100进行结构优化。
经过反复摸索和尝试后,最终得到了具有最佳成药性的化合物AG-120(艾伏尼布),其具有优异的酶活与细胞活性、良好的肝微粒体稳定性、可接受的hPXR激活活性、较高的透膜性以及较低的流出速率。同时,艾伏尼布对IDH1突变具有极高的选择性,对IDH2的野生型和突变型无抑制作用。在后续的体内及药效评价中,艾伏尼布均表现出了优异的活性和良好的安全性。
4.2 艾伏尼布的作用机制29,30
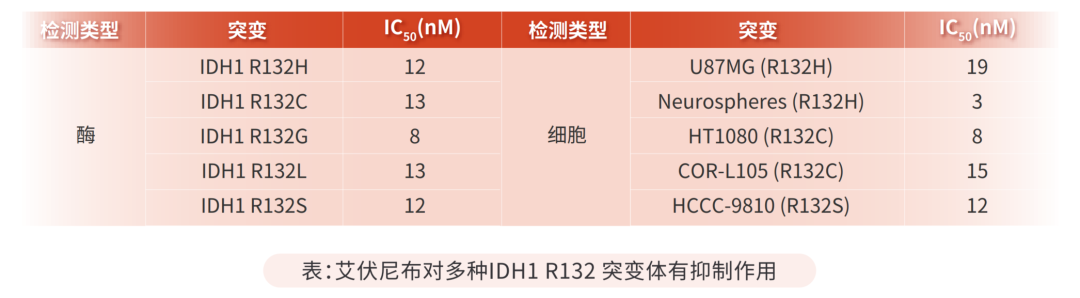
艾伏尼布是IDH1突变酶的抑制剂,是一种针对癌症代谢的新型疗法,可与各类型的IDH1突变体结合发挥作用。艾伏尼布与突变型IDH1结合可降低2-HG生成,改善由2-HG异常升高所引起的DNA和组蛋白的高甲基化状态,促进细胞的正常分化,恢复细胞的正常功能,并抑制白血病细胞的增殖。
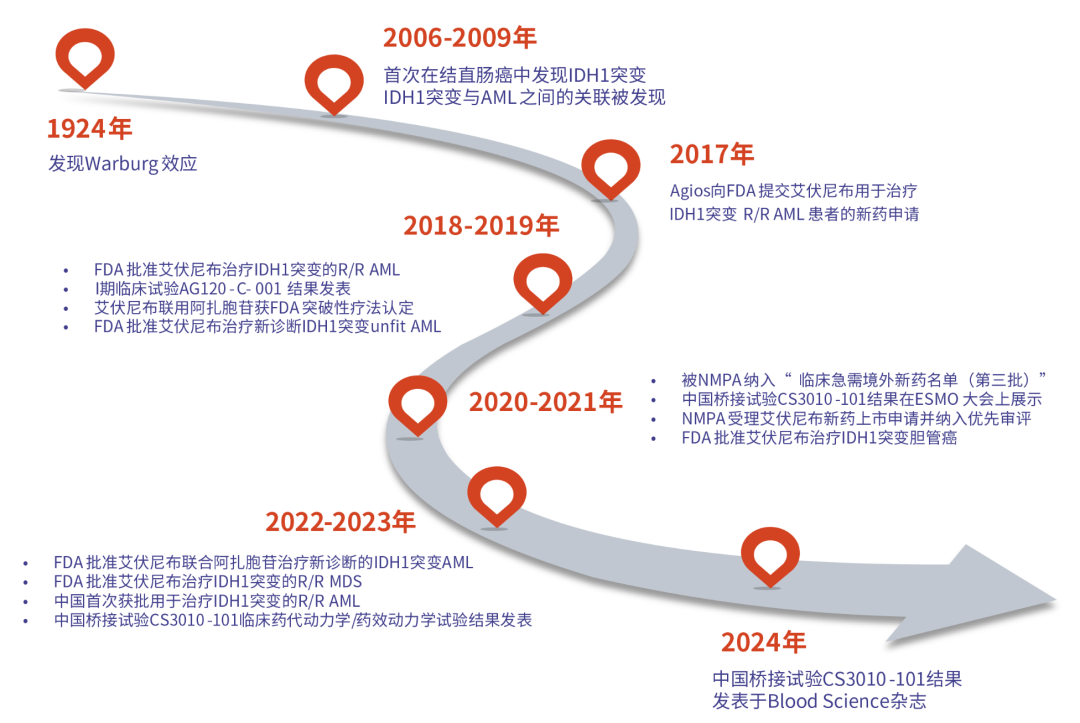
4.3 FDA, EMA和CDE适应症获批情况31-37
专家点评
“自上世纪70年代以来,所有改进传统药物疗法的尝试在AML治疗中均未取得理想效果。然而,自2017年首个AML靶向药物在美国上市以来,近年来用于AML治疗的选择大幅增加,我们欣喜地看到,长期停滞不前的AML治疗格局正在发生变化。对IDH1突变的研究可以被视为靶向药物研发的经典案例,从首次发现IDH1突变与AML的关联性至今,我们仅用了数十年时间,就明确了其不仅对代谢有影响,还涉及表观遗传,免疫微环境等等多种机制,并逐步理解了其对AML预后的负面影响。目前,IDH1抑制剂在全球多个国家可及,治疗推荐也被写入国内外主流指南,IDH1突变患者的生存期得到了改善。鉴往知来,随着靶向疗法、免疫疗法、细胞疗法等技术的发展和经验的积累,理想必将照进现实,我们终将迎来白血病的全面治愈时代”
专家简介
哈尔滨血液病肿瘤研究所所长
中国临床肿瘤学会(CSCO)监事会监事长
亚洲临床肿瘤学会副主任委员
中国临床肿瘤学会白血病专家委员会主任委员
国家卫生健康委能力建设与继续教育中心淋巴瘤
专科建设项目专家组组长
白血病·淋巴瘤杂志 总编辑
原中国临床肿瘤学会(CSCO)主任委员
原中华医学会血液学分会副主任委员
审批号:M-TIBSO-CN-202408-00014、M-TIBSO-CN-202408-00015
本内容仅供医疗卫生专业人士医学科学交流使用,不做药品推广。
医疗卫生专业人士在作出任何与治疗有关的决定时,应根据患者具体情况,参考药监局核准的药品说明书。
1. Zheng J. Oncol Lett. 2012 Dec;4(6):1151-1157.
2. Anderson NM, et al. Protein Cell. 2018 Feb;9(2):216-237.
3. Hanahan D, Weinberg RA. Cell. 2000 Jan 7;100(1):57-70.
4. Hanahan D, Weinberg RA. Cell. 2011 Mar 4;144(5):646-74.
5. Cancer Cell. 2010 Mar 16; 17(3): 225–234.
6. Yan H, et al. N Engl J Med. 2009 Feb 19;360(8):765-73.
7. Mardis ER, et al. N Engl J Med, 2009, 361(11): 1058-1066
8. Dang L, et al. Trends Mol Med. 2010 Sep;16(9):387-97.
9. Acta Pharm Sin B. 2023 Apr;13(4):1438-1466.
10. Blood. 2011 May 26; 117(21): e198–e206.
11. 魏晨等. 中国肿瘤临床,2021,48(21):1088-1092.
12. Waitkus, M.S., et al. Neuro Oncol. 2016; 18:16–26.
13. Dang L, et al. Trends Mol Med. 2010 Sep;16(9):387-97.
14. Yang H, et al. Clin Cancer Res. 2012 Oct 15;18(20):5562-71.
15. 蒋健等. 磁共振成像,2021,12(05):103-106.
16. Liu Y, et al. Acta Pharm Sin B. 2023 Apr;13(4):1438-1466.
17. Wishart DS. BioMedicine. 2015 May 23;2(6):478-9.
18. Dang L, et al. Nature. 2009 Dec 10;462(7274):739-44.
19. Notarangelo G, et al. Science. 2022 Sep 30;377(6614):1519-1529.
20. Sutandyo N, et al. Asian Pac J Cancer Prev. 2022 Apr 1;23(4):1107-1116
21. Molenaar RJ, et al. Leukemia. 2015 Nov;29(11):2134-42.
22. Xu Q, Li Y, Lv N, et al. Clin Cancer Res. 2017;23(15):4511-4522.
23. NCCN Guidelines for Acute Myeloid Leukemia V.3.2024
24. Lachowiez CA, et al. Am J Hematol. 2022;97(11):1443-1452.
25. Duchmann M, et al. Blood. 2021;137(20):2827-2837.
26. Zarnegar-Lumley S, et al. Blood Adv. 2023 Oct 10;7(19):5941-5953.
27. Altman RA, et al. ACS Med Chem Lett. 2022 Feb 3;13(4):540-545.
28. Popovici-Muller J, et al ACS Med Chem Lett. 2018 Jan 19;9(4):300-305.
29. Pirozzi, et al. Nature Reviews Clinical Oncology. 2021 Oct;18:645-661.
30. Losman JA Kaelin WG.Jr.Genes Dev.2013:27:836-852.
31. Mardis ER, et al. N Engl J Med. 2009 Sep 10;361(11):1058-66.
32. DiNardo CD, et al. N Engl J Med.2018;378(25):2386-2398
33. Yue Z, et al. Eur J Clin Pharmacol.2024:80(1):105-113
34. Sun M, et al. Blood Sci. 2024 Jun 20;6(3):e00196.
35. https://www.drugs.com/history/tibsovo.html
36. https://mma.prnewswire.com/media/2074010/Servier_Tibsovo_EC_Approval.pdf
37. https://www.fda.gov
排版编辑:肿瘤资讯-展思懿











 苏公网安备32059002004080号
苏公网安备32059002004080号


