新年伊始,寒意犹存,科研探索的脚步从未停歇。本期汇集了NEJM、Blood、Leukemia等顶级期刊的精彩研究,从双特异性抗体联合治疗到前白血病微环境的深入探索,让我们一起领略这些前沿突破与创新成果。
NEJM
Talquetamab plus Teclistamab in Relapsed or Refractory Multiple Myeloma
Talquetamab联合特立妥单抗治疗复发或难治性多发性骨髓瘤
已经接受过免疫调节剂、蛋白酶体抑制剂和抗CD38治疗(即三类药物治疗)的复发或难治性多发性骨髓瘤(RRMM)患者预后较差。尽管嵌合抗原受体T细胞(CAR-T)和双特异性抗体疗法已获批,但MM仍无法治愈。特立妥单抗是一种靶向BCMA的T细胞重定向双特异性抗体,Talquetamab是一种靶向GPRC5D的T细胞重定向双特异性抗体。基于此,研究者开展了一项1b-2期研究,评估两种药物联合用于治疗RRMM的安全性和有效性。
研究共纳入94例患者,其中44例接受推荐的2期方案治疗(Talquetamab 0.8 mg/kg + 特立妥单抗 3.0 mg/kg,每两周一次)。中位随访20.3个月。最常见的不良反应包括细胞因子释放综合征、中性粒细胞减少、味觉改变和非皮疹皮肤事件。96%的患者出现3-4级不良反应,主要是血液学事件。64%的患者出现3-4级感染。在推荐的2期方案中,80%的患者达到缓解(包括61%的髓外病变患者);在所有剂量组中,78%的患者达到缓解。在推荐的2期方案中,18个月时86%的患者持续保持缓解(髓外病变患者为82%),所有剂量组中为77%。
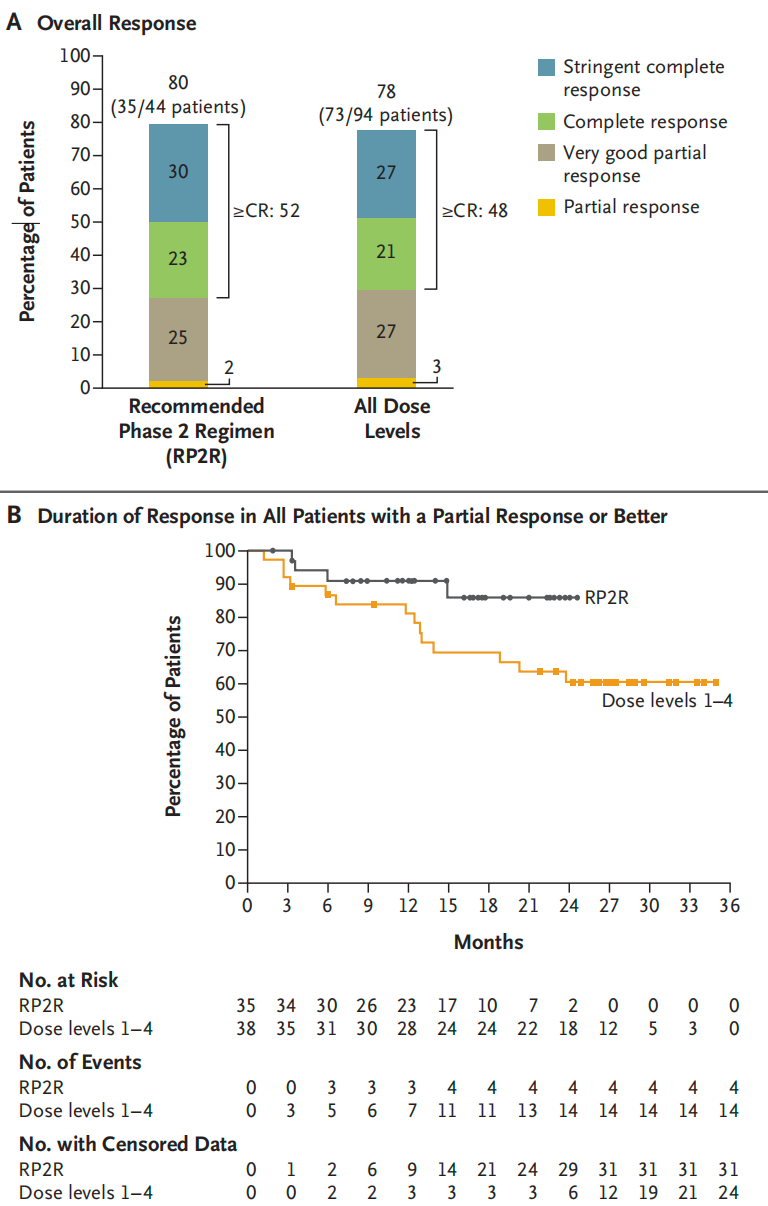
结论:与单药治疗相比,Talquetamab联合特立妥单抗的3~4级感染发生率更高。在所有剂量组中都观察到较高的缓解率,且在推荐的2期方案中缓解持久。这种靶向双抗原的治疗策略值得进一步研究。
Blood
Daratumumab with lenalidomide as maintenance after transplant in newly diagnosed multiple myeloma: the AURIGA study
达雷妥尤单抗联合来那度胺用于新诊断多发性骨髓瘤患者移植后的维持治疗:AURIGA研究
目前,来那度胺(R)维持治疗被认为是移植适合的新诊断MM(NDMM)患者的标准治疗。然而,大多数患者最终会复发,因此需要优化维持治疗策略以改善长期预后。达雷妥尤单抗是一种靶向CD38的单克隆抗体,已被批准用于MM的治疗。Badros等人开展了一项3期AURIGA研究,评估达雷妥尤单抗联合来那度胺(D-R)维持治疗与标准的来那度胺(R)单药维持治疗的对比。
研究纳入200例移植后获得≥非常好的部分缓解(≥VGPR)、MRD阳性(10-5)且未使用过抗CD38治疗的NDMM患者,按1:1随机分配接受D-R(n=99)或R(n=101)维持治疗,最长36个疗程。结果显示,从维持治疗开始12个月时MRD转阴率(主要终点)在D-R组显著高于R组(50.5% vs 18.8%; 比值比4.51; P<0.0001)。MRD(10-6)转阴率也显示相似趋势(23.2% vs 5.0%; P=0.0002)。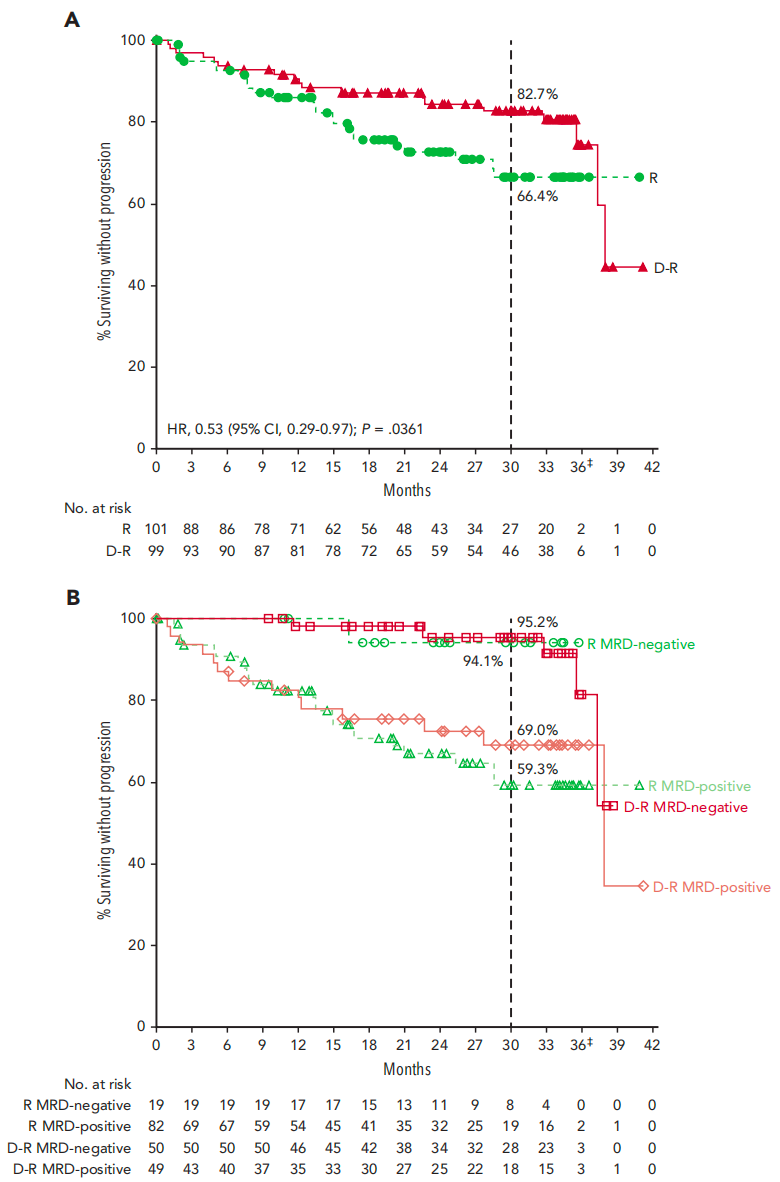
中位随访32.3个月时,D-R组的总体MRD转阴率(60.6% vs 27.7%)和完全缓解(CR)率(75.8% vs 61.4%)均优于R组。无进展生存期(PFS)也显示D-R组获益(风险比0.53),预估的30个月PFS率分别为82.7%和66.4%。D-R组3/4级血细胞减少(54.2% vs 46.9%)和感染(18.8% vs 13.3%)发生率略高,但未出现新的安全性问题。
结论:对于移植后MRD阳性的NDMM患者,达雷妥尤单抗联合来那度胺维持治疗可显著提高MRD转阴率并改善无进展生存期,安全性可控。
Leukemia
Cellular taxonomy of the preleukemic bone marrow niche of acute myeloid leukemia
急性髓系白血病前白血病骨髓微环境的细胞分类学研究
急性髓系白血病(AML)是一种克隆性恶性血液疾病,其发病与造血干/祖细胞中的反复克隆突变有关,这些突变会导致骨髓微环境发生深刻变化,使白血病干细胞的生长优于正常造血干细胞。了解前白血病突变的造血干/祖细胞与骨髓微环境之间的相互作用对开发预防白血病发生的新治疗策略至关重要。研究团队假设前白血病干细胞会诱导骨髓微环境发生对白血病发生至关重要的改变。他们使用AML小鼠模型,对前白血病骨髓微环境细胞进行了单细胞RNA测序。
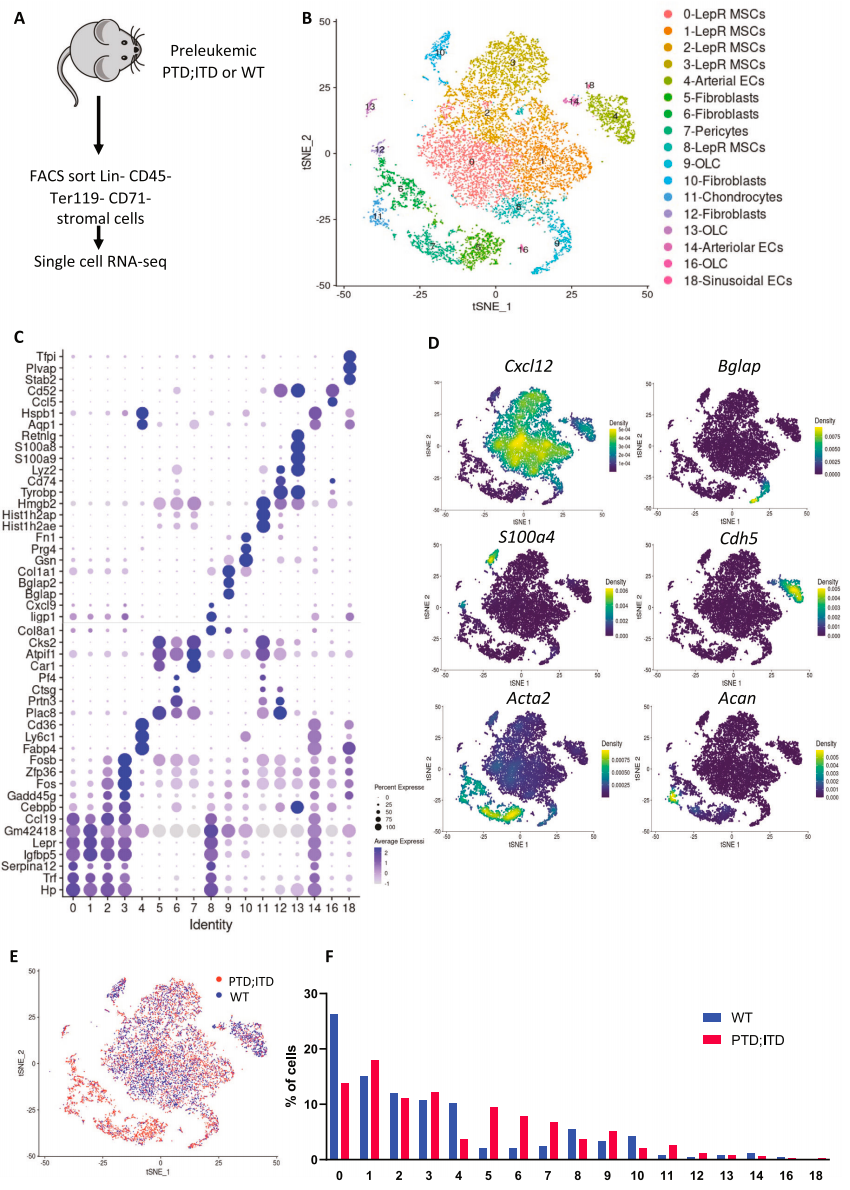
研究发现,调节正常造血干细胞的LepR+间充质干细胞和内皮细胞数量减少,同时CD55+成纤维细胞和周细胞数量增加。前白血病CD55+成纤维细胞具有更高的增殖率和降低的胶原表达,提示在白血病发生过程中发生细胞外基质重塑。重要的是,共培养实验发现前白血病CD55+成纤维细胞显著促进前白血病干细胞而非正常造血干细胞的扩增。
研究结论:该研究鉴定了一个独特的前白血病骨髓微环境,以及一种在前白血病骨髓微环境中扩增的新型CD55+成纤维细胞群,这种细胞群能够促进前白血病干细胞相对于正常造血干细胞的适应性生长。这些发现为理解白血病发生的早期阶段提供了新的见解,可能有助于开发预防白血病的新策略。
The Lancet Haematology
Tranexamic acid versus placebo to prevent bleeding in patients with haematological malignancies and severe thrombocytopenia (TREATT): a randomised, double-blind, parallel, phase 3 superiority trial
氨甲环酸对比安慰剂预防血液系统恶性肿瘤伴重度血小板减少患者出血的研究(TREATT):一项随机、双盲、平行、III期优效性试验
在血液系统恶性肿瘤患者中,出血是一个常见并发症。虽然预防性血小板输注是常规治疗手段,但其有效性尚不明确,且所有评估不同血小板输注策略的临床试验都显示即使进行预防性输注,出血发生率仍然很高。为此,研究者开展了这项国际性、随机、双盲、平行对照的III期优效性试验,在澳大利亚和英国的27个血液病中心进行。研究纳入了接受强化化疗或造血干细胞移植的成年血液系统恶性肿瘤患者,这些患者预计会出现血小板计数≤10×109/L且持续5天以上。患者按1:1比例随机分配接受氨甲环酸(静脉给药每8小时1g或口服每8小时1.5g)或安慰剂治疗。
研究共筛查1736例患者,最终616例患者入组并随机分配(氨甲环酸组310例,安慰剂组306例)。主要终点结果显示,氨甲环酸组30天内死亡或发生WHO 2级及以上出血的患者比例为31.7%(90/298),安慰剂组为34.2%(98/295),两组差异无统计学意义(HR 0.92,95%CI 0.67-1.27;P=0.62)。在血栓事件和静脉闭塞性疾病方面两组无差异。治疗60天内,氨甲环酸组77例患者报告了94起严重不良事件,安慰剂组82例患者报告了103起。
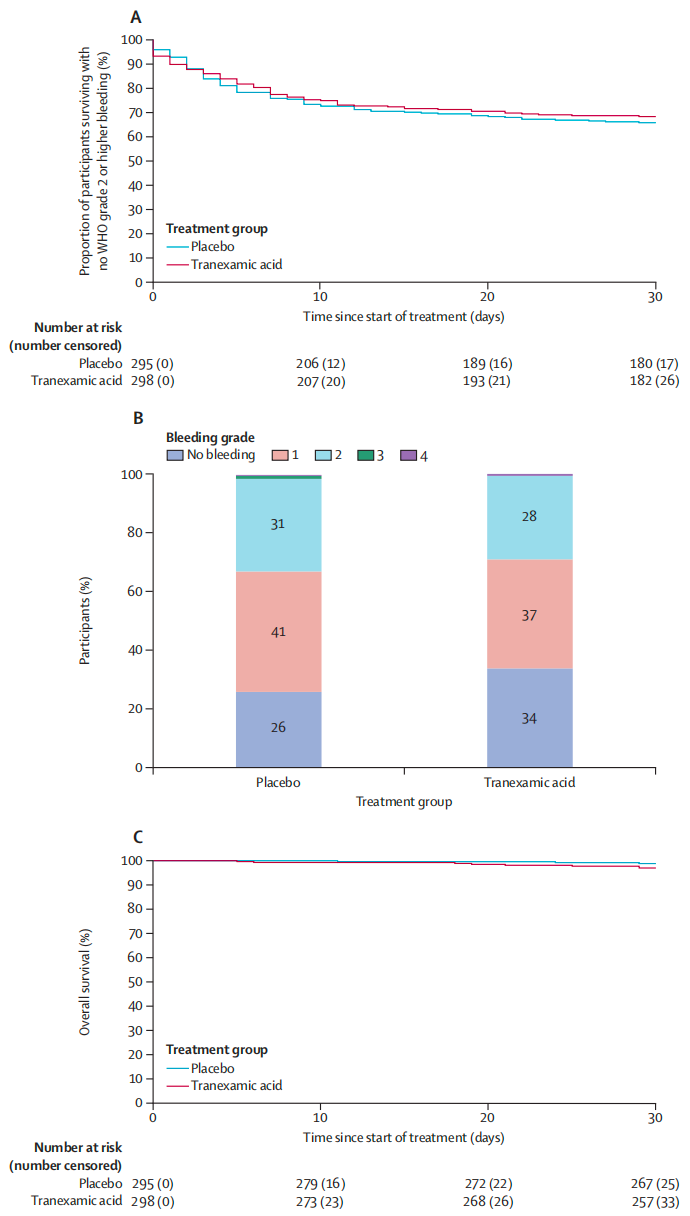 图4:按治疗分组的死亡或WHO 2级及以上出血情况和最高出血等级
图4:按治疗分组的死亡或WHO 2级及以上出血情况和最高出血等级
结论:研究表明,对于接受强化治疗的血液系统恶性肿瘤患者,常规使用氨甲环酸减少出血的证据不足。
Haematologica
Hematopoietic cell transplantation for older acute myeloid leukemia patients in first complete remission: results of a randomized phase III study
老年急性髓系白血病患者第一次完全缓解期异基因造血干细胞移植的随机对照III期研究结果
老年AML患者的预后较差,虽然支持治疗的进步提高了可能从潜在治愈性治疗中获益的患者比例,但是通过增加治疗强度来改善无白血病生存期的尝试大多因为极高的复发率(>80%)而未能成功。异基因造血干细胞移植(allo-HCT)已被证明具有很强的抗白血病效果。Niederwieser等开展了一项前瞻性随机对照研究,评估60~75岁获得首次CR的AML患者接受allo-HCT或常规巩固化疗的疗效
2010~2017年间共纳入245例中位年龄67岁的患者。在一个疗程巩固治疗后,26.9%的患者未能满足入组标准。在研究中的179例(73%)患者中,75.4%找到了HLA相合供者。排除10例不合适患者后,125例患者被随机分配到allo-HCT组(83例)或非HCT组(42例)。
主要终点5年限制性平均无白血病生存期(RM-LFS)在allo-HCT组为24.5个月(95%CI:18.9-30.1),非allo-HCT组为15.6个月(95%CI:10.4-20.8) (P=0.022),这主要归因于累积复发率从非allo-HCT组的91.1%降至allo-HCT组的37.8% (P<0.0001)。次要终点5年限制性平均总生存期(RM-OS)在allo-HCT组为27.8个月,非allo-HCT组为28.6个月;allo-HCT组5年非复发死亡率为33.4%,allo-HCT组为0%。
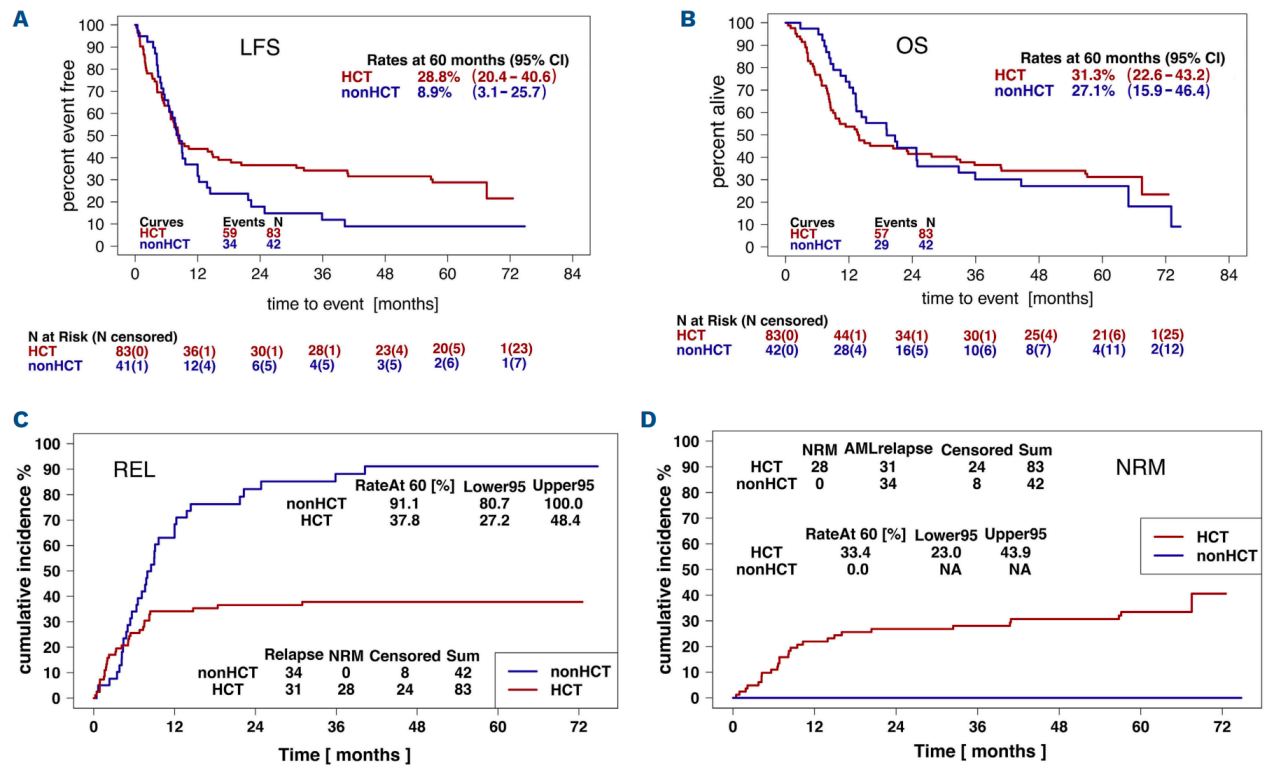 图5. 根据意向治疗原则分析异基因造血干细胞移植(HCT)或非HCT的结果
图5. 根据意向治疗原则分析异基因造血干细胞移植(HCT)或非HCT的结果
研究结论:对于首次CR的老年AML患者,allo-HCT可提供更好的5年RM-LFS,但这种长期获益并未转化为研究期间更好的RM-OS。
[1] Cohen YC, Magen H, Gatt M, et al. Talquetamab plus Teclistamab in Relapsed or Refractory Multiple Myeloma. N Engl J Med. 2025;392(2):138-149. doi:10.1056/NEJMoa2406536
[2] Badros A, Foster L, Anderson LD Jr, et al. Daratumumab with lenalidomide as maintenance after transplant in newly diagnosed multiple myeloma: the AURIGA study. Blood. 2025;145(3):300-310. doi:10.1182/blood.2024025746
[3] Goda C, Kulkarni R, Bustos Y, et al. Cellular taxonomy of the preleukemic bone marrow niche of acute myeloid leukemia. Leukemia. 2025;39(1):51-63. doi:10.1038/s41375-024-02415-3
[4] TREATT Trial Investigators. Tranexamic acid versus placebo to prevent bleeding in patients with haematological malignancies and severe thrombocytopenia (TREATT): a randomised, double-blind, parallel, phase 3 superiority trial. Lancet Haematol. 2025;12(1):e14-e22. doi:10.1016/S2352-3026(24)00317-X
[5] Niederwieser D, Hasenclever D, Berdel WE, et al. Hematopoietic cell transplantation for older acute myeloid leukemia patients in first complete remission: results of a randomized phase III study. Haematologica. 2025;110(1):68-77. Published 2025 Jan 1. doi:10.3324/haematol.2024.285879
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


