前言:胆管癌5年生存率不足10%[1],手术仍是目前的主要治疗方案,但术后5年复发率高达60%~70%[2,3]。约60~70%胆管癌患者诊断时已为晚期,不适合接受手术治疗[4],使得胆管癌的治疗举步维艰[5]。近年来,分子检测技术的高度发展、新型药物及治疗策略的不断问世,给胆管癌治疗带来转机。精准检测在肿瘤诊断、治疗及耐药等方面发挥着重要作用,以基因检测为指导的靶向药物治疗取得了一定的疗效,为胆管癌患者带来了治疗新选择[6]。胆管癌治疗模式的转变及更多分子突变的发掘,引起广泛临床关注。
在此,本期特邀北京大学第一医院肝胆胰外科田孝东教授对近期发表的胆管癌基因检测及靶向治疗相关文献进行深入解读,以剖析胆管癌领域的靶向诊疗的最新进展。
专家简介
医学博士、主任医师、教授、博士研究生导师
擅长肝胆胰腺良恶性肿瘤的微创(机器人)手术治疗和综合治疗
Journal of Pancreatology、中华实验外科杂、肝癌电子杂志编委
中华外科杂志、中华消化外科杂志、中华肝胆外科杂志通讯编委
中华医学会外科学分会青年委员会委员
中国临床肿瘤学会(CSCO)胰腺癌专家委员会委员
中国研究型医院学会加速康复外科专业委员会委员
中国研究型医院学会消化道肿瘤专业委员会委员
中国研究型医院学会胰腺疾病专业委员会青年委员会副主任委员
中国医师协会外科医师分会加速康复外科专家委员会委员
中国医师协会外科医师分会胆道外科青年委员会副主任委员
中国研究型医院学会老年外科专业委员会委员兼副秘书长
中国医疗保健国际交流促进会肿瘤免疫治疗学分会常委
中国医疗保健国际交流促进会腔镜内镜外科学分会委员
胆管癌精准检测,助力靶向治疗选择
Comprehensive Immunogenomic Profiling of IDH1-/ 2-Altered Cholangiocarcinoma. Shalini Makawita, et al. JCO Precis Onco 2024 Mar. IF=4.6
尽管约20%肝内胆管癌(iCCA)患者存在异柠檬酸脱氢酶(IDH)1/2基因组改变(GA),但关于IDH1-/2-突变型iCCA免疫基因组的表达情况仍未明确。一篇综述[7]对3067例晚期iCCA患者进行全面基因组测序分析(CGP),并回顾性收集501例胆管癌(CCA)患者的临床资料,在分子、蛋白及患者结局多个数据集水平探索IDH1-/2-改变与IDH野生型(IDHwt)CCA基因组免疫微环境间的差异,并对IDH1/2+与IDHwt患者中位总生存期(mOS)间的差异进行分析。
研究结果显示,在接受CGP检测的3067例iCCA病例中,14%为IDH1+,4%为IDH2+。69%的IDH1 GA发生在R132C,在IDH2 GA中94.4%发生在R172K。尽管共突变模式不同,IDH1+与IDHwt iCCA中位基因组杂合性缺失(gLOH)也未存在显著差异(P=0.37)。与IDHwt iCCA相比,在IDH1/2+中,高微卫星不稳定性(MSI-high)、TMB≥10 mut/Mb和PD-L1表达阳性的病例较少。在非IDH1突变患者中,NK细胞群、CD70和程序性细胞死亡受体1(PD-1)表达水平显著升高,而在IDH1+患者中VTCN1(B7-H4)显著升高。
IDH1/2+和IDHwt iCCA患者在基因组改变及免疫标志物方面存在显著差异,IDH1-/2-突变多见于无gLOH的冷肿瘤。由精准检测获得的免疫基因组数据可为进一步精准靶向IDH突变型iCCA治疗提供依据。
生物标志物可监测IDH靶向治疗疗效
Circulating Oncometabolite 2-hydroxyglutarate as a Potential Biomarker for Isocitrate Dehydrogenase (IDH1/2) Mutant Cholangiocarcinoma. Lee CL, et al. Mol Cancer Ther 2024 Mar 4. IF=6.3
异柠檬酸脱氢酶(IDH)可催化异柠檬酸脱羧生成α-酮戊二酸(aKG),而IDH1/2突变倾向于将aKG转化为R-2-羟基戊二酸(R2HG),导致肿瘤组织中R2HG的积累,故循环2-羟基戊二酸(2HG)或可作为IDH突变型(IDHmt)胆管癌(CCA)患者的潜在生物标志物。一项队列研究[8]分析了IDHmt胶质瘤和CCA患者血液及肿瘤组织中的R2HG、S-2-羟基戊二酸(S2HG)水平。
结果显示,IDHmt胶质瘤患者肿瘤组织中R2HG/S2HGr值(rRS)显著升高,但循环rRS水平未见上升,而IDHmt CCA患者循环rRS水平显著升高。IDHmt和野生型(IDHwt)CCA患者的循环R2HG和总2HG分布重叠,而IDHmt和IDHwt CCA患者间的rRS值几乎无重叠。在rRS截断值设定为1.5的情况下,rRS的敏感性为90%,特异性为96.8%。
IDHmt CCA患者的循环rRS水平显著高于IDHwt CCA患者,可作为IDH1/2突变型CCA患者敏感性及特异性较高的替代生物标志物,有潜力成为监测IDH靶向治疗的工具。
精准检测有望破译靶向治疗耐药机制
Landscape of Clinical Resistance Mechanisms to FGFR Inhibitors in FGFR2-Altered Cholangiocarcinoma. Qibiao Wu, et al. Clin Cancer Res 2024 Jan. IF=11.5
FGFR抑制剂治疗FGFR2突变型胆管癌效果显著,佩米替尼、英菲格拉替尼及不可逆抑制剂福巴替尼已获批用于FGFR2突变型胆管癌患者治疗。然而,耐药性的产生限制了此类药物的临床效果,目前包括继发性FGFR2激酶结构域突变在内的部分耐药机制已被揭示。一项研究[9]对12篇已发表报告中接受FGFR抑制剂治疗后疾病进展的82例FGFR2突变胆管癌患者进行分析,基于ctDNA或肿瘤组织探索获得性耐药的发生机制,并对潜在的耐药改变进行功能性研究。
其中,60%患者在获得性耐药后出现了一种或多种可检测到的继发性FGFR2激酶结构域突变。以N550“分子制动器”突变和V565“守门人”突变最为常见,分别占FGFR2激酶结构域突变的63%和47%。
功能性研究显示,不同抑制剂对FGFR2突变具有各自独特的活性作用。值得关注的是,与福巴替尼共价结合的半胱氨酸残基(FGFR2 C492)被破坏的情况极为罕见,在接受该药治疗的42例患者中仅1例患者发现上述情况。FGFR2 C492突变体对福巴替尼的抑制作用不敏感,信号活性较低,或可为其发生率低的原因。
通过精准检测发现,继发性FGFR2激酶结构域突变可能为FGFR抑制剂获得性耐药的主要机制,最常见的是N550和V565突变。开发靶向FGFR2耐药突变全谱系的组合策略及下一代FGFR抑制剂至关重要,精准检测将在其中占据重要地位。
精准检测与生存获益改善相关
Exploring the Clinical Use of Molecular Profiling of Intrahepatic Cholangiocarcinoma in a Comprehensive Multidisciplinary Clinic. Julia Purchla, et al. J Am Coll Surg, 2024 Apr. IF=5.2
精准检测除在肿瘤诊断、预后评估等方面占据重要地位外,关于其与生存获益间的相关性研究也处于不断探索中。一项回顾性研究[6]纳入194例2019年~2023年经病理组织检查确诊为ICC的患者,通过回顾性分析患者组织活检、细胞刷检和液体活检的分子表达谱及治疗过程中接受靶向治疗的情况,旨在探索从首诊之日起,患者检测到的可靶向的分子突变与总生存期(OS)间的相关性。OS定义为从进行分子表达谱分析之日到死亡/最后一次随访之日;未接受分子表达谱分析的患者,OS定义为从向中心报告之日到死亡/最后一次随访之日。
【研究结果】精准检测,定点靶向,基因检测有助改善生存获益
1.分子谱分析 在194例胆管癌患者中,125例患者存在具体分子分型,45%(56例)患者具有可靶向的分子突变。在分子表达谱分析中,共检出87个可作为治疗靶点的分子突变。其中,异柠檬酸脱氢酶(IDH)代谢通路突变最常见为32.2%,IDH1突变占25.4%,IDH2突变占6.9%。14.9%可靶向的分子突变为成纤维细胞生长因子受体(FGFR)融合,13.8%为FGFR2融合。程序性死亡配体1(PD-L1)过表达在可靶向的分子突变中占比为10.3%。磷脂酰肌醇3激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白细胞增殖通路的可靶向分子突变主要为磷脂酰肌醇-4,5-二磷酸3-激酶催化亚基α突变,占可靶向分子突变的8%。酪氨酸激酶受体2(ERBB2)过表达占6.9%,而BRCA1/2突变占可靶向的分子突变5.7%。高肿瘤突变负荷(TMB-H,>10muts/mb)及高微卫星不稳定性(MSI-H,≥2个位点不稳定)分别占可靶向的分子突变5.7%及3.4%。
此外,其他少见但值得注意的可靶向分子突变为细胞周期蛋白依赖性激酶4/6(cdk4/6)突变(3.4%)、上皮间充质转化(MET)基因扩增(2.3%)及c-ros原癌基因1酪氨酸激酶(ROS1)融合(1.1%)。
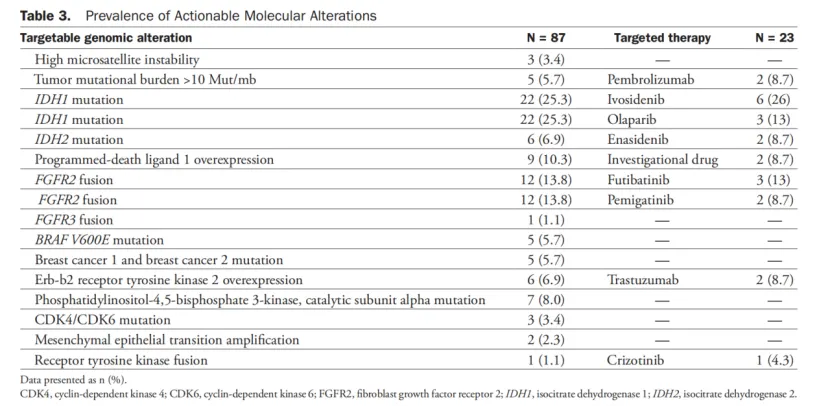
2.接受靶向治疗患者靶向药物使用情况 41%(23例)检测到分子突变的患者接受了靶向治疗。其中,26%为接受艾伏尼布治疗的IDH1突变患者,8.07%为接受Enasidenib治疗的IDH2突变患者。接受Futibatinib和Pemigatinib治疗的FGFR2融合患者分别为13%及8.7%。接受帕博利珠单抗治疗的TMB-H患者、接受曲妥珠单抗治疗的ERBB2高表达患者及接受新型双功能融合蛋白治疗的PD-L1过表达患者均占8.7%。接受克唑替尼治疗的ROS1融合突变患者仅1例(4.3%)。在接受靶向治疗的23名患者中,22例在开始靶向治疗前接受至少1次干预。
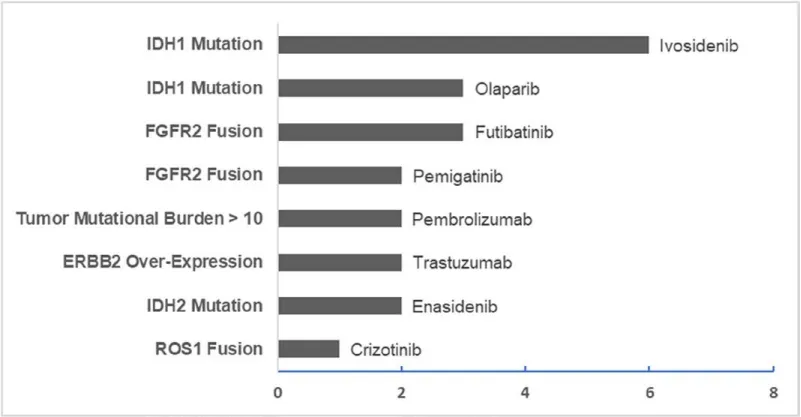
3.生存结局分析 在接受分子表达谱分析的120例ICC患者中,检测到可靶向的分子突变与OS改善相关。与未检测到可靶向的分子突变患者相比,检测到可靶向的分子突变患者OS延长近50%(34.1 vs 23.6个月,P=0.008)。在非转移性ICC患者中观察到与整体人群一致的生存获益,对于接受分子表达谱分析的非转移性ICC患者,检测到可靶向的分子突变患者OS显著延长(32.1 vs 27.5个月,p=0.02)。而在转移性ICC患者中,检测到可靶向的分子突变患者存在OS潜在获益倾向,但OS并未取得显著改善(28.7 vs 18.4个月,P=0.16)。在接受靶向治疗的23例患者中,平均OS为33.6个月。其中,10例患者在接受靶向治疗后出现病情进展或复发。
【分析】
全面基因组测序的进展揭示了胆管癌分子特征的多样性及异质性,有助于指导临床治疗发展。本研究通过单中心回顾性分析,结果显示,近半数接受肿瘤分子表达谱分析的患者存在可靶向的分子突变。其中,约50%患者接受了靶向治疗。生存数据分析显示,检测到可靶向的分子突变与OS改善相关,且生存获益优势存在于非转移性ICC患者中,进一步证实精准医疗对预后较差肿瘤临床获益的影响。
【专家点评】
田孝东教授表示,目前早期胆管癌标准治疗方案为手术切除,但术后复发风向较高,大多数患者就诊时已为晚期,不适合手术切除,传统一线化疗生存获益有限,而目前暂无二线标准治疗方案推荐,提示亟需有效的治疗方案全面满足胆管癌患者的治疗需求。而全面基因组测序的革命及靶向治疗的引入,为一线化疗后胆管癌患者的治疗提供了有效的替代选择。同时我们可以注意到,在2022年CSCO胆道恶性肿瘤指南分子检测指导中,除了推荐进行FGFR2融合检测,还推荐对MSI/MMR、BRAF、IDH1等多个分子指标进行检测[10]。2023年NCCN指南建议对于无法切除/转移性胆管癌患者进行全面的分子谱分析[11]。
随着全面基因组测序的广泛应用,胆管癌的分子格局不断演变,目前已取得相当大的进展,其中IDH1基因是CCA中相对常见的突变靶点。在iCCA中,欧美国家IDH1突变占比最高达约19%~30%,而中国IDH1突变占比约6.5%~20%[13]。
关于IDH1基因,田孝东教授为我们介绍了之前公布的一项III期临床研究ClarIDHy,该研究结果也证实[12],与安慰剂相比,艾伏尼布可显著延长IDH1突变晚期胆管癌患者的PFS(2.7 vs 1.4个月,HR=0.37,P<0.0001)。尽管高达70%的安慰剂组患者交叉接受艾伏尼布治疗,但艾伏尼布组的OS仍在数值上优于安慰剂组(10.3 vs 7.5个月,HR=0.79,P=0.09),经校正交叉治疗因素验证后该优势仍存在(安慰剂组OS为5.1个月,HR=0.49,P<0.001)。提示靶向治疗IDH1突变的药物艾伏尼布可为有相关基因突变的胆管癌患者带来生存获益。


截至目前,获批用于胆管癌的靶向治疗仍屈指可数,但为数不多的研究表明靶向治疗在延长胆管癌患者生存期,改善患者预后方面具有积极影响。而优化胆管癌肿瘤分子表达谱筛查则有助于患者精准靶向治疗药物的选择,尽管目前关于癌肿瘤分子表达谱筛查与肿瘤治疗获益间相关性分析较少,但检测到可靶向的分子突变与OS改善间的相关性已初现锋芒,未来期待更多相关研究开展,研究数据的不断披露,将进一步推动癌症患者肿瘤分子表达谱筛查,从而指导临床治疗,提高生存获益。
[1]Renzulli M,et al. Cancers (Basel). 2021 Jul 2;13(13):3336.
[2]韦鹏程,等.腹部外科, 2024, 37(1):1-6.
[3]Chun YS,et al.Cancer Control,2017,24(3):1073274817729241.
[4]Massironi S,et al. Cells. 2020 Mar 11;9(3):688.
[5]Lowery MA, et al. Lancet Gastroenterol Hepatol. 2019 Sep;4(9):711-720.
[6]Purchla J, et al. J Am Coll Surg. 2024 Apr 1;238(4):532-540.
[7]Makawita S, et al. JCO Precis Oncol. 2024 Mar;8:e2300544.
[8]Lee CL, et al. Mol Cancer Ther. 2024 Mar 4;23(3):394-399
[9]Wu Q, et al. Clin Cancer Res. 2024 Jan 5;30(1):198-208.
[10]2022 CSCO
[11]2023 NCCN
[12]Zhu AX, et al. JAMA oncology. 2021 Nov 1;7(11):1669-77.
[13]中国抗癌协会胆道肿瘤专业委员会.中国抗癌协会胆道恶性肿瘤靶向及免疫治疗指南(2022)(简要版)[J].中国实用外科杂志,2023,43(5):481-491.
审批号:M-TIBSO-CN-202404-00017
本文转自:论坛报
排版编辑:肿瘤资讯-邓文普











 苏公网安备32059002004080号
苏公网安备32059002004080号


