2020年Staudt等人提出的分子亚型中,约50%的弥漫性大B细胞淋巴瘤(DLBCL)因缺乏特征性基因突变而无法分类,而这类未明确亚型DLBCL患者对一线标准治疗反应异质性大,总生存期(OS)和无进展生存期(PFS)差异显著,R-CHOP + X方案在其治疗中的效果与对照组无明显差异,因此仍需探索可预测靶向及免疫治疗有效性的生物标志物。程序性细胞死亡(PCD)受生物大分子调控,其代谢通路失调可致异常细胞累积,尽管DLBCL中不同PCD模式的作用已有报道,但在未明确亚型DLBCL中,19种PCD形式与抗肿瘤免疫反应的复杂相互作用尚不完全清楚。
基于此,南京医科大学第一附属医院(江苏省人民医院)徐卫/梁金花教授团队开展了一项研究,纳入来自多个公共数据库的270例及江苏省人民医院队列的69例未明确亚型DLBCL患者,确定了8个与PCD相关的基因,构建PCD指数(PCDI),分析其与关键基因、ctDNA负荷、临床特征和疾病进展的相关性,刻画不同风险组的遗传和突变特征,建立预后模型预测生存结局,并探究模型基因、PCDI评分与淋巴瘤微环境(LME)间的复杂相互作用对疾病进展和治疗反应的影响。
近期,该研究结果已发表于Clinical and Translational Medicine杂志,【肿瘤资讯】特将研究结果整理如下,以飨读者。

数据收集与整合
研究人员从GSE117556(N=116)和GSE181063(N=154)两个公共数据库以及江苏省人民医院队列(JSPH 队列,N=69)中收集了患者的临床数据、基因表达数据、DNA突变谱等多组学数据。所有患者均接受了标准的R-CHOP治疗方案。
为了构建PCD相关基因集,研究人员从多个科学数据库和文献中整理了与19种不同PCD模式相关的基因,经过去重处理后,最终得到了2118个独特的PCD相关基因用于后续分析。
PCDI的构建与验证
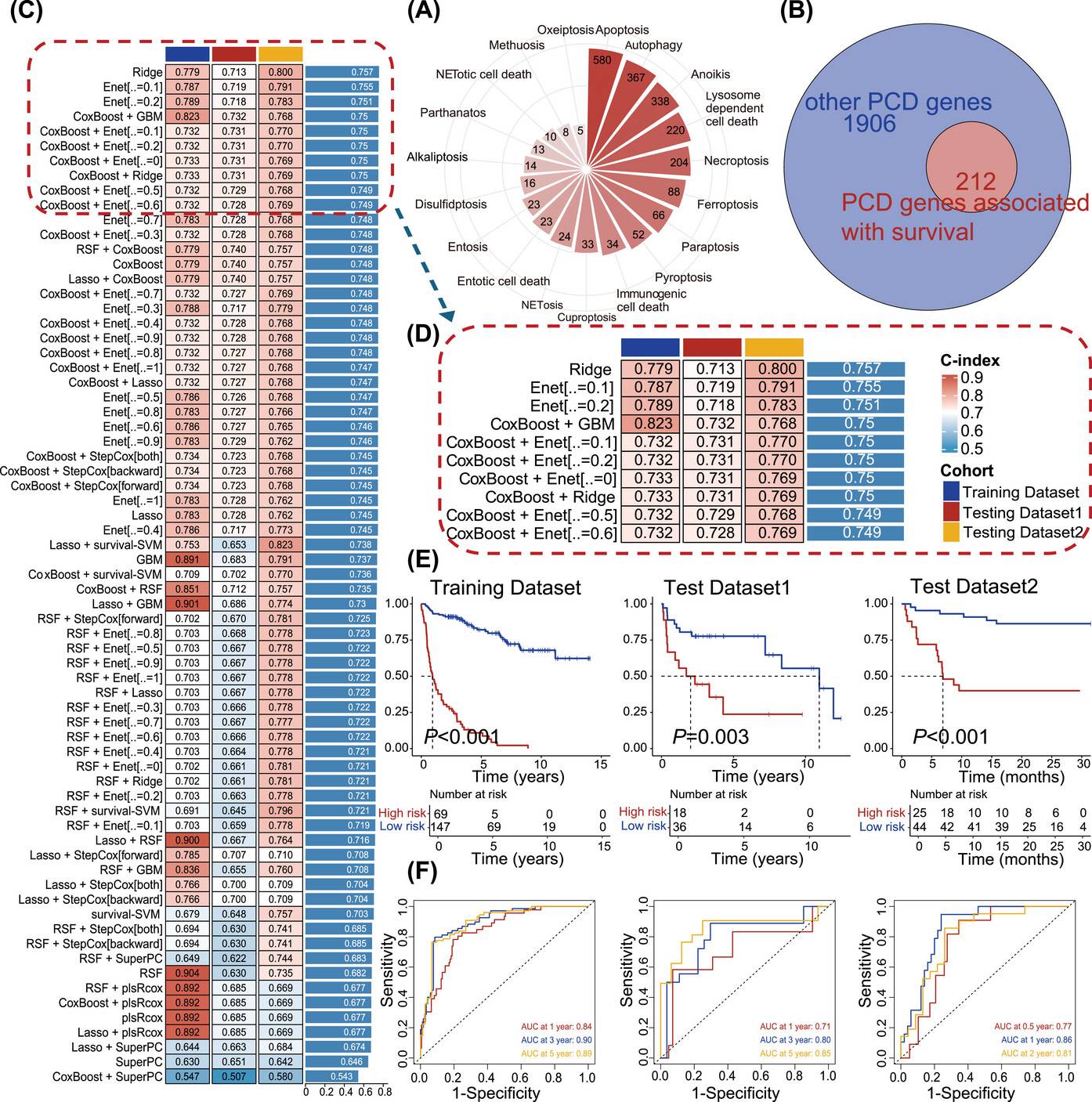
运用10种机器学习算法和70种算法组合,在训练数据集中开发了70个不同的模型,并通过留一法交叉验证(LOOCV)对模型进行训练和评估。最终确定了由FLT3、SORL1、CD8A、BCL2L1、COL13A1、MPG、DYRK2和CAMK2B这8个基因组成的PCDI特征基因集。
通过对公共数据库和JSPH队列中患者的分析,发现PCDI在预测患者预后方面具有显著的能力。在训练数据集、测试数据集1和测试数据集2中,高PCDI评分与较差的PFS显著相关(训练数据集:P<0.001;测试数据集1:P=0.003;测试数据集2:P<0.001)。
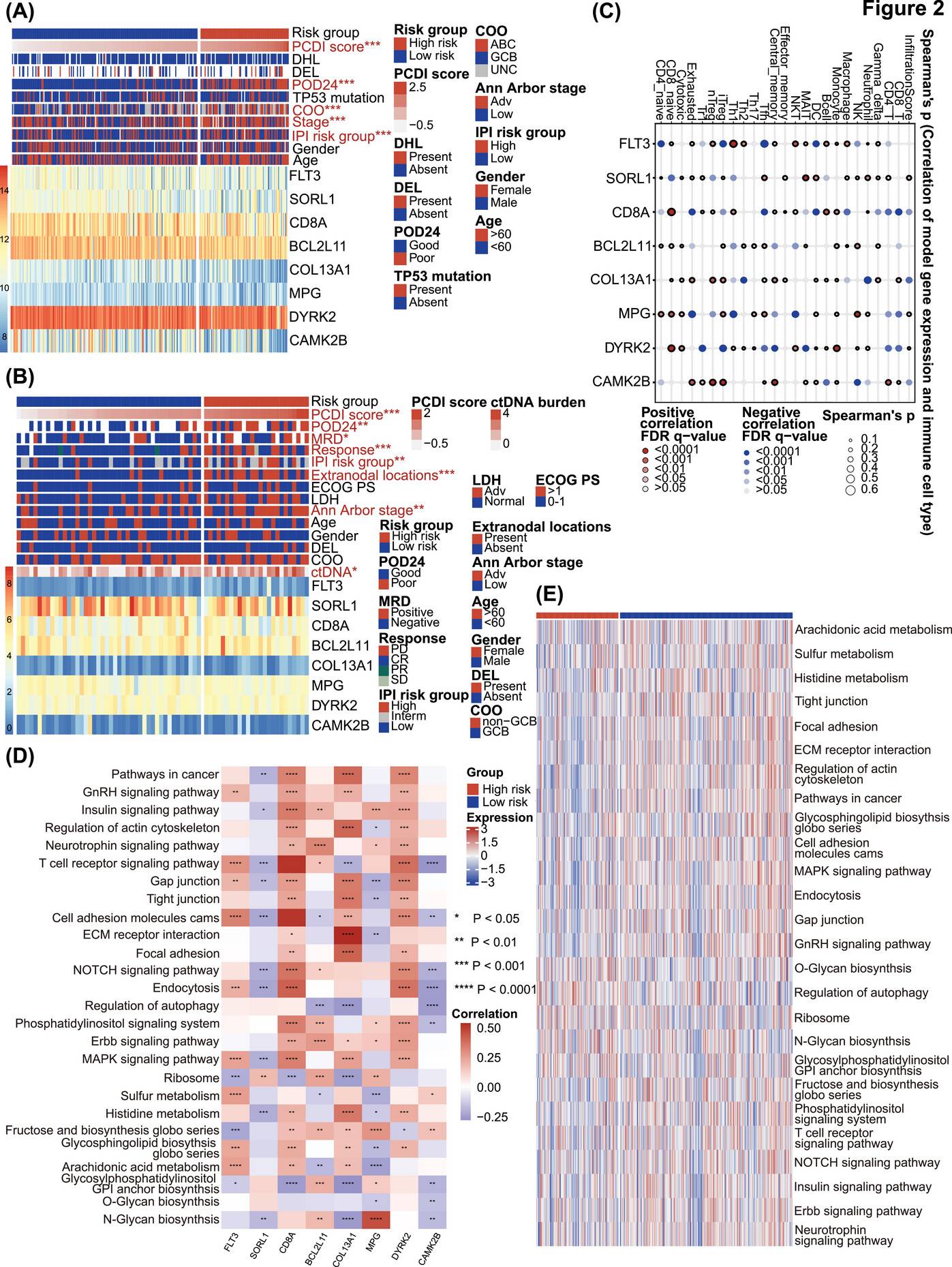
PCDI特征基因的特性分析
对PCDI相关的预后模型和临床特征进行热图分析,发现在公共数据库中,低风险组和高风险组在PCDI评分、24个月内疾病进展(POD24)、细胞起源(COO)、Ann Arbor分期和IPI风险组等方面存在显著差异(P<0.001),JSPH队列中也呈现出类似结果。
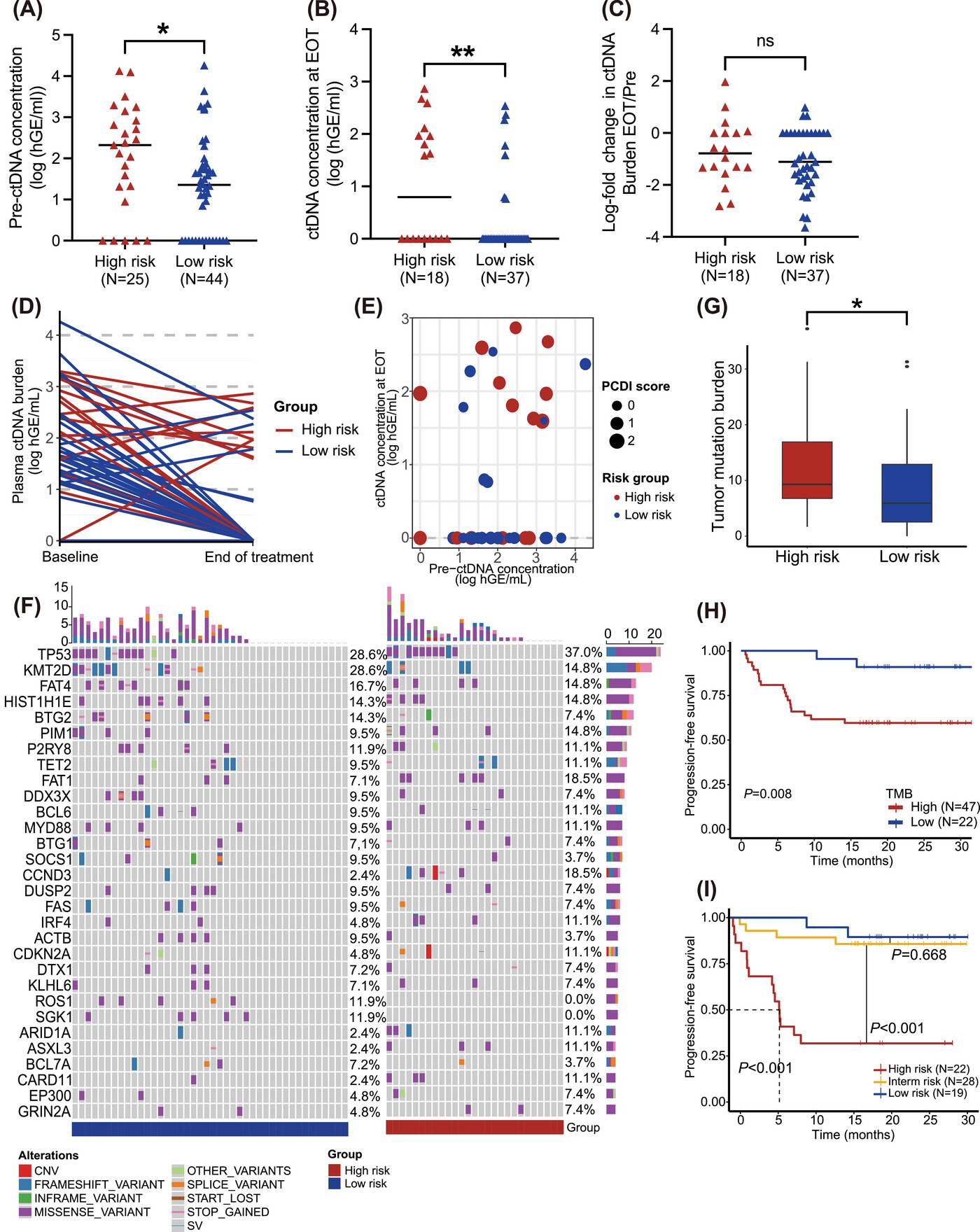
液体活检分析显示,高风险患者治疗前的ctDNA浓度明显高于低风险患者(P<0.05),治疗结束时,高风险组ctDNA的检测阳性率也更高(P<0.05)。此外,在肿瘤突变分析中,发现高风险组血浆中CCND3突变更为常见,而低风险组组织样本中BCL2突变频率更高,NSD2突变在高风险组中更频繁出现。同时,高风险组的肿瘤突变负荷(TMB)显著升高,且TMB与PCDI联合分析能够更精准地预测患者的预后。
不同PCDI组的液体活检动态监测
研究人员对患者治疗前后的ctDNA进行动态分析,结果表明高风险患者在治疗前和治疗后的ctDNA浓度均较高,但两组患者ctDNA负荷的对数变化无显著差异。进一步分析发现,几乎所有高风险患者不仅倾向于呈现MRD阳性,而且ctDNA负荷的变化也较高。
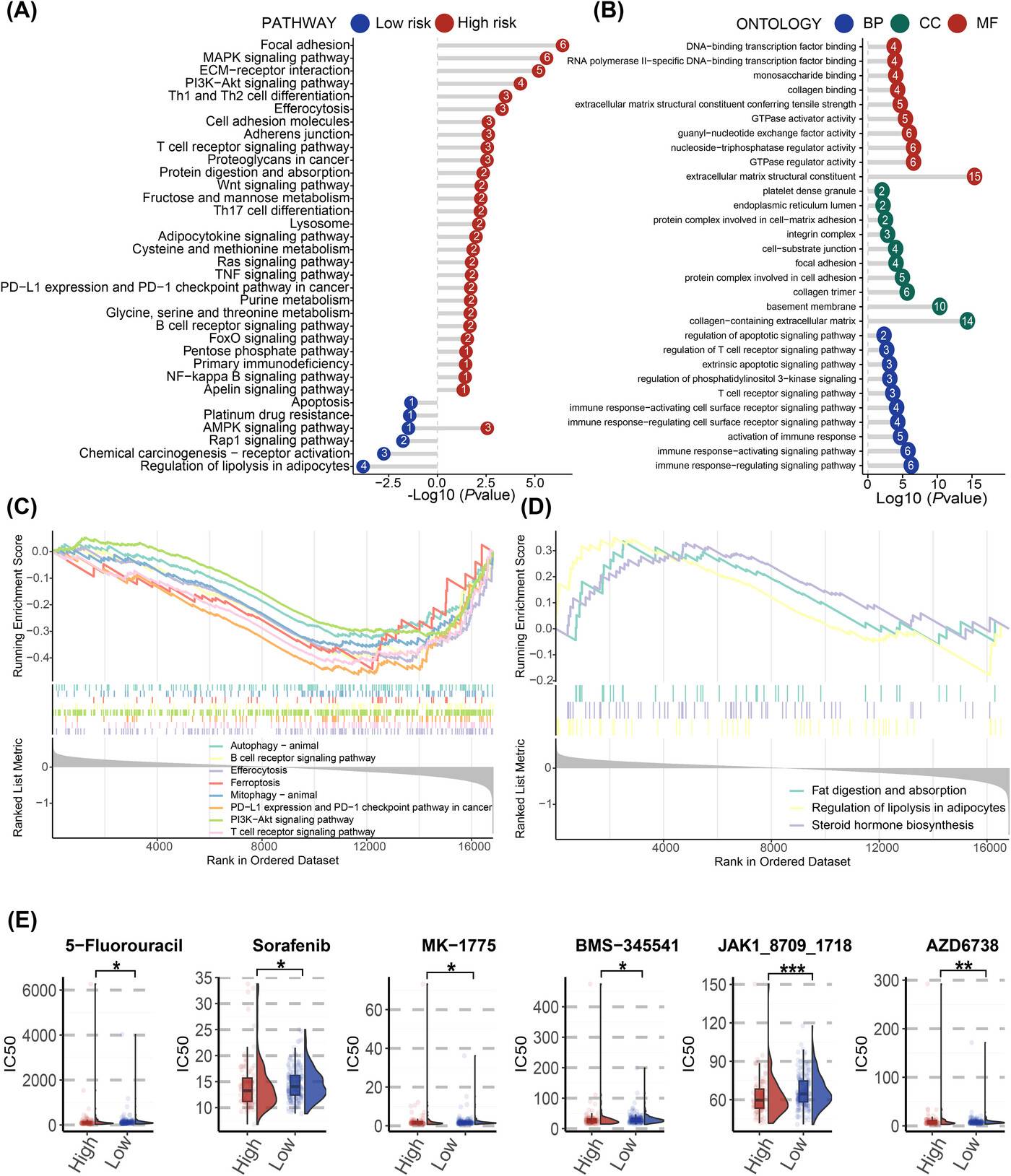
PCDI组的潜在生物学机制探究
通路富集分析显示,在高风险组中,PCDI主要富集于细胞黏附相关的focal adhesion、溶酶体相关的lysosome、胞葬作用相关的efferocytosis以及细胞间黏附连接相关的adherens junction等细胞过程;在环境信息处理方面,主要集中在PI3K-Akt和NF-kappa B信号通路。此外,PD-L1表达和PD-1检查点通路在高风险组中也显著富集。
基于GDSC数据库的药物敏感性分析发现,高风险患者对多种抗肿瘤药物更为敏感,如5-氟尿嘧啶、索拉非尼、MK-1775、BMS-345541、JAK1抑制剂和AZD6738等。其中,JAK1抑制剂在高风险组中的IC50值明显低于低风险组,提示其在高风险患者中可能具有更好的治疗效果。
与PCDI特征相关的肿瘤免疫过程机制剖析
对癌症干细胞(CSCs)相关的mRNAsi评分分析发现,高风险患者的mRNAsi评分较高,但风险评分与mRNAsi评分之间未观察到显著的相关性。
在肿瘤免疫周期分析中,发现高风险组在肿瘤免疫周期的第2(癌症抗原呈递)、4(肿瘤免疫浸润细胞招募)和5(免疫组织流入)阶段存在明显的中断现象。同时,研究还分析了与癌症保护机制相关的178个基因在七个阶段的表达水平,进一步揭示了PCDI特征对肿瘤免疫过程的影响。
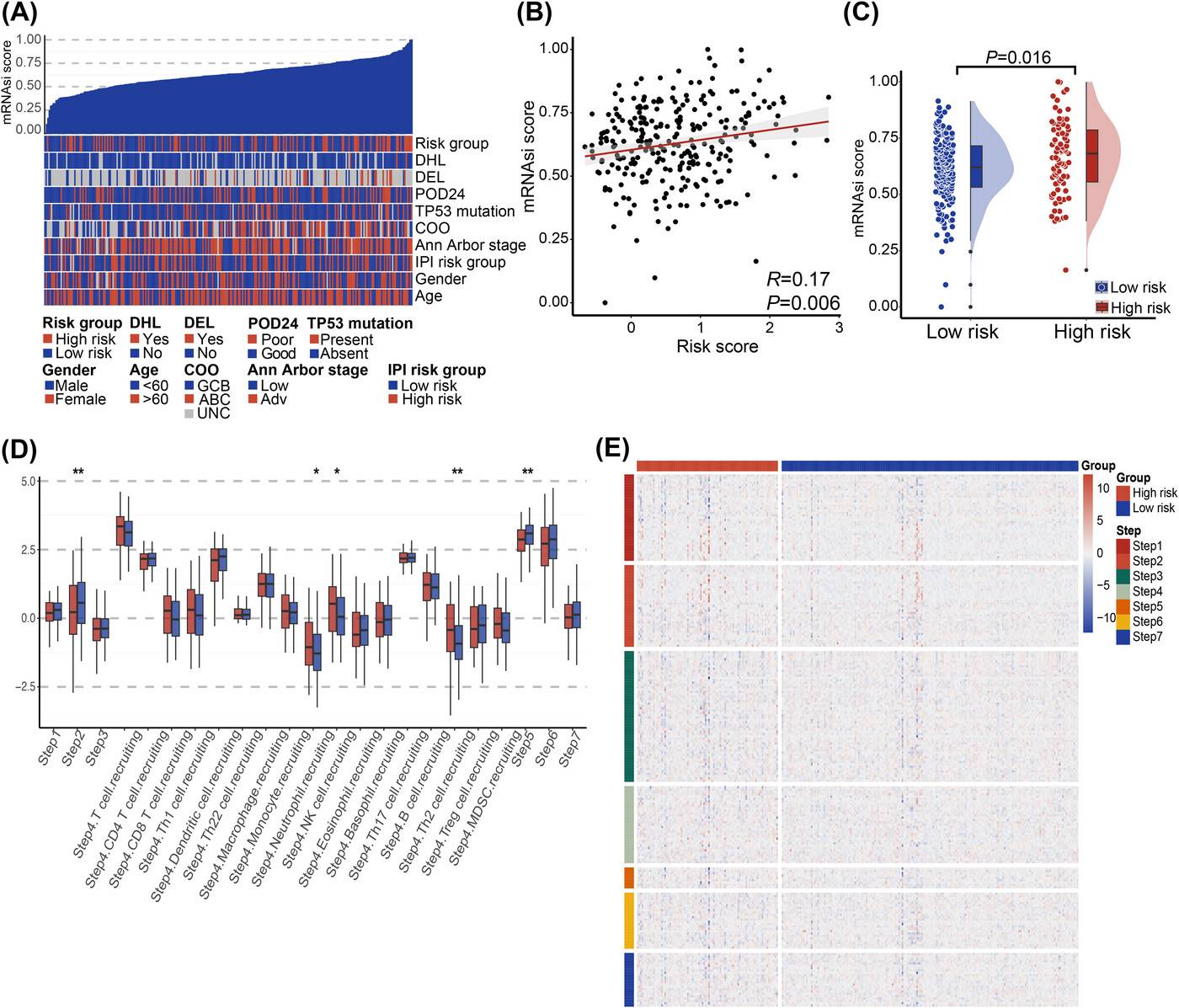
不同PCDI组的免疫特征比较
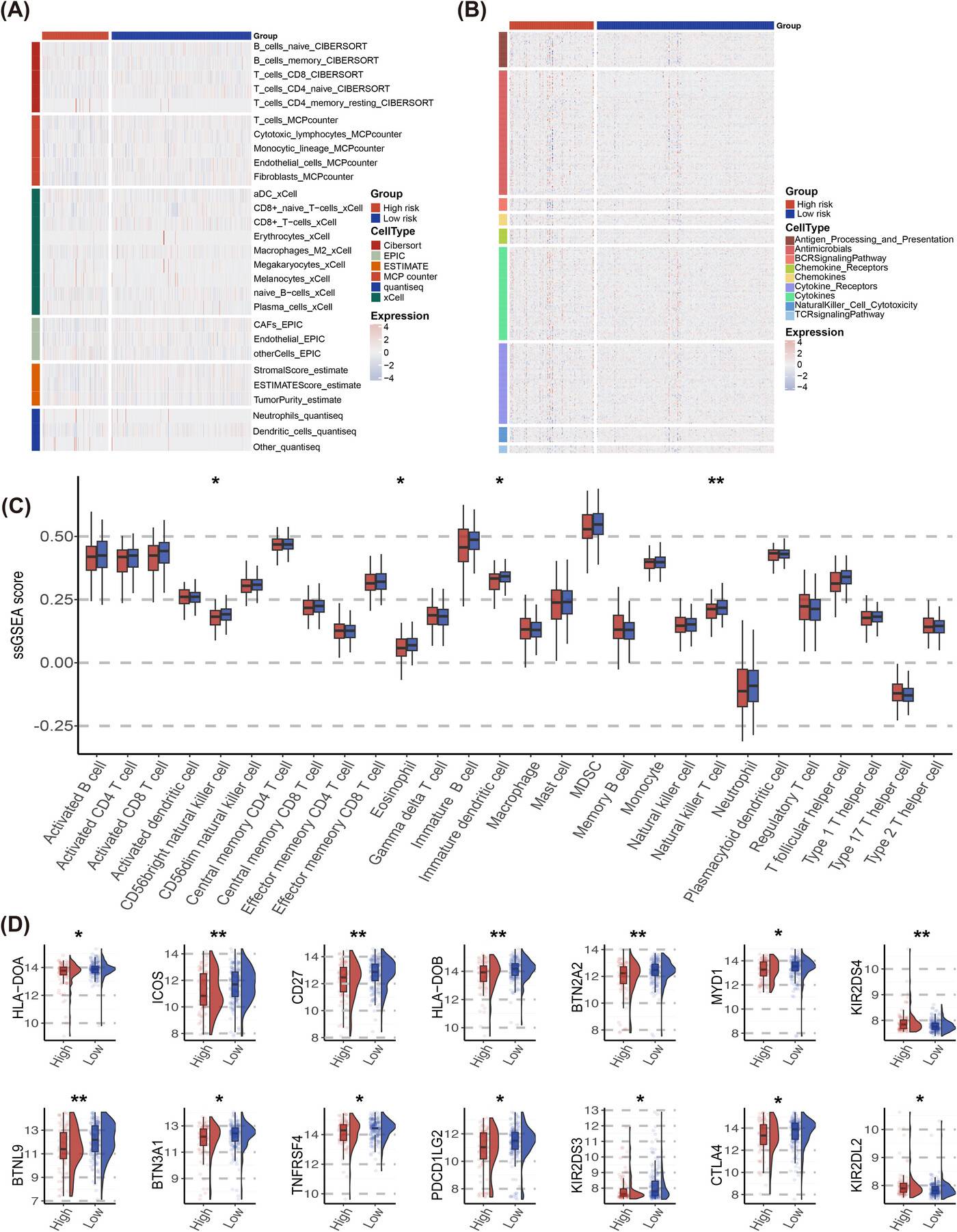
通过多种算法评估免疫细胞浸润情况,发现低PCDI评分与较高的CD4 T细胞、CD8 T细胞和M1巨噬细胞浸润相关,而高PCDI评分患者的基质和ESTIMATE评分显著降低。在JSPH队列中,也观察到了类似的趋势,且中央记忆CD4 T细胞在低风险组中更为常见。
对免疫检查点表达的分析显示,PCDI特征评分与多种免疫检查点呈负相关,包括HLA-DOA、HLA-DOB、ICOS、CD27、CTLA4、PD-L2 等,这表明高PCDI评分患者的免疫抑制状态可能更强。
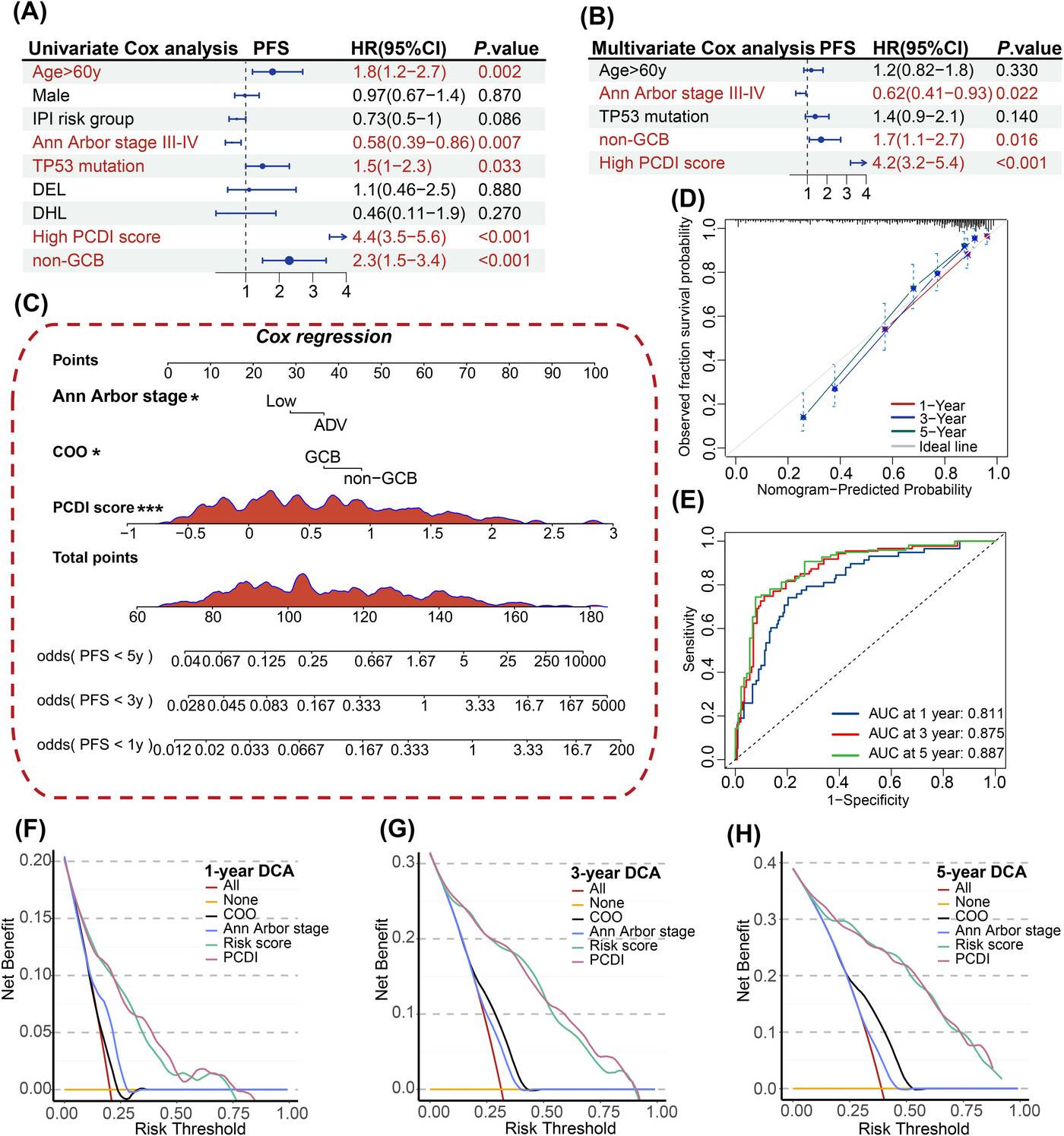
预后模型的开发与评估
单变量和多变量Cox回归分析表明,PCDI是未明确亚型DLBCL患者的一个重要风险因素(单变量:HR=4.4,P<0.001;多变量:HR=1.7,P<0.001)。
利用多变量Cox和逐步回归分析建立的预后列线图模型,能够有效预测患者1、3和5年的PFS率。校准和ROC曲线分析证实了该模型具有较高的准确性,决策曲线分析(DCA)表明该模型在预测患者预后方面具有较好的临床实用性,优于其他模型。
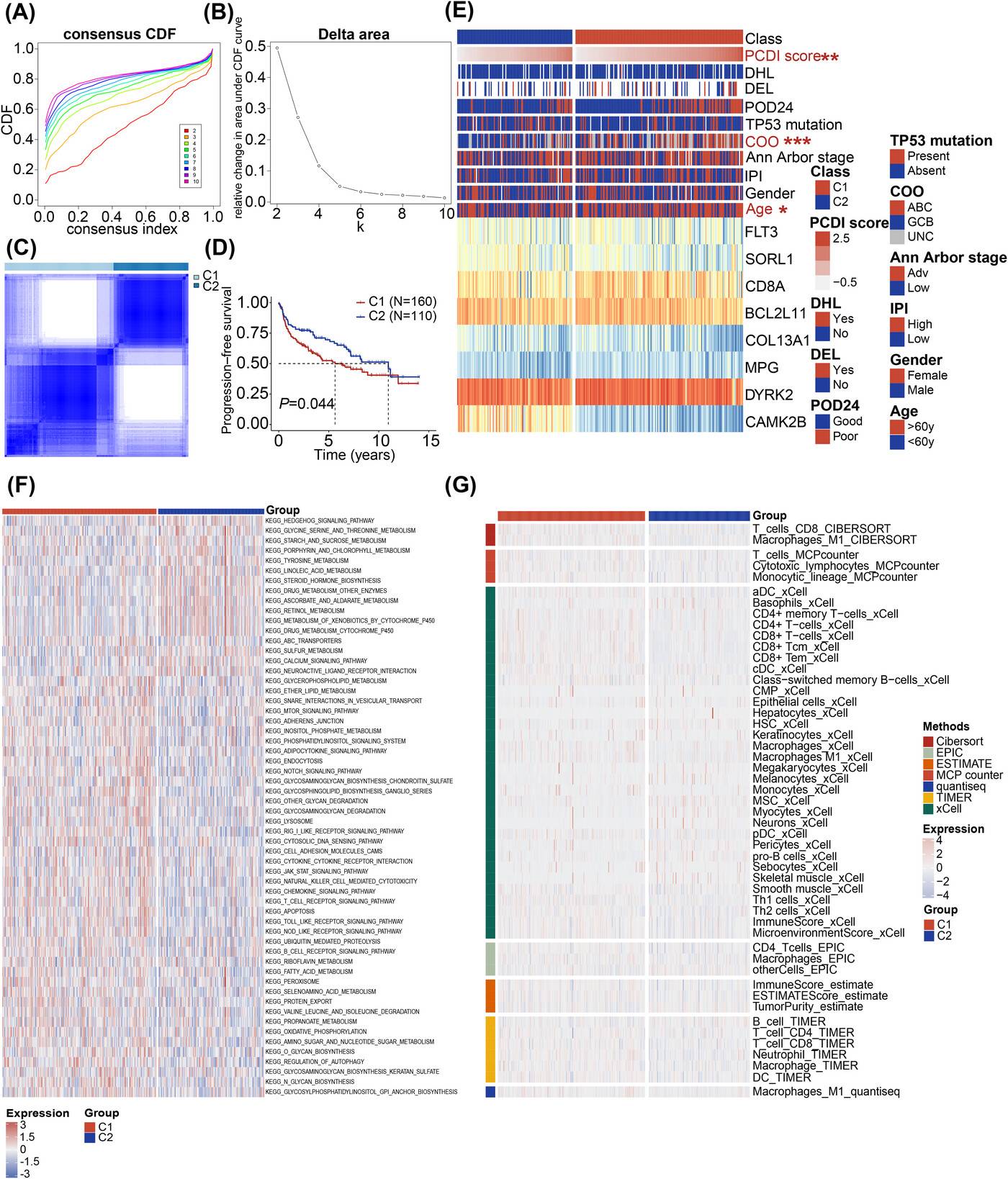
共识聚类识别患者亚群及特征分析
通过对PCDI特征基因进行共识聚类分析,确定K=2为最佳稳定聚类数,将患者分为两个亚群(C1和C2)。C1亚群主要由高PCDI评分患者组成,C2亚群主要由低PCDI评分患者组成。
C1亚群患者的PFS明显差于C2亚群(P=0.044),且在风险评分、COO和年龄等方面,两个亚群之间存在显著差异。基因集变异分析(GSVA)结果显示,C1亚型表现出与肿瘤和免疫相关通路的激活增加,如T细胞受体、B细胞受体、JAK-STAT信号通路、内吞作用和细胞凋亡,这表明PCDI特征与这些经典的肿瘤相关通路密切相关。
研究结论
本研究通过整合PCD模式和液体活检技术,成功构建了PCDI,并全面揭示了其在未明确亚型DLBCL患者中的重要临床意义。PCDI不仅与患者的预后密切相关,还与免疫微环境和药物敏感性存在显著关联。高PCDI评分的患者预后较差,且对传统化疗可能存在耐药性,但可能从特定信号通路抑制剂(如JAK1抑制剂)中获益。
本研究建立的预后模型具有良好的预测性能,为未明确亚型DLBCL患者的个性化治疗提供了重要的理论依据和决策支持。然而,研究也存在一定的局限性,如JSPH队列的样本量相对较小,需要进一步扩大样本量以更准确地验证模型的准确性和可靠性。未来,还需要开展更多的机制研究、临床试验以及临床评估,以深入探究PCD基因在未明确亚型DLBCL中的作用机制,为患者提供更加精准、有效的治疗策略。
HuaW, Liu J, Li Y, et al.Revealing the heterogeneity of treatment resistance in less-defined subtype diffuse large B cell lymphoma patients by integrating programmed cell death patterns and liquid biopsy. Clin Transl Med.2025;15:e70150. https://doi.org/10.1002/ctm2.70150
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


