病例介绍
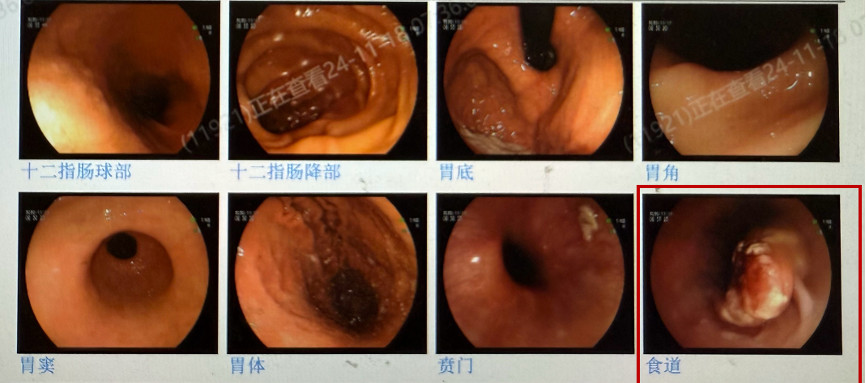
患者,女性,73岁。4年前患者出现嗳气、腹胀,【胃镜】显示距门齿29-35cm处花椰菜样增生病变,累及2/5的管腔,【病理】提示低分化鳞状细胞癌。
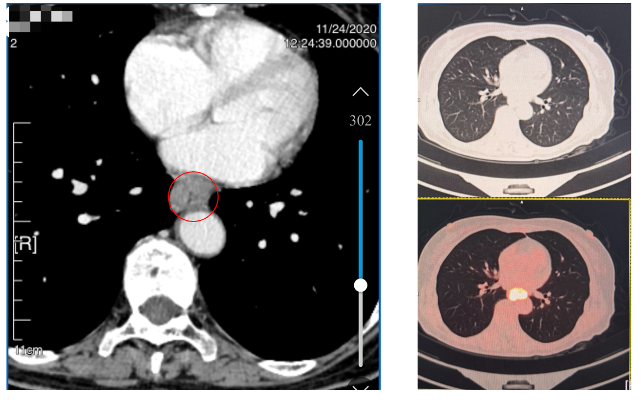
 【食管癌分期CT】提示食管中下段不规则增厚伴肿块形成(3.3cm × 1.6cm),伴强化。【PET/CT】提示:1.胸中段和下段食管壁广泛增厚,伴代谢活性显著升高,与周围血管边界模糊,提示恶性病变;2.左侧锁骨上区及贲门内侧淋巴结肿大,代谢活动明显升高,提示有转移的可能。
【食管癌分期CT】提示食管中下段不规则增厚伴肿块形成(3.3cm × 1.6cm),伴强化。【PET/CT】提示:1.胸中段和下段食管壁广泛增厚,伴代谢活性显著升高,与周围血管边界模糊,提示恶性病变;2.左侧锁骨上区及贲门内侧淋巴结肿大,代谢活动明显升高,提示有转移的可能。
进一步行左侧锁骨上淋巴结穿刺活检,未见恶性肿瘤证据。在MDT和与患者及家属充分沟通后,建议患者行新辅助治疗,并将患者纳入PALACE-Ⅱ临床试验。自2020年12月24日起,患者接受新辅助治疗,方案为:1.放疗:食管病灶及阳性淋巴结41.4 Gy,共23次;2.化疗:白蛋白结合紫杉醇84.5 mg +卡铂204 mg(5次);3.帕博利珠单抗免疫治疗200mg(2次)。
在完成新辅助治疗后,2021年2月下旬患者无明显诱因下出现全身斑驳的红色斑点和丘疹,并逐渐进展为溃疡。同时,患者的嘴唇也出现溃疡、出血和结痂,并伴有疼痛。于我院就诊,诊断为PD-1单抗引起的中毒性表皮坏死松解症(TEN)合并耐甲氧西林金黄色葡萄球菌(MRSA)感染。予甲泼尼龙用于抗炎,免疫球蛋白用于免疫调节,万古霉素、美罗培南和达非诺康唑用于抗感染治疗。
患者症状逐渐得到控制,糜烂部位基本愈合。由于严重的不良反应,患者无法接受食管癌手术。后对患者进行定期随访,最新的检查结果表明,新辅助治疗有效地抑制了食管癌的进展。
【随访检查】
2021-05-20【PET/CT】未见中下段食管壁异常增厚,伴中度代谢增高,可能与治疗后改变有关;2022-11-7【胃镜】管腔通畅,距门牙29 - 35厘米处可见黏膜斑片状发白区;【病理】小面积轻度鳞状上皮异型性,考虑为食管黏膜反应性改变。2023-02-10【食管癌分期CT】食管中下段CA治疗后改变,表现为食管壁轻微增厚和局部管腔狭窄。食管壁的状况较前有所改善。2024-03-13【食管癌分期CT】食管中下段CA治疗后改变,食管管壁微增厚,局部管腔狭窄。2024-03-29【胃镜】食管腔清晰,粘膜完整,齿状线规则。距门齿30-35 cm处,黏膜血管扩张,管壁坚硬,蠕动不佳。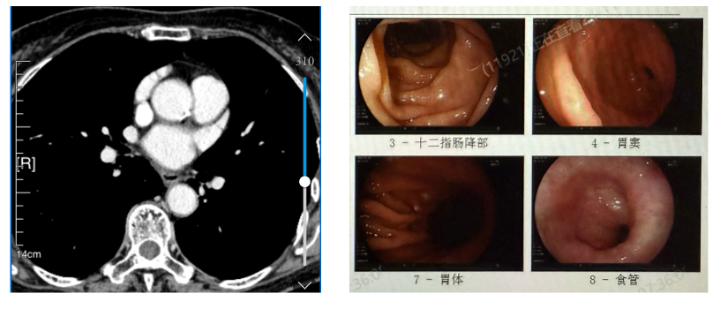 患者目前规律随访中,未见复发。
患者目前规律随访中,未见复发。
一、局部晚期食管癌的标准治疗
2012年荷兰的CROSS研究[1, 2]为新辅助放化疗在可手术的食管鳞癌和食管胃交界部腺癌中的应用提供了重要证据。该研究显示,术前新辅助放化疗使R0切除率从69%提高到92%,病理完全缓解率(pCR)达到29%(47/191),其中鳞癌的pCR达到49%。总生存率显著提高(HR: 0.657, 95% CI: 0.495-0.871, P=0.003)。10年随访数据显示,与单纯手术组相比,术前放化疗组的生存优势始终明显,绝对生存获益提高了13%(10年OS率:放化疗组38% vs 单纯手术组25%),死亡风险降低了40%。基于该研究,新辅助放化疗逐步成为局部晚期食管癌的标准治疗方案。
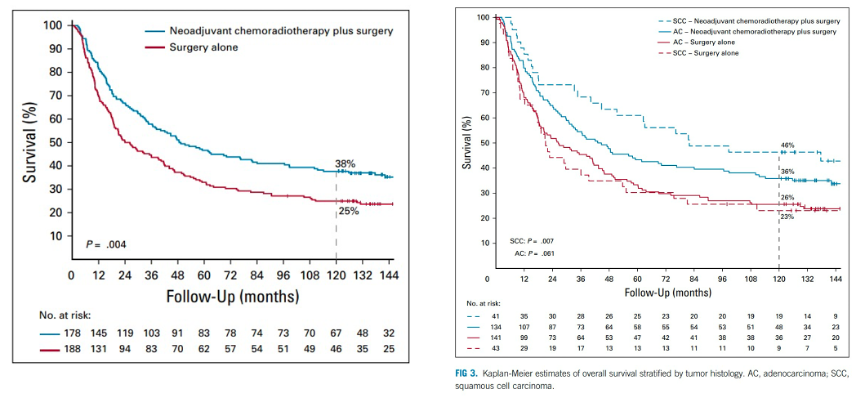
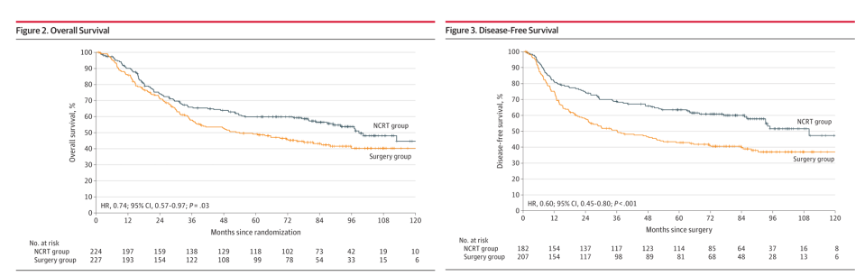
2018年,我国的NEOCRTEC5010研究[3, 4]纳入了2007年至2014年间在国内8家中心的451例局部晚期食管鳞癌患者。研究结果显示,与单纯手术相比,术前放化疗的综合治疗模式可以有效改善患者的生存状况,显著延长中位生存时间(100.1个月 vs. 66.5个月, p=0.025)。术前放化疗组的pCR率为43.2%,R0切除率从91.2%提高到98.4%(p=0.002)。2021年的长期随访结果显示,与单纯手术组相比,nCRT组患者的OS和DFS均有显著改善:OS(HR=0.74;95% CI:0.57-0.97;P=0.03)和DFS(HR=0.60;95% CI:0.45-0.80;P<0.001)。两组患者的5年生存率分别为59.9%(95% CI:52.9%-66.1%)和49.1%(95% CI:42.3%-55.6%)。因此,我国局部晚期可手术或潜在可手术食管癌的标准治疗逐步采用新辅助同步化放疗。
 在NCCN指南中,也同样推荐术前新辅助放化疗,可作为局部晚期食管癌的标准治疗。
在NCCN指南中,也同样推荐术前新辅助放化疗,可作为局部晚期食管癌的标准治疗。
 二、局部晚期食管癌新辅助后器官保留的探索
二、局部晚期食管癌新辅助后器官保留的探索
一项对NEOCRTEC5010研究的分析显示,nCRT后, pCR是食管鳞状细胞癌患者总生存期和无病生存期的重要预后指标。43.2%的患者在接受新辅助放化疗后达到了病理完全缓解。pCR组的平均生存时间显著长于非pCR组(92.6个月 vs. 69.2个月;HR = 2.70;95% CI:1.48-4.92;P = 0.001)。pCR组的5年总生存率和无病生存率分别为79.3%和77%,而非pCR组则分别为54.8%和51.2%[4]。
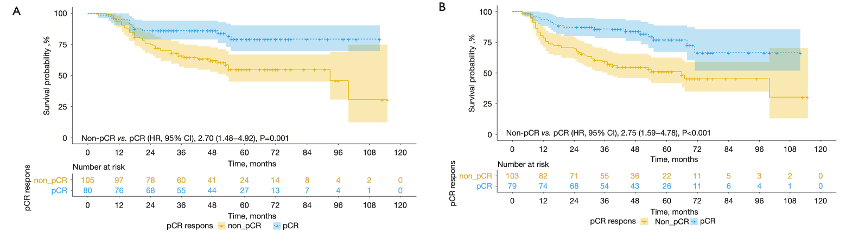
在接受新辅助治疗的患者中,观察到较高的病理完全缓解率和生存获益。考虑到食管癌根治术创伤较大,术后并发症以及术后生存治疗问题也不容忽视,这为新辅助治疗后是否继续进行食管切除术提供了合理依据。少数患者在接受新辅助治疗后,因主观或客观原因放弃手术,选择保留器官治疗。
对于新辅助治疗后达到临床完全缓解(clinical complete response, cCR)的患者,是否仍需接受手术,NCCN指南和CSCO指南推荐首选手术,但也可以选择密切观察。然而,相关临床证据和推荐级别较低。
 针对这个问题,荷兰学者发起一项阶梯整群、随机、非劣效III期临床研究——SANO临床研究[5]。本研究纳入接受新辅助治疗后达到cCR的食管癌患者,共198名患者接受了主动监测,111名患者接受标准手术。主动监测组中位随访时间为34个月,标准手术组为50个月。
针对这个问题,荷兰学者发起一项阶梯整群、随机、非劣效III期临床研究——SANO临床研究[5]。本研究纳入接受新辅助治疗后达到cCR的食管癌患者,共198名患者接受了主动监测,111名患者接受标准手术。主动监测组中位随访时间为34个月,标准手术组为50个月。
主动监测组的总生存率不劣于标准手术组(HR, 0.88, 95%上限1.40, P = 0.007)。主动监测组的中位无病生存期为35个月(95% CI, 31-41),而标准手术组为49个月(95% CI, 38-50.15)。
在主动监测组中,69名患者(35%)保持临床完全缓解,96名患者(48%)出现局部或区域复发,33名患者(17%)出现远处转移。两组的R1切除率均为2%,术后90天死亡率分别为4%(主动监测组)和5%(标准手术组)。nCRT后30个月,主动监测组有43%的患者出现远处转移,而标准手术组为34%(HR = 1.35,95% CI:0.89-2.03,P = 0.18)。两组R1切除率均为2%,主动监测组和标准手术组的术后90天死亡率分别为4% vs 5%。在主动监测组6个月(P = 0.002)和9个月(P = 0.007)时,健康相关生活质量(HRQOL)有显著改善,且具有统计学意义。
三、器官保存的前提
新辅助治疗后达到pCR的患者理论上可避免手术治疗,但其前提是高pCR率和高pCR预测能力。
1、preSANO研究[6] 是一项在荷兰六个中心进行的前瞻性诊断队列研究,符合条件的患者年龄为18岁或以上,组织学证实的可切除的食管鳞状细胞癌或腺癌,或食管胃交界处癌症,接受新辅助治疗后进行食管癌手术。主要终点是临床反应评估期间与最终病理反应之间的相关性,通过临床反应评估期间漏诊的肿瘤退缩分级(TRG)3或4(>10%的切除标本中有残余癌)的肿瘤比例来显示。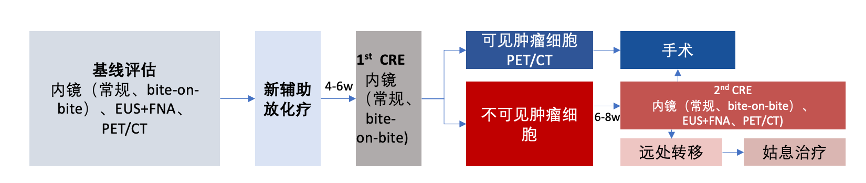
本研究共纳入207名患者进行分析。在26例TRG3或TRG4肿瘤中,有8例(31% [95% CI:17–50])通过常规活检和细针穿刺未能发现。41例TRG3或TRG4肿瘤中,有4例(10% [95% CI:4–23])通过连续活检和细针穿刺未能发现。内镜超声测量最大肿瘤厚度时,在39名患者中漏诊了11例(28% [95% CI:17–44])TRG3或TRG4残留肿瘤。PET-CT在41例TRG3或TRG4肿瘤中漏诊了6例(15% [95% CI:7–28])。PET-CT在190名患者中检测到18例(9%)经组织学证实的间隔转移(1例鳞状细胞癌,17例腺癌)。食管癌新辅助化疗放疗后,通过内镜超声、活检和可疑淋巴结细针穿刺进行临床反应评估,对于检测局部残留疾病具有充分的敏感性,PET-CT则可用于检测间隔转移。
preSANO试验通过引入临床反应评估(clinical response assessment, CRE)方法,为筛查cCR患者提供了宝贵的经验。然而,preSANO试验结果主要涉及EAC患者(78%),其在ESCC患者中的应用存在局限性,特别是在评估低级别残留病变伴淋巴结转移(ypN+)和高远处复发率方面,这在亚洲ESCC中很常见[7]。
2、基于既往 preSANO 试验的食管腺癌(EAC)相关数据,前瞻性、多中心、诊断队列试验 preSINO 针对亚洲 ESCC 患者进行了探索[7,8]。两次临床疗效评估节点分别为患者将在新辅助治疗结束后 4-6 周和(或)新辅助治疗结束后 10-12 周内进行疗效评估,判断其残留肿瘤状态。主要终点为在识别高风险残留肿瘤(如 TRG 3-4 级或伴ypN+的TRG 1-2级)方面,CRE-1或CRE-2 阶段深挖活检+EUS-FNA的联合准确率。
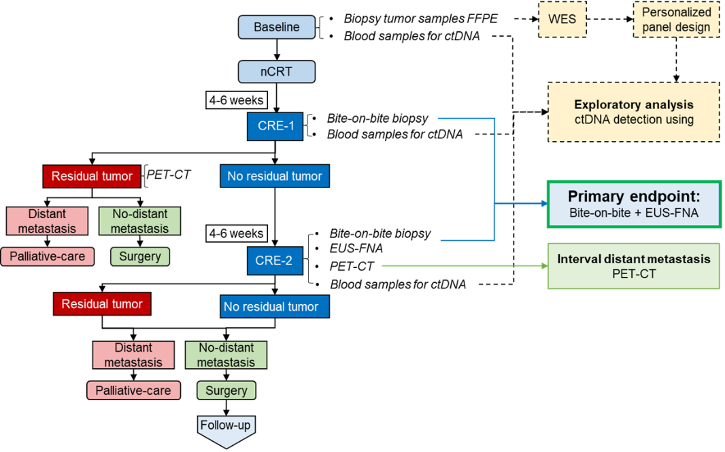
该研究自 2019 年 8 月 20日至 2023 年 1 月 15 日共纳入309 例ESCC 患者。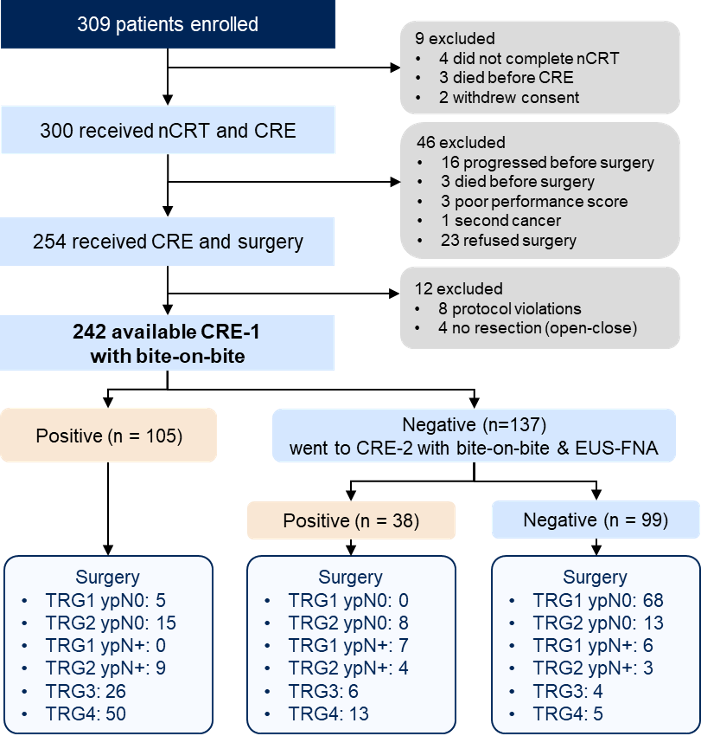 针对 133 例高风险残留肿瘤(TRG3-4 或 TRG1-2 伴ypN+)的患者,活检结合 EUS-FNA 检测残留肿瘤的FNR 为 13.5%(18 例未检出),低于预设的可接受标准(19.5%),显示出较高的检测效能。
针对 133 例高风险残留肿瘤(TRG3-4 或 TRG1-2 伴ypN+)的患者,活检结合 EUS-FNA 检测残留肿瘤的FNR 为 13.5%(18 例未检出),低于预设的可接受标准(19.5%),显示出较高的检测效能。
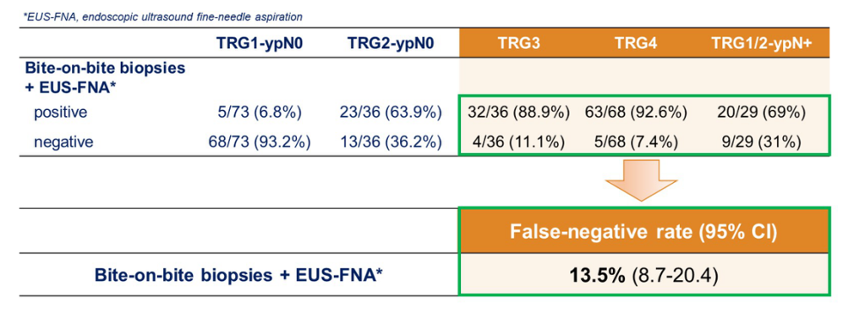 深挖活检+EUS-FNA 检测任何残留肿瘤(即 non-pCR)的敏感性达 82%,特异性为 93%,阴性预测值为 69%,阳性预测值高达 97%,全面验证了其在评估肿瘤残留中的准确性和可靠性。术前 PET-CT 检查在 268 例患者中识别出 4.9%(13 例)的远处转移。另外,CRE 阶段 ctDNA 阳性的患者术后远处复发率显著高于阴性患者(28.0% vs. 5.3%)。
深挖活检+EUS-FNA 检测任何残留肿瘤(即 non-pCR)的敏感性达 82%,特异性为 93%,阴性预测值为 69%,阳性预测值高达 97%,全面验证了其在评估肿瘤残留中的准确性和可靠性。术前 PET-CT 检查在 268 例患者中识别出 4.9%(13 例)的远处转移。另外,CRE 阶段 ctDNA 阳性的患者术后远处复发率显著高于阴性患者(28.0% vs. 5.3%)。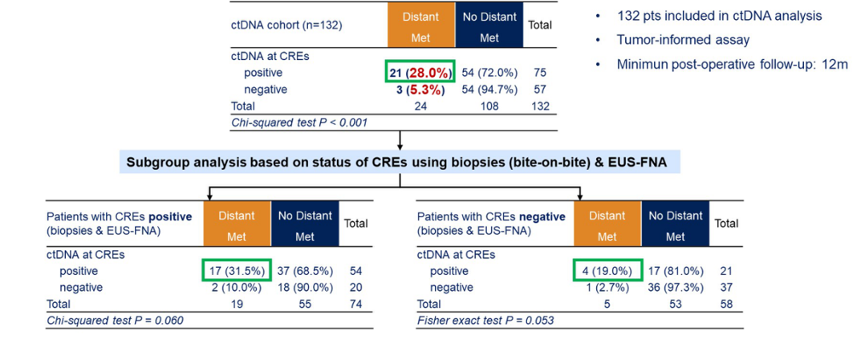
四、总结
食管癌的治疗正逐渐从传统的根治性手术转向器官保存。免疫治疗和干预的兴起可能加速这一进程,而提高cCR率成为维持治疗的重要手段,并有助于显著降低远处复发的风险。关于保器官治疗这一新兴理念,尽管目前尚未广泛推荐,但相信这一概念将逐渐获得更广泛的关注。基于精准评估的保器官治疗相关临床试验,特别是针对nCRT后达到pCR患者的探索,有望减少手术创伤,提升生活质量,并带来潜在的社会经济效益[7,9]。
1. van Hagen P, Hulshof MC, van Lanschot JJ, et al. Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med. 2012;366(22):2074-2084.
2. Eyck BM, van Lanschot JJB, Hulshof MCCM, et al. Ten-Year Outcome of Neoadjuvant Chemoradiotherapy Plus Surgery for Esophageal Cancer: The Randomized Controlled CROSS Trial. J Clin Oncol. 2021;39(18):1995-2004.
3. Yang H, Liu H, Chen Y, et al. Long-term Efficacy of Neoadjuvant Chemoradiotherapy Plus Surgery for the Treatment of Locally Advanced Esophageal Squamous Cell Carcinoma: The NEOCRTEC5010 Randomized Clinical Trial. JAMA Surg. 2021;156(8):721-729.
4. Shen J, Kong M, Yang H, et al. Pathological complete response after neoadjuvant treatment determines survival in esophageal squamous cell carcinoma patients (NEOCRTEC5010). Ann Transl Med. 2021;9(20):1516.
5. van der Wilk BJ, et al. Neoadjuvant chemoradiotherapy followed by surgery versus active surveillance for oesophageal cancer (SANOtrial): A phase-III stepped-wedge cluster randomised trial. 2023 ESMO abstr LBA75.
6. Noordman BJ, Spaander MCW, Valkema R, et al. Detection of residual disease after neoadjuvant chemoradiotherapy for oesophageal cancer (preSANO): a prospective multicentre, diagnostic cohort study. Lancet Oncol. 2018;19(7):965-974.
7.《局晚期食管鳞癌新辅助放化疗达到 cCR 可以豁免手术吗?李志刚教授团队成果入选 ASCO 突破性进展研究》,微信公众号:丁香园肿瘤时间
8. Zhigang Li, et al. Accuracy of detecting residual disease after neoadjuvant chemoradiotherapy for esophageal squamous cell carcinoma (preSINO trial): a prospective multicenter diagnostic cohort study in Asia. 2024 ASCO Breakthrough Abstract 196.
9.《【Case Pilot】进展期食管癌患者器官保留的探索及思考》,公众号:肿瘤咨询
排版编辑:肿瘤资讯-Kingsley











 苏公网安备32059002004080号
苏公网安备32059002004080号


