(以下内容仅供医学药学专业人士阅读参考,如您非前述专业人士,请离开本页。)
对携带MET 14号外显子跳跃突变(METex14跳突)的晚期非小细胞肺癌(aNSCLC)患者治疗疗效的真实世界研究评估1
Real-world assessment of treatment effectiveness in patients with advanced non-small cell lung cancer (aNSCLC) with MET exon 14 skipping (METex14).
Muhammad Furqan, et al.
2023 ASCO
背景:卡马替尼已被批准用于治疗METex14跳突的晚期非小细胞肺癌(aNSCLC)患者。然而,关于卡马替尼与其他获批疗法对比的疗效数据有限。本研究评估了携带METex14跳突的aNSCLC患者使用卡马替尼、免疫治疗(IO)或化疗(CT)治疗的实际临床疗效。
方法:在一项回顾性病历审查中,由美国全国范围内邀请的肿瘤学家随机选择预先指定数量的病历进行数据提取,其中接收卡马替尼和IO治疗的样本量更大。入组标准:年龄≥18岁,至少为IIIB期的NSCLC且携带METex14跳突;在2017年1月1日之后接受了一线(1L)系统治疗,并在开始1L治疗后至少随访6个月(除非死亡),直到数据提取日期;且未接受卡马替尼之外的MET抑制剂。研究终点包括真实世界总体最佳缓解率(rwORR)、无进展生存期(rwPFS)、总生存期(OS)和治疗中断时间(TTD)。使用rw-RECIST标准和RECIST 1.1标准或医生记录评估rwORR。所有治疗方法均进行了描述性分析。通过Kaplan-Meier方法评估1L及二线(2L)治疗的研究结果。
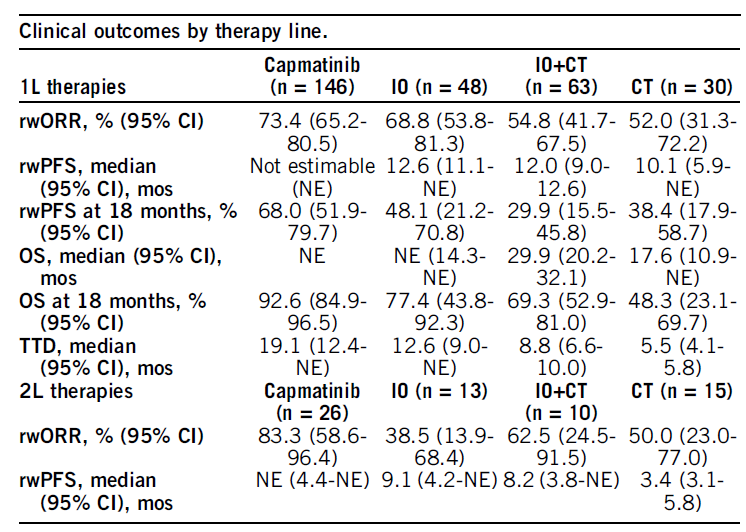
结果:共纳入了287名符合条件的患者。中位年龄为63.3岁,71%为男性,41%为非白人,49.5%在社区环境中接受治疗。15名患者基线伴有脑转移。1L接受卡马替尼治疗的患者比接受IO单药或单纯化疗或免疫联合化疗治疗的患者有更高的rwORR和更长的rwPFS、OS和TTD(表1)。2L接受卡马替尼治疗的患者比其他治疗有更高的rwORR,但患者样本量较小。
结论:在携带METex14跳突的aNSCLC患者中,卡马替尼的治疗疗效在数值上优于单独或联合使用IO或CT。这些发现支持在这种情况下使用卡马替尼,并可能在常规实践中指导临床决策。
点评专家
南京医科大学第一附属医院肿瘤科科副主任,肺癌中心副主任
南京医科大学肿瘤学系副主任
国家卫生健康委能力建设和继续教育肿瘤学专家委员会委员
中国临床肿瘤协会(CSCO)理事
CSCO非小细胞肺癌专家委员会委员
CSCO小细胞肺癌专家委员会委员
CSCO转化医学专家委员会常务委员
江苏省医师协会肿瘤化疗与生物治疗医师分会副会长
江苏省医学会肿瘤化疗与生物治疗专业委员会常务委员
中国初级卫生保健基金会肺癌专业委员会常务委员
中国控制吸烟协会第二届肺癌防治专业委员会常务委员
中国胸部肿瘤研究协作组(CTONG)成员
MET 14外显子(ex14)跳跃突变约占NSCLC患者的1-3%[2,3],卡马替尼是一种口服、高选择性的MET抑制剂,2022年8月FDA将卡马替尼加速批准升级为常规批准,是第一款获得FDA常规批准的MET抑制剂。其全球注册研究GEOMETRY mono-1更新了其长期随访结果,初治队列的中位随访时间达46.4个月,研究结果显示[4]卡马替尼一线治疗MET ex14跳突ORR 68%,DCR 98%,无进展生存期(PFS)12.5个月,总生存期(OS)21.4个月。针对脑转移患者,卡马替尼同样具有优异疗效,28例颅内病灶可评估患者的颅内完全缓解率(iCR)为32%,颅内客观缓解率(iORR)为57%。中国注册临床研究GeoMETry-C[5]显示出与全球注册研究一致的疗效,初治队列可评估人群的ORR达69.2%,DCR达100%,脑转移患者的iCR=50%,iDCR=100%。基于此研究卡马替尼于2024年6月在中国获批治疗未经系统治疗的MET 外显子14跳跃突变的局部晚期或转移性NSCLC。
因MET ex14跳突属少见突变,注册临床研究通常样本量受限,真实世界研究能够补充临床研究结果。本项真实世界研究共纳入了287例一线接收治疗的MET ex14跳突患者,其中接收卡马替尼治疗的患者146例,比较了卡马替尼与免疫治疗,化疗或免疫联合化疗的疗效。结果显示卡马替尼一线治疗rwORR达73.4%,中位PFS及OS均未达到,18个月的PFS率及OS率分别为68.0%和92.6%。而其他疗法的ORR为52%-68.8%,中位PFS为10.1-12.6个月,中位OS为17.6-NE个月,卡马替尼的疗效是优于免疫治疗,化疗或免疫联合化疗的疗效(表1)[6]。2L治疗中同样卡马替尼也显示出较其他疗法的疗效优势。另一项德国的真实世界研究RECAP研究[7]同样也证实了卡马替尼相比于其他疗法的优异疗效。初治患者中,卡马替尼可显著延长患者的OS(25.49个月 vs 14.59个月)、PFS(12.45 vs 5.03个月)和ORR(68.3% vs 26.9%)。总之,多项真实世界研究均证明了卡马替尼相比其他疗法对携带METex14突变的NSCLC患者的疗效更佳。
表1 卡马替尼对比其他疗效一线治疗的疗效分析
NCCN非小细胞肺癌临床实践指南将卡马替尼作为MET ex14跳突NSCLC一线治疗的优先推荐[8]。卡马替尼已于2024年6月在中国获批上市用于未经系统治疗的MET 外显子14跳跃突变的局部晚期或转移性NSCLC,期待卡马替尼中国真实世界研究数据的疗效验证。
非小细胞肺癌中BRAF信号通路和靶向途径9
Pathways and targeting avenues of BRAF in non-small cell lung cancer
Evgeny N Imyanitov, et al. (通讯作者:Evgeny N Imyanitov)
Expert Opin Ther Targets
IF = 4.6
引言:BRAF是一种丝氨酸/苏氨酸激酶,涉及调节MAPK信号级联反应。BRAF基因突变驱动的活化发生在约2-4%未经治疗的非小细胞癌(NSCLC)中。在对受体酪氨酸激酶抑制剂(TKIs)产生获得性耐药的肿瘤中,也常常观察到BRAF基因变异。
涵盖领域:本综述描述了BRAF突变谱系及其功能,讨论了适用于BRAF p.V600和非V600突变NSCLC的治疗方案,并指出该领域内的一些数据空白。
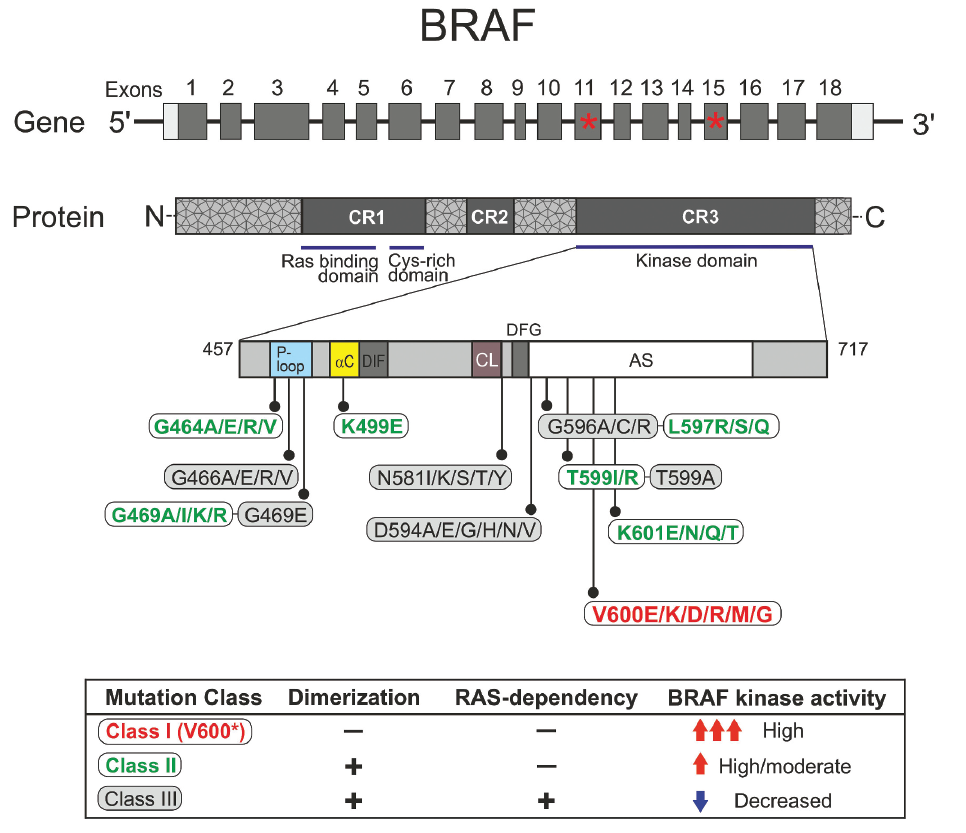
专家意见:对于携带BRAF V600(I类)突变的NSCLC患者,联合使用BRAF/MEK抑制剂通常能获得显著的获益。对于BRAF II类(L597、K601、G464、G469A/V/R/S、融合等)和III类(D594、G596、G466等)突变,目前尚无确定的治疗方法,这些突变占BRAF驱动的NSCLC的三分之二。BRAF突变NSCLC接受免疫治疗等问题仍有待进一步研究。BRAF突变在NSCLC中相对罕见,但肺癌整体的发病率相对较高,因此,对BRAF突变NSCLC具有待满足的临床需求。
点评专家
郑州大学第一附属医院保健办公室副主任
南院区肿瘤科病区负责人
河南省肺癌防治中心主任
郑州大学和哈佛大学麻省总医院联合培养博士生
《现代临床肿瘤》编辑部主任
河南省医学会肿瘤精准治疗分会副主任委员
河南省临床肿瘤学会肺癌专委会副主任委员
河南省临床肿瘤学会副秘书长、常务理事
中国抗癌协会肿瘤热疗专委会常委
中国老年保健协会肿瘤罕见靶点精准诊疗专委会常委
河南省研究型医院分子肿瘤专委会常委
最新流行病学数据[10]显示肺癌在男、女恶性肿瘤发病和死亡顺位中均位居首位,2022年肺癌新发病例106.06万,占全部恶性肿瘤的22.0%,死亡73.33万,占全部恶性肿瘤死亡的28.5%,因此增加对肺癌患者诊疗的规范化和全程化管理至关重要。BRAF突变占非小细胞肺癌(NSCLCs)的2-4%,是驱动基因阳性NSCLC患者中相对少见的类型,随着近年来学术界对少见或罕见突变肿瘤的关注和重视程度的逐年增加,精准诊断、精准诊疗理念也愈发深入人心。
BRAF V600突变即BRAF I类突变,在NSCLC中的I类突变约占BRAF突变的三分之一,而在非NSCLC中,BRAF V600突变则占BRAF突变的大多数。郑州大学第一附属医院在今年ESMO Asia公布的一项真实世界研究(CMBAST)[11],汇总分析了自2019年2月至2023年12月期间就诊的26115例实体瘤患者,经NGS检测后共有183例患者携带有BRAF突变,其中BRAF V600突变肺癌约占32.2%,提示对BRAF V600突变NSCLC患者人群的精准诊疗需要更多关注。
目前,BRAF V600突变转移性NSCLC患者的一线标准治疗是接受BRAF抑制剂联合MEK抑制剂的双靶方案。BRF113928研究[12]是一项多队列、多中心II期研究,队列C入组36例初治IV期BRAF V600E突变的转移性NSCLC患者,结果显示达拉非尼+曲美替尼治疗的客观缓解率(ORR)为63.9%,中位反应持续时间(DOR)15.2个月,中位PFS为14.6个月,中位OS长达24.6个月,5年总生存率为22%。队列B入组57例既往接受过1-3次治疗的IV期BRAF V600E突变的转移性NSCLC患者,结果显示达拉非尼+曲美替尼治疗的ORR为68.4%,中位DOR为 9.8个月,中位PFS 10.2个月,中位OS 18.2个月,5年总生存率为19%,该研究结果是首个BRAF突变NSCLC患者的长生存数据,一线二线治疗均能带来显著疗效获益。另外2024年WCLC公布了PHAROS研究[13],一项针对BRAF V600E突变NSCLC患者接受 Encorafenib联合Binimetinib治疗的单臂、开放标签、多中心、II期临床研究,结果显示BRAF抑制剂联合MEK抑制剂双靶组合疗效获益明确,但该治疗组合最常见的TRAE为消化道反应、乏力、视物模糊、肝功能损伤等。
在该篇综述中提到BRAF突变是TKI类药物的耐药机制之一,在临床上EGFR、ALK、ROS1阳性的NSCLC患者通常接受长期的TKI类药物治疗,但几乎所有的患者最终都会出现治疗耐药,出现耐药性的机制虽具有一定的多样化,但其中最常见的原因是MAPK信号通路再激活。在EGFR、ALK和ROS1 TKI治疗进展的NSCLC患者活检标本中已多次证明BRAF癌基因的激活,包括BRAF V600突变或BRAF II类突变,以及大量的BRAF融合[9]。在今年ESMO大会上一项通过系统性回顾结合多中心真实世界研究[14],纳入了迄今最大规模的104例EGFR-TKI耐药后继发BRAF改变NSCLC患者,探索了EGFR-TKI联合BRAF抑制剂和MEK抑制剂的三靶治疗策略。结果显示在使用一代/二代EGFR-TKIs后,57.1%的患者出现BRAF突变,42.9%出现BRAF融合。而在使用三代EGFR-TKIs后,这一比例变为76.5%的BRAF突变和23.5%的BRAF融合(P=0.185),提示三代EGFR-TKIs可能更容易诱导BRAF突变。在BRAF突变患者中接受三靶联合治疗较其他治疗方案同样显示延长的mPFS(9.0个月 vs 2.8个月,P=0.004),BRAF I类突变(主要为V600E)患者中,三靶联合治疗的获益最为显著,mPFS达到9.0个月(vs其他治疗方案2.5个月, P<0.01),BRAF融合亚组,三靶联合治疗方案仍显示出一定获益优势 (mPFS 5.0 vs 2.0个月),但差异未达到统计学显著性 (P=0.230),该研究也进一步证实三靶联合方案能有效改善继发BRAF变异患者预后。
BRAF V600E是目前已获批“Tumor agnostic”治疗的靶点之一。ROAR、NCI-MATCH、BELIEVE等研究相继探索了BRAF抑制剂联合MEK抑制剂治疗BRAF V600E突变实体瘤的疗效及安全性[15-17],此外,泛RAF抑制剂Belvarafenib治疗BRAF II/III类突变实体瘤早期研究数据[18]也已公布。我们团队发表的CMBAST研究[11]显示,BRAF V600E突变实体瘤患者(n=54)一线靶向治疗的rwPFS优于化疗以及免疫联合化疗方案(8.3个月 vs 4.8个月 vs 4.6个月,p=0.041),BRAF突变实体瘤(n=77)患者接受靶向治疗的rwOS获益同样优于非靶向治疗组(41.4个月 vs 25.1个月,p=0.012),该研究提示针对BRAF突变的实体瘤接受靶向治疗获益明确,支持”异病同治”模式。
目前开展临床研究最多的是BRAF V600突变,但BRAF II类突变及III类突变尚无明确的靶向治疗方法,未来针对BRAF突变的临床试验需要考虑BRAF非V600突变以及同一肿瘤中存在的共存突变谱。对BRAF突变的NSCLC患者使用免疫疗法值得进一步考虑,在黑色素瘤和结直肠癌中已经评估了联合BRAF/MEK和免疫检查点抑制,但在非小细胞肺癌中是否需要与免疫检查点抑制剂联合尚需更多研究。
超级多原发性肺癌在MAPK通路中携带高频率BRAF和低频率EGFR突变19
Super multiple primary lung cancers harbor high-frequency BRAF and low-frequency EGFR mutations in the MAPK pathway.
Haochen Li(通讯作者:Haochen Li, Zhicheng Huang, Chao Guo)
NPJ Precis Oncol
IF = 6.8
多原发性肺癌(MPLC)的发病率正在上升,一些手术患者表现出众多的病灶。我们将具有五个或更多原发性病灶的肺癌定义为超级MPLC。阐明这种特殊MPLC亚型的基因组特征可以帮助减轻疾病负担并理解肿瘤的演变。在我们的同步超级早期MPLC队列(PUMCH-ssesMPLC)中,对来自18名患者切除的130个恶性标本进行的全外显子测序,提供了全面的超级MPLC基因组景观。PI3k-Akt和MAPK信号通路中的突变更为丰富。它们的BRAF突变频率(31.5%)明显高于病灶较少和早期单病灶癌症的MPLC,而EGFR突变则明显较少(13.8%)。随着病灶数量的增加,BRAF突变逐渐成为主导。此外,侵袭性病灶更倾向于具有经典的超级MPLC突变模式。BRAF突变的高频率,特别是第二类,以及EGFR突变的低频率可能是超级MPLC患者靶向治疗效果有限的原因之一。
METex14跳突非小细胞肺癌(NSCLC)的分子谱分析:组织学的影响20
Molecular profiling METex14+ non-small cell lung cancer (NSCLC): Impact of histology
Jennifer A Marks, et al.(通讯作者:Jennifer A Marks)
Lung Cancer
IF =4.8
目的:MET 14号外显子跳跃突变(METex14跳突)代表了代表具有不同生物学和基因组特征的非小细胞肺癌(NSCLC)的异质性亚组。我们在一个大样本队列中对这种异质性进行了表征,整合了基因组和转录组分析以及临床结果,以阐明METex14跳突NSCLC的组织学和分子特征以及生存模式。
材料与方法:NSCLC组织样本(n=28,739)在Caris Life Sciences进行了基于DNA的下一代测序(592个基因,NextSeq)或全外显子测序(NovaSeq)、RNA测序包括全转录组测序(WTS, NovaSeq)和PD-L1 IHC(Dako 22C3),从bulk RNA测序(quanTIseq)估算免疫细胞比例。实际生存数据(mOS)是从保险索赔中计算得出。统计分析采用了卡方检验、Fisher精确检验或Mann-Whitney U检验和对数秩检验,并在适用的情况下进行了假设检验校正。
结果:共检测到711例METex14跳突病例。在575例已定义组织学类型的病例中,77例(13.6%)为鳞状细胞(Sq),474例(82.3%)为非鳞状(nSq),24例(4.1%)为腺鳞状。POT1和BRCA2的突变富集,MDM2、HMGA2、CDK4和MET的扩增在METex14跳突肿瘤中常见。与组织学无关,METex14跳突中TMB高和TP53突变的肿瘤减少。KEAP1(2.1% vs 14.7%)和STK11突变(0.8% vs 17.1%)仅在METex14跳突 nSq中减少(与METex14跳突Sq相比,P< 0.05)。尽管PD-L1高表达肿瘤在METex14跳突中富集与组织学无关,但T细胞炎症肿瘤仅在nSq METex14跳突中富集。B细胞和CD8+ T细胞(1.07-1.43倍)在nSq METex14跳突中富集,而树突状细胞(0.32倍)仅在METex14跳突Sq中减少。与非METex14跳突肿瘤相比,METex14跳突肿瘤的实际中位生存期(mOS)有所改善(mOS=22.9个月 vs 18.6个月,HR= 0.914,P=0.04)。此外,与未接受免疫治疗(IO)相比,接受IO的METex14跳突肿瘤的生存期有所改善(mOS=27.5个月 vs 21.8个月;HR=0.803,P=0.03)。与METex14跳突Sq肿瘤相比,METex14跳突 nSq肿瘤与改善的mOS相关(mOS: 27.7个月 vs 8.9个月,HR=0.493,P< 0.0001)。
结论:METex14跳突是非小细胞肺癌的一个异质性亚组。我们的分析揭示METex14跳突nSq相比METex14跳突Sq表现出更好的生存期。不同组织学类型间独特的基因组和转录组变异需要临床上的考虑。
2022年全球肺癌负担和2050年肺癌预计负担21
Global burden of lung cancer in 2022 and projected burden in 2050
Lanwei Guo , et al.(通讯作者:Haiyan Yang)
Chin Med J (Engl)
IF = 1.58
背景:肺癌是全球最常见的癌症,也是导致癌症相关死亡的主要原因。本研究旨在评估2022年全球肺癌的发病率和死亡率,并预测2050年中国和美国的肺癌新增病例数和死亡数。
方法:在这项研究中,使用了GLOBCAN 2022数据库的数据来分析肺癌的发病率和死亡率。通过国家/地区、性别、年龄和人类发展指数(HDI)来描述肺癌发病率和死亡的当前状况,并预测2050年中国和美国的肺癌发病率和死亡率。
结果:全球范围内,2022年估计新增肺癌病例数2,480,675例,肺癌相关死亡1,817,469例,年龄标准化发病率(ASIR)和年龄标准化死亡率(ASMR)分别为23.6/10万和16.8/10万。在中国,男性肺癌患者的ASIR和ASMR分别约为女性的1.7倍和2.7倍。高HDI国家的ASIR和ASMR分别约为低HDI国家的8.5倍和6.5倍。预计到2050年,中国男性新增肺癌病例数约1120万例和死亡960万例,中国女性新增约680万例和死亡450万例,美国男性新增约170万例和死亡110万例,美国女性新增约160万例和死亡90万例。
结论:不同地区和性别的肺癌发病率和死亡率存在显著差异。因此,在肺癌的预防、筛查和治疗策略中需要考虑性别因素,并且需要积极推广肺癌的三级预防措施,尤其是一级和二级预防。
审批码TAB0034576-79592,有效期为2024-11-25至2025-11-24,资料过期,视同作废
1. Muhammad F, et al. Real-world assessment of treatment effectiveness in patients with advanced non-small cell lung cancer (aNSCLC) with MET exon 14 skipping (METex14).2023 ASCO,e21112
2. Liu SY, et al. The Unique Characteristics of MET Exon 14 Mutation in Chinese Patients with NSCLC. J Thorac Oncol 2016;11:1503–10;
3. Tan AC, et al. Targeted Therapies for Lung Cancer Patients With Oncogenic Driver Molecular Alterations. J Clin Oncol. 2022;40(6):611-625
4. Wolf J, et al. Capmatinib in MET exon 14-mutated non-small-cell lung cancer: final results from the open-label, phase 2 GEOMETRY mono-1 trial. Lancet Oncol. 2024 ;25(10):1357-1370.
5. Yi-Long Wu, et al. Capmatinib in Chinese adults with EGFR wt, ALK rearrangement negative (ALK-R−), MET exon 14 skipping mutation (METex14), advanced NSCLC: Results from the phase II GEOMETRY-C study. 2022 ESMO AISA 388P.
6. Furqan M, et al. Effectiveness of standard treatments in non-small-cell lung cancer with METexon14 skipping mutation: a real-world study. Future Oncol. 2024;20(22):1553-1563.
7. Kron A, et al. Efficacy of capmatinib compared to standard of care for German patients with locally advanced or metastatic NSCLC harboring METex14 mutations: Results from the RECAP study. 2023 ESMO 1383P.
8. NCCN NSCLC guideline V11 2024
9. Evgeny N. Imyanitova,et al. Pathways and targeting avenues of BRAF in non-small cell lung cancer. Expert Opin Ther Targets.2024 Jul;28(7):613-622.
10. 郑荣寿, 等. 2022年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2024, 46(3):221-231.
11. Wang XY, et al. CMBAST study: A real-world database of clinical and molecular characteristics in patients (pts) harboring BRAF mutation in solid tumor profiled with NGS. 2024 ESMO Asia,522P
12. Planchard D, et al. Phase 2 Study of Dabrafenib Plus Trametinib in Patients With BRAF V600E-Mutant Metastatic NSCLC: Updated 5-Year Survival Rates and Genomic Analysis.Thorac Oncol. 2022;17(1):103-115.
13. Smit E, et al. Updated safety analysis of encorafenib plus binimetinib in patients with BRAF V600E-mutant metastatic NSCLC from PHAROS study. 2024 WCLC MA 06.13.
14. Li Y, et al. Features and efficacy of triple-targeted therapy for patients with EGFR-mutant non-small-cell lung cancer with acquired BRAF alterations who are resistant to epidermal growth factor receptor tyrosine kinase inhibitors. ESMO Open. 2024;9(10):103935
15. Subbiah V, et al. Dabrafenib plus trametinib in BRAFV600E-mutated rare cancers: the phase 2 ROAR trial. Nat Med. 2023;29(5):1103-1112.
16. Salama AKS, et al. Dabrafenib and Trametinib in Patients With Tumors With BRAFV600E Mutations: Results of the NCI-MATCH Trial Subprotocol H. J Clin Oncol. 2020;38(33):3895-3904.
17. Honma Y, et al. Phase II trial of Encorafenib and Binimetinib in patients with BRAF-altered advanced solid tumors: Results of Encorafetinib and Binimetinib cohort in the BELIEVE trial. ESMO 621P
18. Dziadziuszko R, et al. Belvarafenib in patients with BRAF class II or III alteration-positive tumors: TAPISTRY study. ESMO 624P.
19. Haochen Li, et al. Super multiple primary lung cancers harbor high-frequency BRAF and low-frequency EGFR mutations in the MAPK pathway. NPJ Precis Oncol.2024;8(1):229.
20. Jennifer A Marks, et al. Molecular profiling METex14+ non-small cell lung cancer (NSCLC): Impact of histology.Lung Cancer. 2024:196:107935.
21. Guo LW, et al. Global burden of lung cancer in 2022 and projected burden in 2050.Chin Med J (Engl) . 2024;137(21):2577-2582.
排版编辑:YX











 苏公网安备32059002004080号
苏公网安备32059002004080号


