2024年9月2日,国际知名期刊Frontiers in Medicine发表了一篇原创研究文章,该研究通过系统评价和荟萃分析对幽门螺杆菌根除对早期胃癌或异型增生内镜切除术后异时性胃癌或异型增生预防效果进行探讨。结果发现,幽门螺杆菌的持续感染可能增加内镜切除术后异时性胃癌或异型增生的风险,而根除幽门螺杆菌可显著降低此类风险,因此建议术后患者进行筛查并根除幽门螺杆菌[1]。【肿瘤资讯】整理该研究要点,以飨读者。
研究背景
胃癌是全球第五大常见癌症,也是癌症相关死亡的第四大原因[2,3]。2020年全球约有768,793例胃癌死亡病例,尤其在东亚地区发病率和死亡率显著更高。这一现象被认为与该地区特有的遗传风险因素及幽门螺杆菌(H.pylori)感染密切相关[4,5]。幽门螺杆菌作为一种致病细菌,能够定植于胃内并引发炎症,逐渐发展为萎缩性胃炎,进而导致胃癌,被认为是非贲门胃癌的主要危险因素[6]。
在胃癌的治疗方面,传统的胃切除术和淋巴结清扫术曾长期被视为标准治疗方法。然而,随着内镜技术的发展,内镜切除术(ER),包括内镜黏膜切除术(EMR)和内镜黏膜下剥离术(ESD),成为治疗早期胃癌(EGC)的常用方式[7,8]。现有研究表明,ER治疗后的长期生存率与手术切除效果相当,且由于手术创伤小,患者的恢复时间较短,因此在临床中得到广泛应用[9]。
尽管ER技术的广泛应用提升了治疗效果,但接受ER的患者发生异时性胃癌(MGC)的风险较高。尽管如此,研究表明,ER后发生的MGC可以通过再治疗成功控制,且不影响患者的总体生存率。针对这一问题,科学家们一直在研究与胃癌发展相关的生物学机制[10]。早在1975年,Correa等人提出了胃癌发生的级联反应模型,描述了胃癌的逐步发展过程:从正常胃黏膜,逐步经历非萎缩性胃炎、萎缩性胃炎、肠上皮化生、上皮内瘤变,最后发展为胃癌[11]。
幽门螺杆菌在内镜切除术后异时性胃病变(MGL)发展中的确切作用仍存争议。部分研究发现,ER后根除幽门螺杆菌可以降低MGC的风险,但也有研究质疑这一做法的效果[12]。因此,本研究旨在通过系统综述和荟萃分析评估幽门螺杆菌感染状态与MGL风险之间的关联,探讨ER后持续感染幽门螺杆菌是否会增加异时性胃病变的风险,以及根除该菌是否能有效降低该风险。
研究方法
该研究通过系统检索PubMed、Cochrane Library、MEDLINE和EMBASE数据库,筛选截至2023年10月31日的随机对照试验(RCT)或队列研究,评估内镜切除术(ER)后幽门螺杆菌感染与异时性胃病变(MGL)风险的关联。将患者分为幽门螺杆菌阴性组、根除组和持续感染组,比较各组MGL的发生率。使用R Studio软件进行荟萃分析,评估风险比(RR)和95%置信区间(CI),并通过I²和Cochran's Q检测异质性,使用固定或随机效应模型。敏感性分析和亚组分析(图1)。
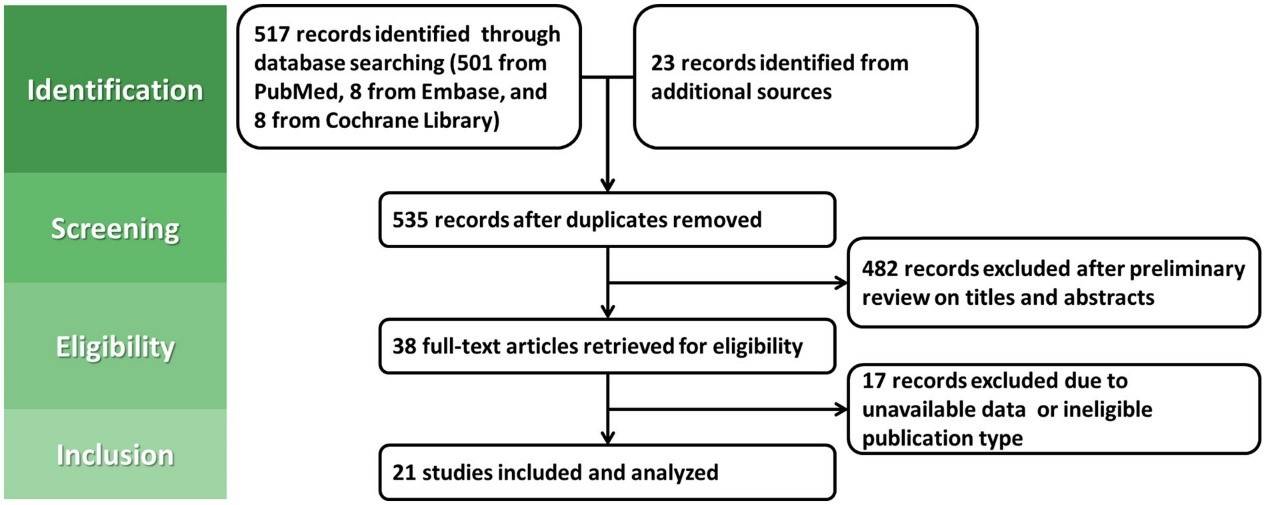 图1.研究流程图
图1.研究流程图
研究结果
该研究共纳入21项研究,包括3项RCT和18项队列研究,主要来自日本和韩国。结果显示,在38,931名接受幽门螺杆菌根除的患者中,有1,233名发生了MGL,而41,969名持续感染患者中有2,982名发生MGL。此外,在仅接受ER治疗的发育不良患者中,34,494名根除患者中有917名发生MGL,而36,059名持续感染患者中有2,469名发生MGL。
幽门螺杆菌持续感染与MGL风险相关的研究表明,持续感染患者的MGL风险有增加趋势,但尚未达到统计显著性(RR=1.58,95% CI=0.98–2.53)。在伴有发育不良的亚组中,幽门螺杆菌持续感染者的MGL风险显著增加(RR=3.80,95% CI=1.31–10.97)。相较于幽门螺杆菌阴性组,根除幽门螺杆菌的患者在ER后MGL风险大致相当(RR=0.79,95% CI=0.43–1.45)(表1,图2)。
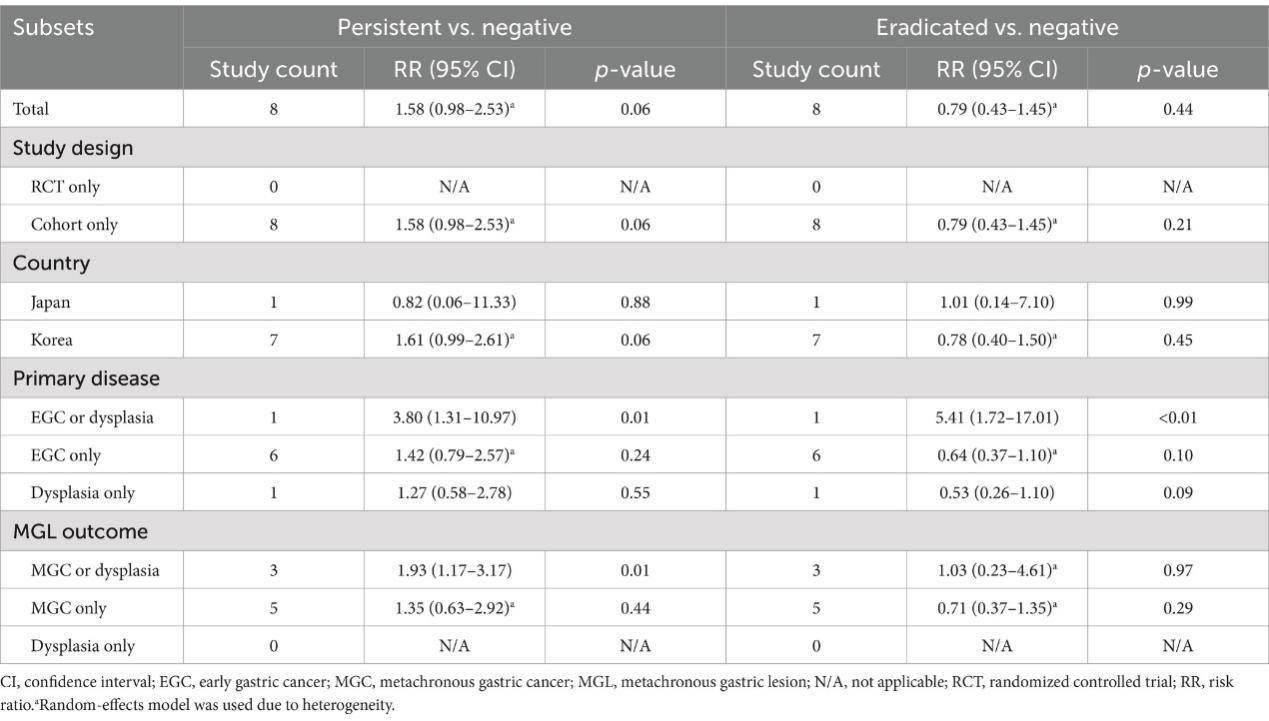
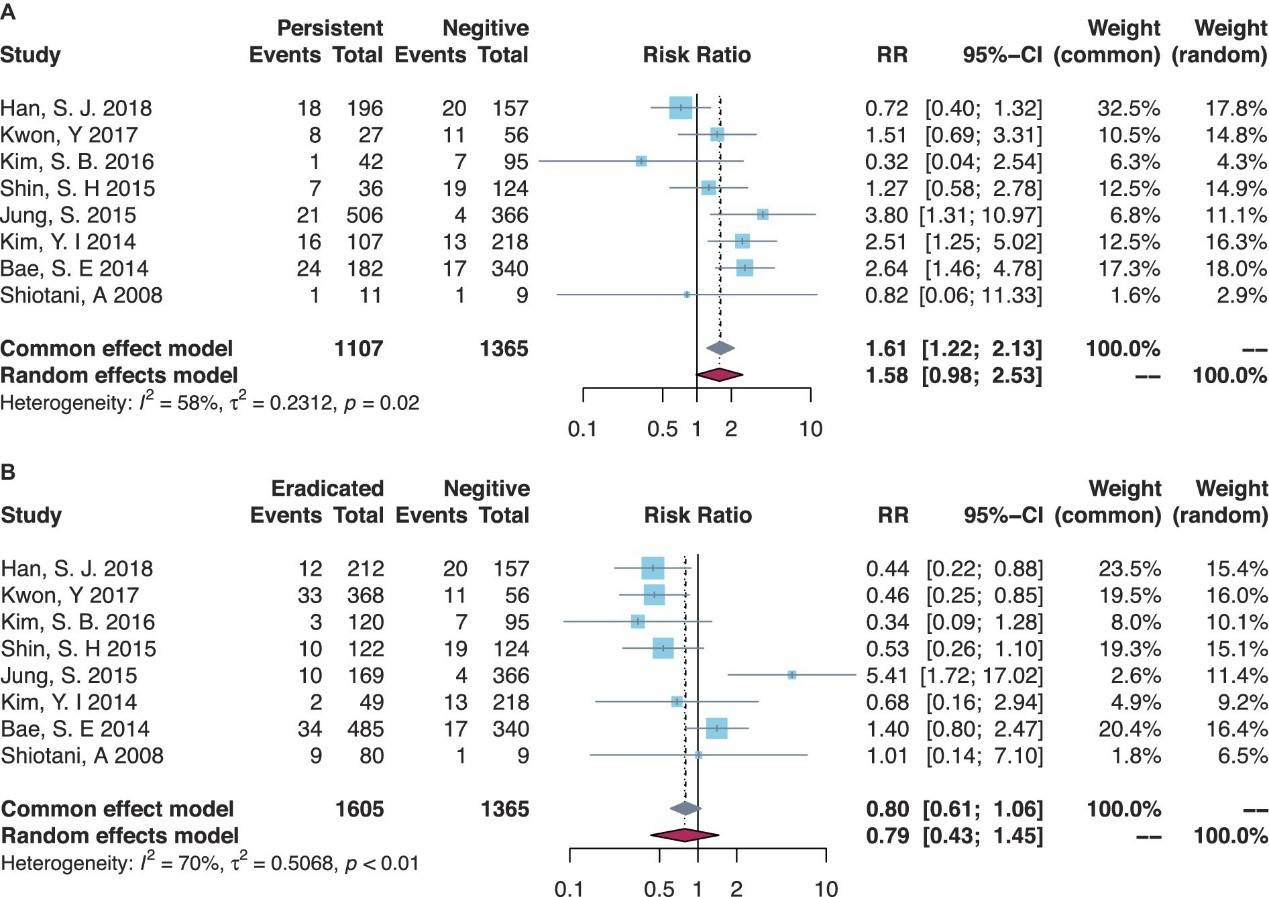
图2. H.pylori持续感染患者与阴性患者之间(A)以及根除患者与阴性患者之间(B)总体比较的森林图。
与持续感染组相比,根除幽门螺杆菌的患者发生MGL的风险显著降低(RR=0.54,95% CI=0.44–0.65)。亚组分析显示,幽门螺杆菌根除对预防MGL具有显著保护作用,无论是在早期胃癌(EGC)还是发育不良患者中,均表现出类似的效果。敏感性分析和出版偏倚检验均显示结果一致可靠。
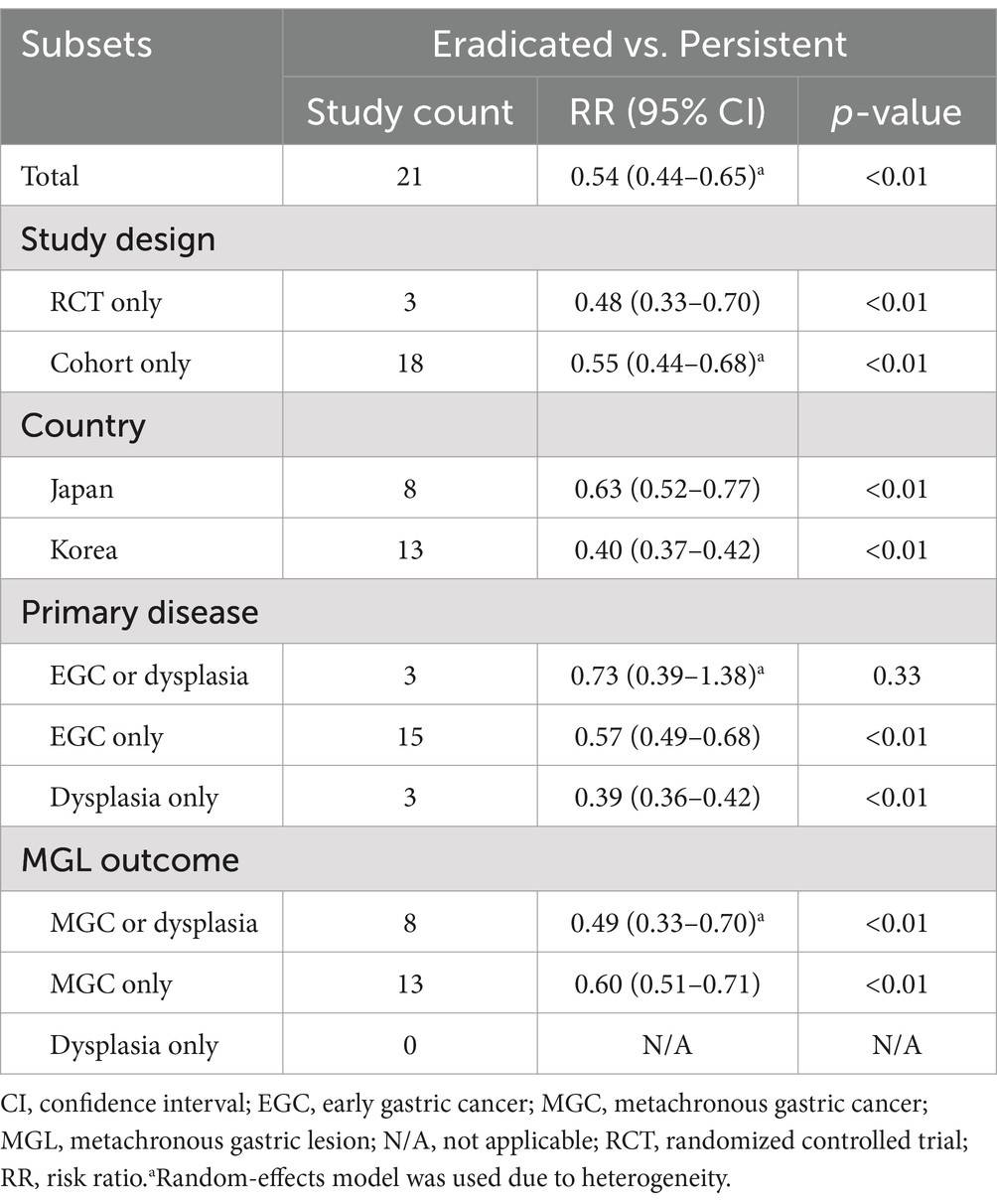
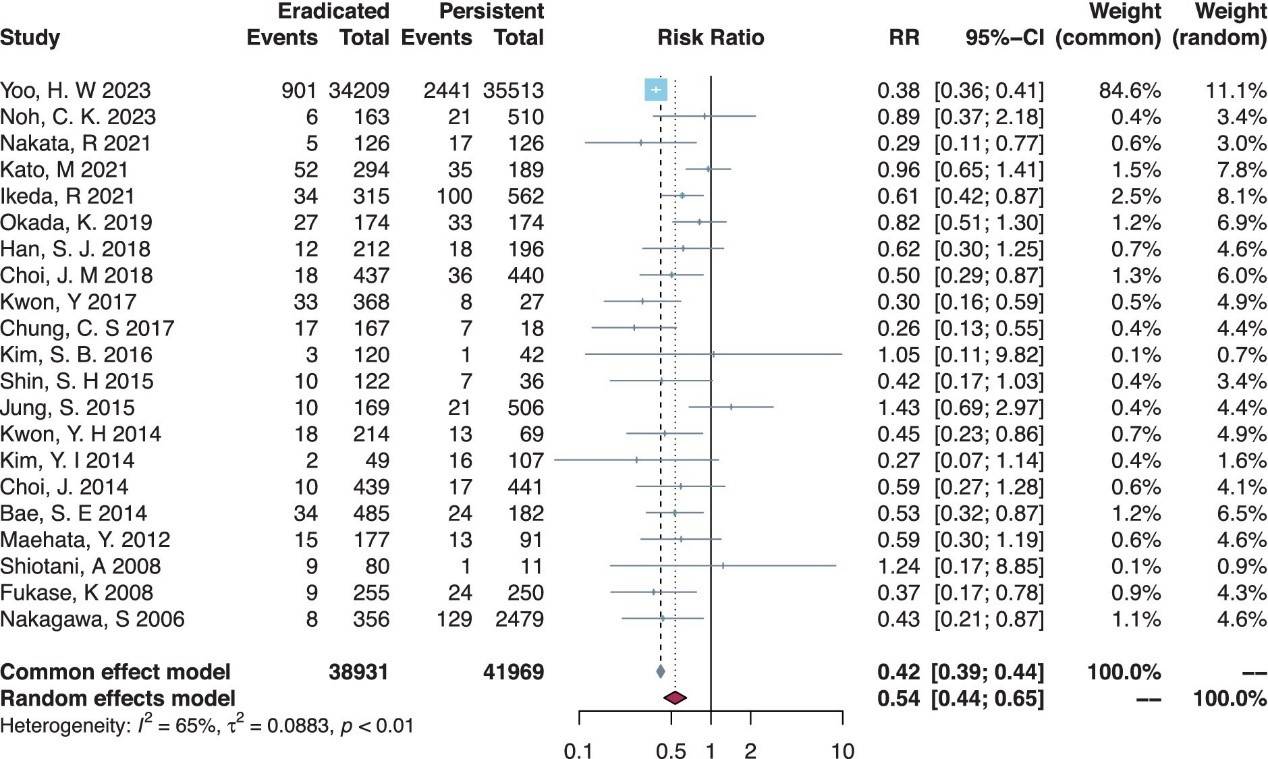
图3.幽门螺杆菌根除组与持续感染组患者总体比较的森林图。
研究讨论
本系统评价和荟萃分析纳入了21项研究,共82,256个观察结果,发现幽门螺杆菌持续感染者患MGL的风险显著高于从未感染者,但ER后成功根除幽门螺杆菌可以有效降低MGL的发生风险。尽管结果一致,荟萃分析中普遍存在异质性,因此采用了随机效应模型。研究指出,幽门螺杆菌感染是东亚地区尤其是中国胃癌的主要危险因素,根除该菌在降低胃癌发病率方面具有重要意义。然而,早期胃癌在中国的发病率相对较低,且胃癌筛查覆盖率不足,导致手术后MGC的风险增加。日本和韩国的ER管理经验更为丰富,表明通过内镜随访和幽门螺杆菌根除可以减少MGC的发生率。
尽管研究表明根除幽门螺杆菌对降低MGC的有效性,尤其是在长期随访中,仍存在一定的局限性。首先,纳入的研究均来自日本和韩国,结果的广泛适用性有待进一步验证。其次,纳入研究的随访时间较短,且部分研究未提供从幽门螺杆菌根除到ER的时间间隔,这可能对预防效果产生影响。此外,其他潜在的胃癌风险因素,如胃癌家族史和感染致癌病毒,尚未充分考虑。因此,未来研究应进一步优化随访策略,并评估其他混杂因素对MGL风险的影响。
结论
本荟萃分析明确显示,幽门螺杆菌感染可能增加ER后MGC或异型增生的发生风险,而成功根除幽门螺杆菌则显著降低该风险。因此,建议对所有ER术后患者进行幽门螺杆菌筛查和根除,以预防MGC或异型增生的发生。然而,为了进一步确定ER术后幽门螺杆菌感染者的最佳内镜监测方案,仍需进行更大规模且随访时间更长的RCT,以评估其成本效益和随访间隔。
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批编码:CN-145424
有效期至:2025-10-24
1. Yu TH, et al.Helicobacterpylori eradication following endoscopic resection might prevent metachronous gastric cancer: a systematic review and meta-analysis of studies from Japan and Korea. Front Med (Lausanne). 2024 Sep 2;11:1393498.
2. Smyth, Elizabeth C., et al. Gastric cancer. The Lancet 396.10251 (2020): 635-648.
3. Sung H, et al.Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249.
4. Arnold M, et al. Global Burden of 5 Major Types of Gastrointestinal Cancer. Gastroenterology. 2020 Jul;159(1):335-349.e15.
5. Bray F, et al. Cancer Incidence in Five Continents: Inclusion criteria, highlights from Volume X and the global status of cancer registration. Int J Cancer. 2015 Nov 1;137(9):2060-71.
6. Wang R, Chen XZ. High mortality from hepatic, gastric and esophageal cancers in mainland China: 40 years of experience and development. Clin Res Hepatol Gastroenterol. 2014 Dec;38(6):751-6.
7. Zhang WH, et al.Outcomes of surgical treatment for gastric cancer patients: 11-year experience of a Chinese high-volume hospital. Med Oncol. 2014 Sep;31(9):150.
8. Chen XZ, et al. Meta-analysis of effectiveness and safety of D2 plus para-aortic lymphadenectomy for resectable gastric cancer. J Am Coll Surg. 2010 Jan;210(1):100-5.
9. Choi KS, et al.EMR versus gastrectomy for intramucosal gastric cancer: comparison of long-term outcomes. Gastrointest Endosc. 2011 May;73(5):942-8.
10. Zavros Y, Merchant JL. The immune microenvironment in gastric adenocarcinoma. Nat Rev Gastroenterol Hepatol. 2022 Jul;19(7):451-467.
11. Correa P. Human gastric carcinogenesis: a multistep and multifactorial process--First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res. 1992 Dec 15;52(24):6735-40. PMID: 1458460.
12. Noh CK, et al.Effect of Helicobacter pylori Eradication Treatment on Metachronous Gastric Neoplasm Prevention Following Endoscopic Submucosal Dissection for Gastric Adenoma. J Clin Med. 2023 Feb 14;12(4):1512.
排版编辑:肿瘤资讯-Rex











 苏公网安备32059002004080号
苏公网安备32059002004080号


