
神经内分泌肿瘤(NEN)可发生于身体多个部位,其异质性较高,起源于神经内分泌细胞,常见于胃、肠、胰腺等消化系统。对于其中的神经内分泌瘤(NET),生长抑素类似物是重要的治疗手段,此外,化疗、靶向药物等也是常用的治疗药物。本期【望岳谈】分享一例48岁十二指肠NET患者,术后淋巴结复发后接受奥曲肽微球治疗,成功达到部分缓解(PR)疗效。特邀中山大学肿瘤防治中心崔伯康教授进行点评。
四川大学华西医院腹部肿瘤医师
四川省肿瘤学会人工智能与大数据专业委员会委员兼任专委会秘书
参与多项临床基金项目
病例分享
患者基本信息:
患者男,48岁。既往史、个人史、家族史无特殊。
ECOG PS 1分。
2021年3月主诉“体检发现十二指肠乳头肿瘤11天”就诊。
诊断经过
2021年3月外院腹部彩超示:胆总管下段似见低回声团。
2021年4月1日外院MRCP示:十二指肠乳头区异常信号影,多系肿瘤性病变,继发肝内外胆管,胰管扩张。为求进一步诊治,以“十二指肠乳头占位”收入我科。
2021年4月11日CT上腹部增强扫描示:肝内外胆管及胰管扩张,十二指肠大乳头区见类圆形软组织密度影,约2.2cm×2.1cm,强化程度略高于胰腺,强化较均匀,肠系膜根部见一枚增大淋巴结,考虑肿瘤可能,其它待排。
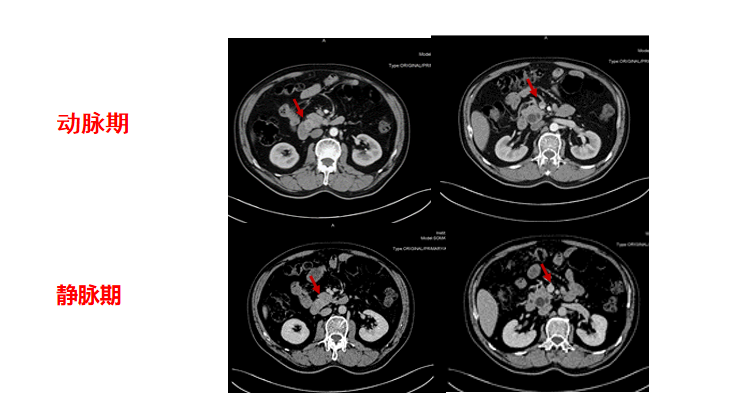
2021年4月12日上腹部MRI示:十二指肠大乳头区肿瘤可能性大,伴肠系膜根部肿大淋巴结(16mm),致胆道低位梗阻扩张(胆囊增大,肝内外胆管、胆总管及胰管扩张)。
2021年4月14日行经内镜逆行胰胆管造影(ERCP)。
手术方式:十二指肠镜检+活检。
术中见:十二指肠降段主乳头膨大,外观充血、水肿,活检4块,质地脆、易出血。十二指肠乳头占位,性质(?)。
病理:(十二指肠乳头)神经内分泌肿瘤,组织学形态及Ki67指数提示为NET1/G1。
免疫组化:肿瘤细胞CK(+)、EMA(+)、CgA(+)、Syn(+)、Ki67阳性率约1%。
手术治疗
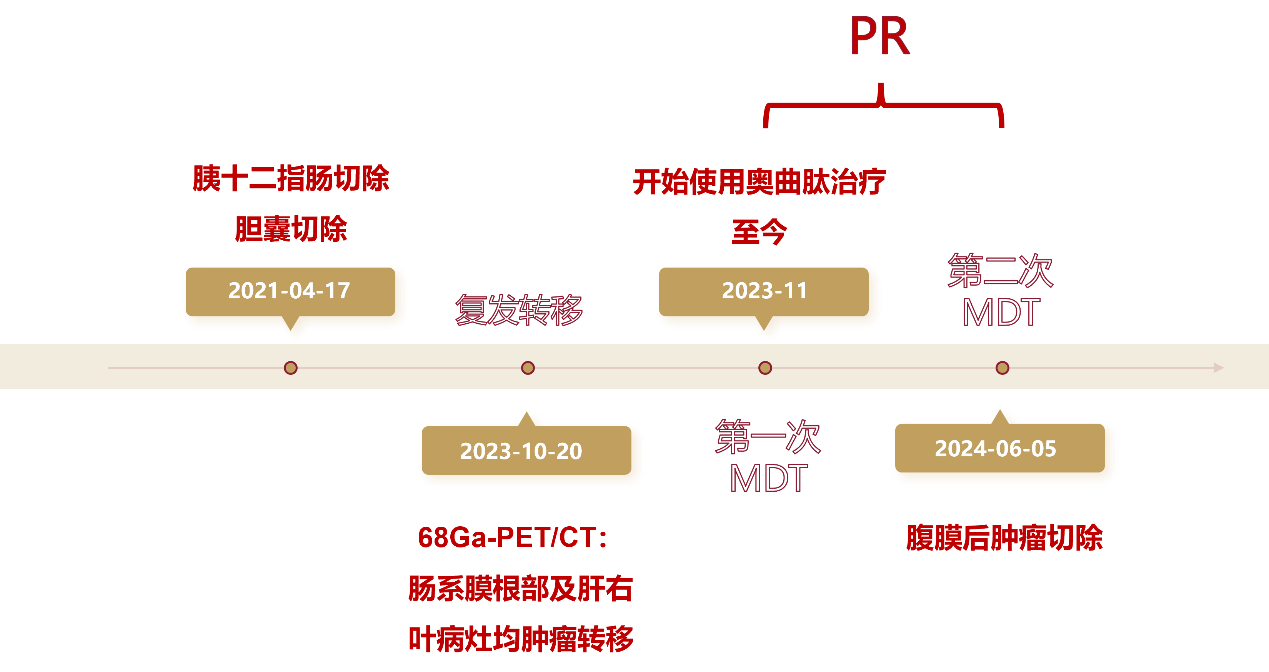
2021年4月17日在全麻下行“胰十二指肠切除、胆囊切除、门静脉修补、肝门胆管成形、肠粘连松解、腹腔恶性肿瘤特殊治疗术”。
术中见:大网膜、小网膜、横结肠系膜根部未扪及肿大淋巴结,肝十二指肠韧带后方、肝总动脉旁、胰头上方均未扪及肿大淋巴结;十二指肠乳头可扪及包块约2.0cm×2.0cm,质地硬,结肠与周围粘连。台下解剖标本见十二指肠乳头可见包块约2.0cm×2.0cm,质地硬,剖面呈鱼肉样改变。
术后病理:
病变部位:胰十二指肠。
标本类型:切除标本。
病理诊断:神经内分泌肿瘤(NET,G2),侵及十二指肠壁及胰腺。
标本胃断端、十二指肠断端、胰腺断端、胆管断端未见肿瘤。
“胆囊”示慢性胆囊炎,胆囊颈淋巴结1枚,呈反应性改变。
免疫组化示:肿瘤细胞呈PCK(+)、CgA(+)、Syn(+)、CD56(+)、CK20(-)、CDX2(弱+)、CK7(-)、CK19(弱+)、ATRX(+,未缺失)、SSTR-2(+)、Rb(+,未缺失)、Ki67(+,约5%)。
病理诊断:十二指肠神经内分泌瘤侵及胰腺(G2)术后,cT3N0M0 II期,非功能性。
复发转移
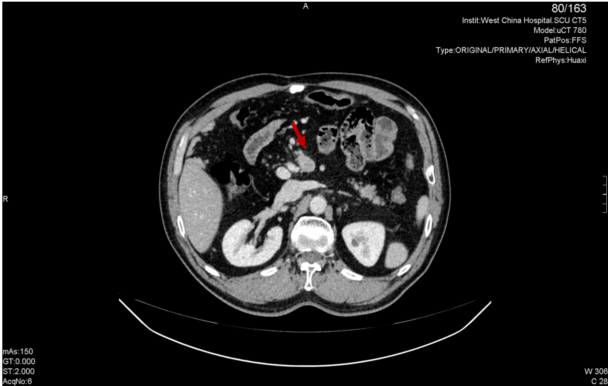
2021年4月20日,行全腹部CT:肠系膜根部见一枚增大淋巴结,考虑肿瘤可能,其它待排。
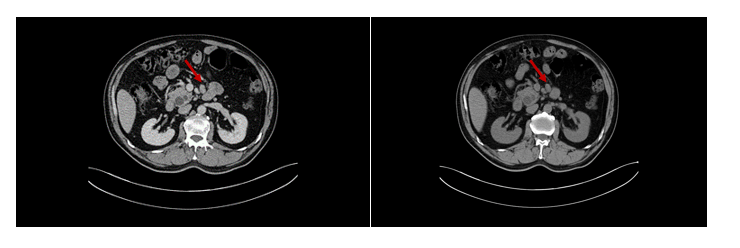
2023年9月21日,术后约2年半,复查CT上腹部平扫+增强扫描 :“十二指肠神经内分泌瘤术后,肠系膜根部结节,系淋巴结转移(?)其它(?)。
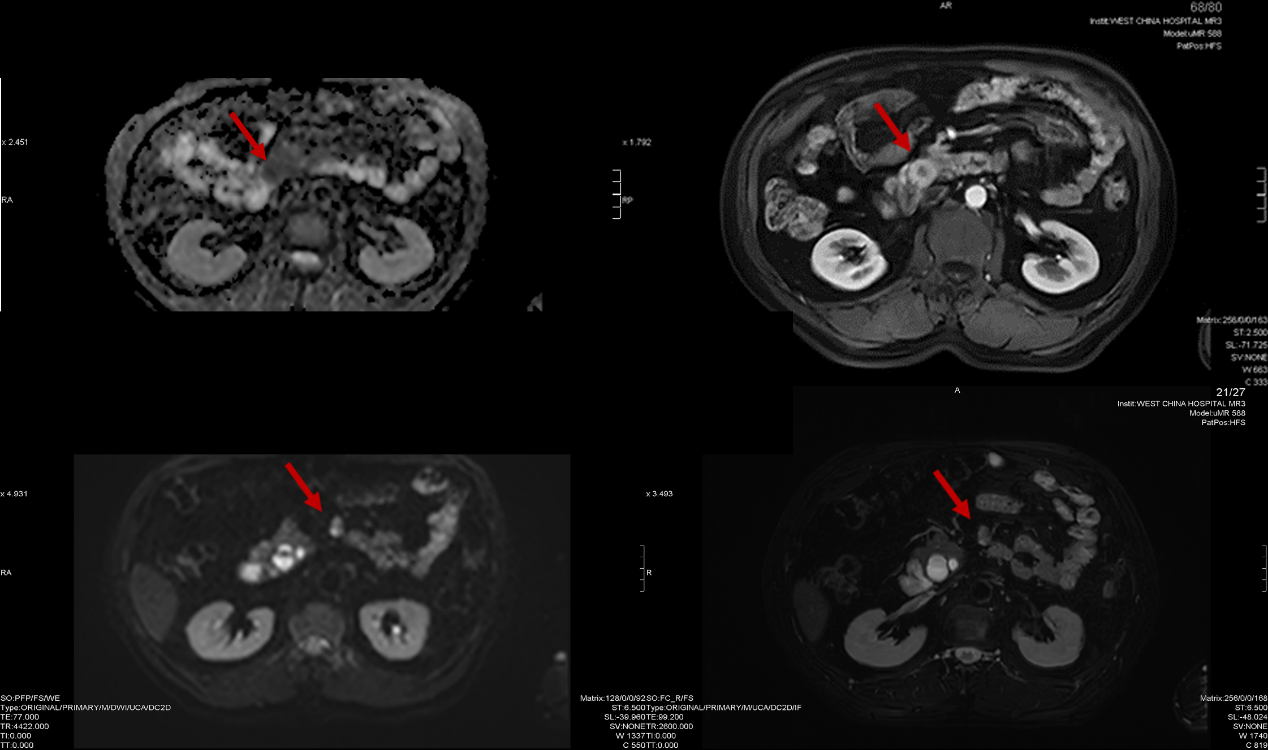
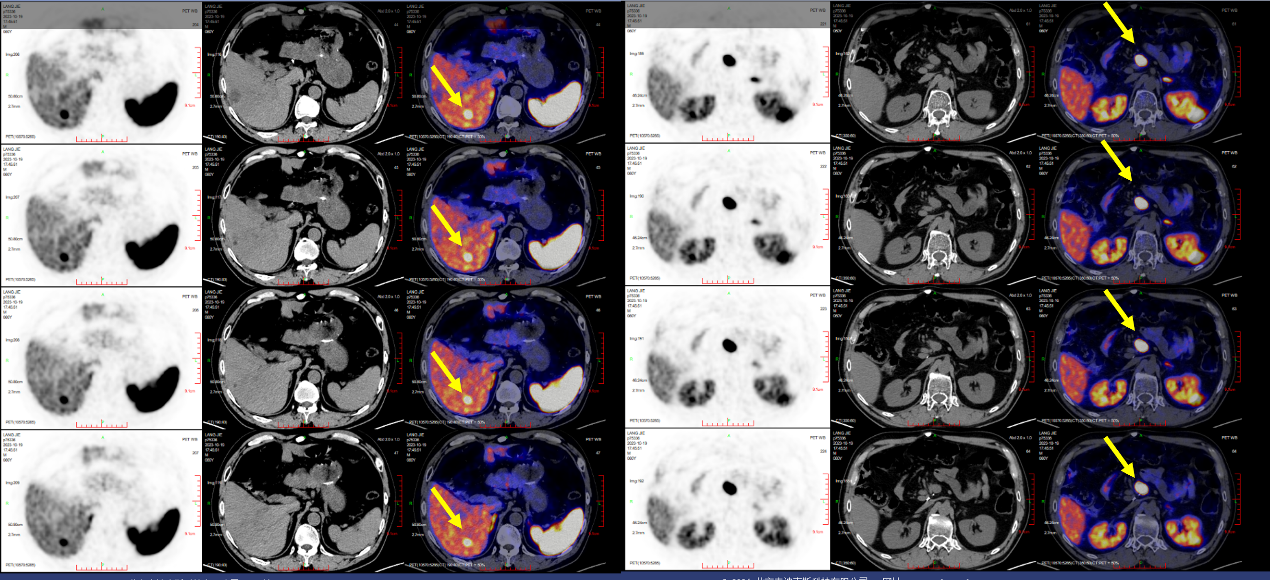
2023年10月20日,PET/CT生长抑素受体全身显像:
十二指肠神经内分泌瘤术后:
1. 肠系膜根部及肝右叶病灶均多系肿瘤转移。
肝右后叶下段局灶性68Ga-DOTATATE摄取增高灶,最大SUV为49.98,相应部位见一直径约10mm稍低密度结节影;肠系膜根部见一大小约24mm×12mm软组织结节,摄取68Ga-DOTATATE增高,最大SUV为92.36。
MDT讨论:
考虑诊断:十二指肠神经内分泌瘤侵及胰腺(G2)术后伴肝、肠系膜根部淋巴结转移(IV期 Ki67(+,约5%)。
下一步诊疗计划:患者术后复发转移,建议首选内科治疗。
结合患者病史:Ki67 偏低,建议首选奥曲肽治疗。
2023年11月起,开始使用奥曲肽微球治疗。
2024年1月,复查CT提示:肝脏病灶较前缩小,疗效评价PR。
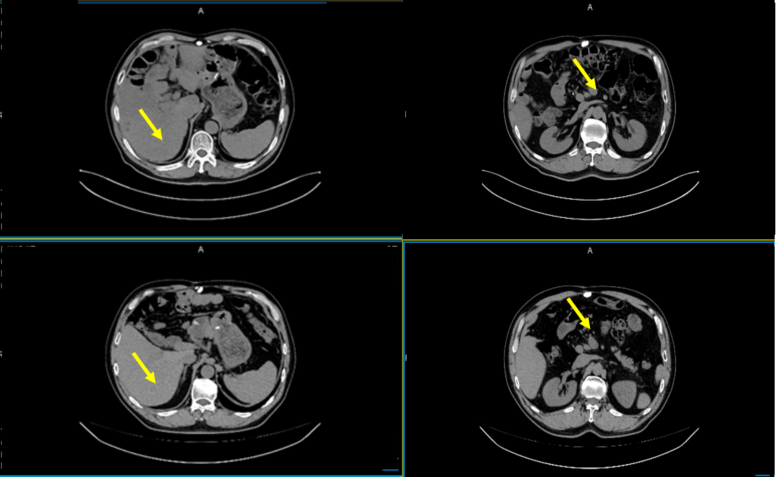
图6. 2023-01-26 疗效评估:PR
2024年5月13日复查CT提示:疗效评价PR。
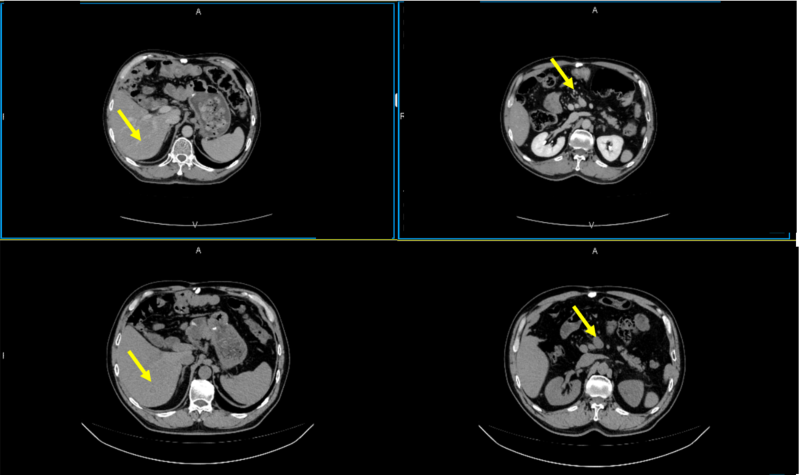
MDT:考虑手术切除转移灶。
2024年6月5日全麻下行腹膜后肿瘤切除、肠粘连松解术、肠破裂修补术。
术中见:肠系膜上动脉左侧扪及一2cm×2cm包块,边界欠清,质地中等,表面光滑。
术后病理:
病变部位:腹腔包块。
样本类型:切除。
病理诊断:肿瘤。
免疫组化结果:CK(Pan)(+)、Syn(+)、CgA(+)、CD56(+)、p53(部分+)、ACTH(-)、Glucagon(-)、Gastrin(-)、Somatostatin(-)、SSTR2(3+)、Insulin(-)、Ki-67(MIB-1)(+,约5%)。
综上,支持神经内分泌肿瘤,结合组织形态、免疫组化及临床病史,符合神经内分泌瘤(NET G2)。
术后患者继续使用奥曲肽微球治疗。
2024年7月20日复查胸腹部增强CT:结果未回示,术区未见异常,肝右后叶下段见占位,新增(?),还是肝脏转移灶较前增大(?)。
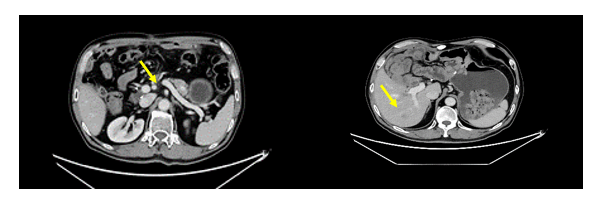
治疗小结
专家点评
中国抗癌协会肝癌专业委员会委员
中国健康管理学会肿瘤专委会委员
广东省抗癌协会肝癌专业委员会委员
广东省医学会肝胆胰外科学分会青年委员会副主委
广东省医学会外科学分会胰腺疾病学组委员
广东省肝脏病学会胆胰疾病专业委员会委员
广东省临床医学学会肝胆胰外科专委会委员
广东省健康管理学会肿瘤专委会常务委员
崔伯康教授:该患者术后诊断为十二指肠神经内分泌瘤侵及胰腺(G2),cT3N0M0 II期,非功能性。对于此类已经接受了根治性切除的患者,NCCN指南推荐采取术后观察策略,特别是该患者肿瘤仅为单发,大小约2cm,结合其Ki 67检查结果,最初的治疗选择正确。然而,病例并未报告术中淋巴结清理情况,病理结果未显示淋巴结转移结果。淋巴结转移与否是指导术后辅助治疗开展的重要高危因素,对于存在淋巴结转移的患者,可能需要采取更积极的辅助治疗策略。考虑患者术后不到一个月即发现肿大淋巴结,14a部位,提示可能在术前、术中忽略了该淋巴结,使其术后短期内复发。
患者术后复发后,经MDT讨论接受了奥曲肽微球治疗。奥曲肽微球在治疗过程中安全性较好,很多患者几乎未报告不良反应,仅偶有腹胀表现,大部分患者不会出现使用化疗、靶向药物常见的不良反应,如皮疹、腹泻等。这是奥曲肽微球的重要优势所在。
奥曲肽微球治疗适用于不可切除的患者,即类似该患者存在肝转移、淋巴结转移等多发转移的情况,此外患者应满足生长抑素受体阳性表达(SSTR2 +),以及Ki 67<10%,如果Ki 67表达更高,可能需要采取以化疗为代表的更为激进的治疗方法。在多中心、随机、双盲、安慰剂对照、IIIB期临床研究PROMID中,奥曲肽微球对比安慰剂一线治疗晚期高分化的功能性和非功能性肠NET,可以有效控制肿瘤生长,延长中位至进展时间2.4倍,达到14.3个月,显著降低66%的肿瘤进展风险[1]。
后续该患者通过二次手术切除了淋巴结腹腔肿物,不过未对肝脏转移灶做相关处理。因此术后一个半月复查再次发现可疑病灶。一些患者接受奥曲肽微球治疗后,可以获得很好的疗效,然而后续可能因耐药再次新发多发转移,这是临床中较为棘手的问题。目前该患者的治疗较为成功,疾病稳定,可以继续采取奥曲肽微球治疗,如果确认出现新的肝脏转移病灶或淋巴结转移病灶,可能需考虑小分子靶向药物进行治疗。
参考文献
[1] Rinke A, et al. J Clin Oncol. 2009 Oct 1:27(28): 4656-63.
排版编辑:肿瘤资讯-Zika











 苏公网安备32059002004080号
苏公网安备32059002004080号


