据全球最新癌症负担数据(GLOBOCAN 2020),全球胃癌新发病例数1089103,居恶性肿瘤第5位,死亡病例数768793,排名第3;我国胃癌新发病例数478508例,占全球胃癌新发病例数43.94%,死亡病例数373789,占全球胃癌死亡病例数48.62%[1];目前包括RATIONALE-305研究在内的多项III期临床研究已经证实免疫治疗的加入可以显著改善晚期HER2阴性胃癌患者的远期生存[2]。
患者基本情况及入院检查
患者,女性,64岁;
主因餐后腹胀2月余首次就诊;
查腹部增强MRI(2019年10月31日)示:1.胃窦部胃壁增厚,胃窦-十二指肠-胰头区巨大软组织团块,考虑恶性肿瘤性病变,建议胃镜进一步检查并活检;2.病变水平下腔静脉、右肾静脉、门静脉主干、肠系膜上动脉分支及胆总管受压,致肝内胆管扩张,门静脉主干局部及肠系膜上静脉充盈缺损,考虑癌栓;3.肝内多发异常信号,考虑转移;4.病变周围及腹主动脉旁多发肿大淋巴结,考虑转移。
胃镜(2019年11月8日):胃窦可见一环周溃疡型新生物,僵硬,表面覆污秽苔,侵及十二指肠降部。病理(2019年11月9日):腺癌。
既往10年前行“子宫切除术”,其他既往病史无特殊。
入院后查体:全身皮肤黏膜无黄染,结膜无苍白;上腹部可触及4×5cm质硬包块;有轻压痛,无反跳痛,肠鸣音正常;双下肢无凹形水肿。
临床诊断:胃窦腺癌IV期(cT4NxM1),HER2(-),PD-L1 TAP≥5。
治疗前检查及检验结果
1.颈胸腹增强CT( 2019年11月20日)示:胃窦壁增厚,符合胃癌表现;左侧锁骨上窝、腹腔及腹膜后多发肿大淋巴结,部分融合,考虑转移;肝门区及胰周软组织影,与胰腺及十二指肠分界不清,考虑转移;肝内多发低密度影,考虑转移;肠系膜上静脉及门静脉瘤栓。
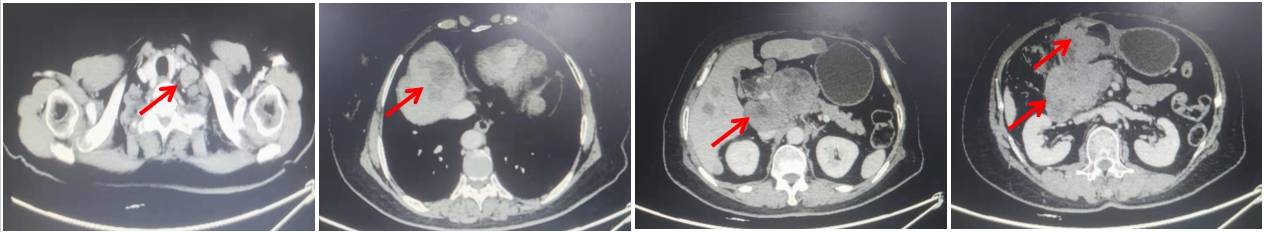 2.化验检查:CEA 37.0ng/mL↑, AFP >1210ng/mL↑, CA199 >1000U/mL↑, CA125 15.16U/mL。
2.化验检查:CEA 37.0ng/mL↑, AFP >1210ng/mL↑, CA199 >1000U/mL↑, CA125 15.16U/mL。
治疗经过
一线治疗
患者于2019年11月26日至2020年3月20日行一线替雷利珠单抗联合XELOX方案6周期治疗。
颈胸腹增强CT( 2020年2月25日)示:胃癌综合治疗后改变,胃窦壁不均匀增厚,较2020年1月8日片缩小;左侧锁骨上窝、腹腔及腹膜后多发肿大淋巴结,较前片部分缩小;肝内多发转移,较前片缩小;肠系膜上静脉内瘤栓。疗效评估为部分缓解(PR)。
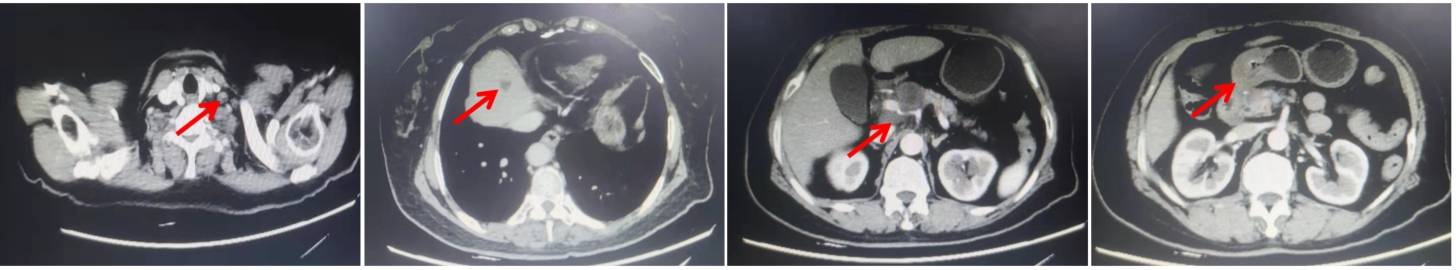 颈胸腹增强CT(2020年4月7日)示:胃癌综合治疗后改变,胃窦壁不均匀增厚,较2020年2月25日片缩小;左侧锁骨上窝、腹腔及腹膜后多发肿大淋巴结,较前片未见明显变化;肝内多发转移,较前片未见明显变化;肠系膜上静脉内瘤栓。疗效评估为PR。
颈胸腹增强CT(2020年4月7日)示:胃癌综合治疗后改变,胃窦壁不均匀增厚,较2020年2月25日片缩小;左侧锁骨上窝、腹腔及腹膜后多发肿大淋巴结,较前片未见明显变化;肝内多发转移,较前片未见明显变化;肠系膜上静脉内瘤栓。疗效评估为PR。
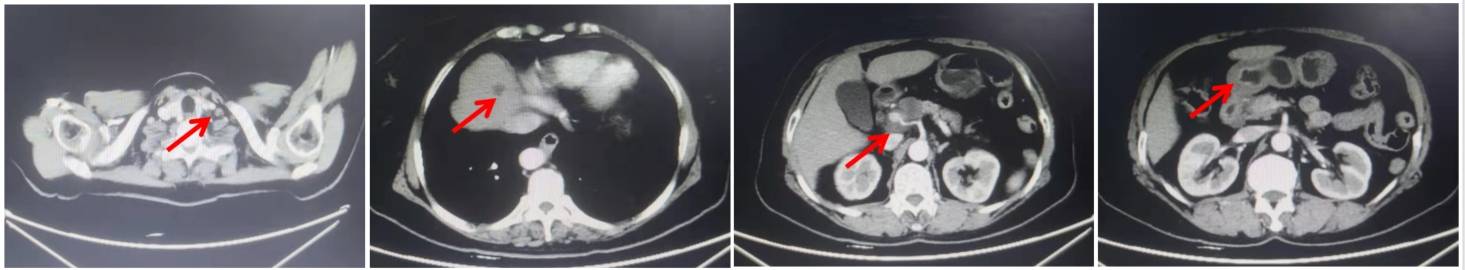 维持治疗:2020年4月11日至2022年6月10日开始行替雷利珠单抗联合卡培他滨维持治疗35个周期。
维持治疗:2020年4月11日至2022年6月10日开始行替雷利珠单抗联合卡培他滨维持治疗35个周期。
腹部增强CT(2022年5月19日)示:胃癌治疗后,胃窦壁增厚,较前片变化不大;胰头上方软组织影增多,较前未见明显变化;肝顶稍低密度,较前片未见明显变化。疗效评价为PR。
 治疗过程肿瘤标志物变化
治疗过程肿瘤标志物变化
一线治疗过程中的安全性
化疗相关:2级白细胞计数下降;3级中性粒细胞计数下降;
免疫相关:2020年9月23日甲功三项:TSH 41.85mIU/L↑,FT3 3.49pmol/L↓,FT4 6.72pmol/L↓,2级甲状腺功能减退,给予“优甲乐”50ug 1/日 口服,甲功控制良好;1级的皮肤红斑、皮疹;3级ALT升高;2级AST升高。
患者维持治疗期间因出现肝脏功能损伤(3级)且不能除外免疫性肝炎,同时患者免疫维持治疗满2年,因此2022年6月10日至2023年11月20日给予停药观察。期间未发生疾病进展,缓解持续时间(DOR)超过45个月。
期间规律复查,患者影像学提示疾病稳定,未新发病灶。2023年11月20临床疗效评价为临床完全缓解(cCR),经MDT讨论后考虑可行手术根治治疗,向患者家属交代病情及后续治疗方案,征求患者家属意见后于2023年11月24行腹腔镜探查术+开腹根治性远端胃大部切除术+毕Ⅱ式+Braun’s吻合术。
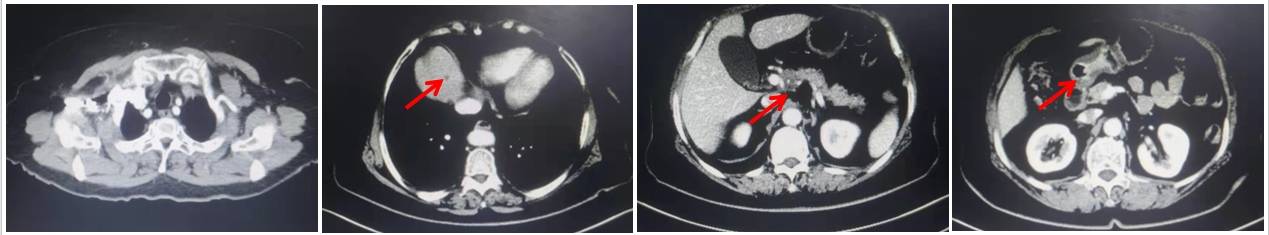
术前CT检查(2023年11月20日):胃癌治疗后,胃窦壁增厚,较2023年10月11日变化不大;幽门旁肿大淋巴结,胰头上方软组织影增多,较前未见明显变化;肝脏多发囊肿。
 术后病理:部分胃切除标本,胃大弯14cm,胃小弯9cm,距上残4cm,距下残2cm,胃窦小弯侧可见一个3cm×3cm的黏膜粗糙区。瘤床处未见残余癌,区域腺上皮低级别上皮内瘤变(肿瘤退缩分级0级)。临床上、下残(-)临床送检“淋巴结内容物”:坏死组织。淋巴结:1组0/4, 3组0/2, 4sb组0/1, 4d组0/2, 7组0/2,11组0/1, 12组0/1转移。临床送检“5组、6组、9组”:软组织(-)。送检“8组”:纤维化坏死结节。术后病理病理完全缓解(pCR)。
术后病理:部分胃切除标本,胃大弯14cm,胃小弯9cm,距上残4cm,距下残2cm,胃窦小弯侧可见一个3cm×3cm的黏膜粗糙区。瘤床处未见残余癌,区域腺上皮低级别上皮内瘤变(肿瘤退缩分级0级)。临床上、下残(-)临床送检“淋巴结内容物”:坏死组织。淋巴结:1组0/4, 3组0/2, 4sb组0/1, 4d组0/2, 7组0/2,11组0/1, 12组0/1转移。临床送检“5组、6组、9组”:软组织(-)。送检“8组”:纤维化坏死结节。术后病理病理完全缓解(pCR)。
术后复查腹部CT检查(2023年12月27日)提示:肝脏表面光滑,各叶比例无异常,肝内外胆管无扩张,肝内未见占位征象,胆囊不大,壁不厚,内见阴性结石,胰腺形态无异常,主胰管未见扩张,脾脏大小,形态无异常,未见异常密度改变,胃术后改变,术区脂肪间隙模糊,可见线样高密度影吻合口不厚,腹部皮下脂肪间隙模糊。
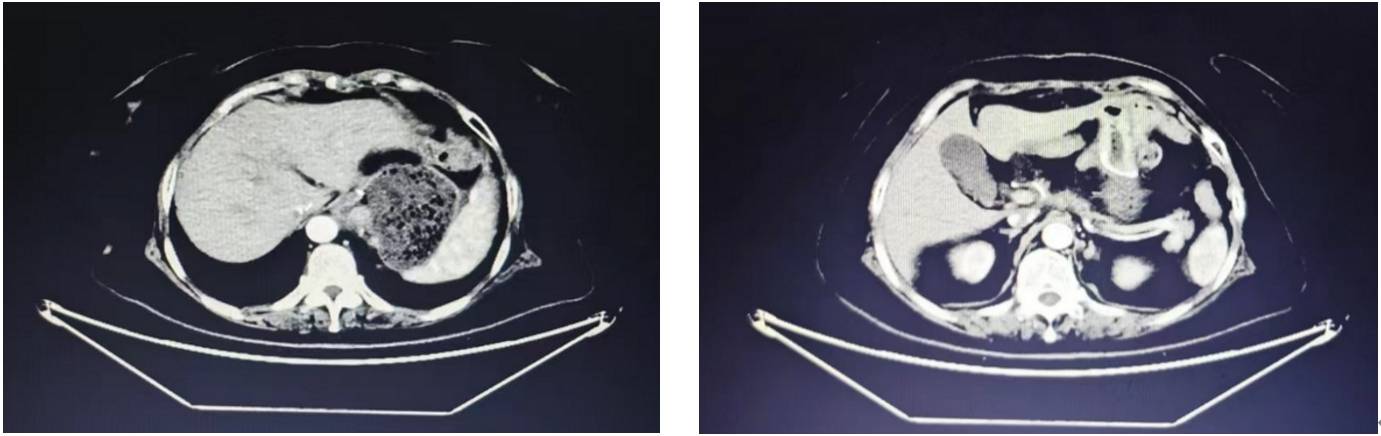 该患者初诊为胃窦腺癌IV期,经替雷利珠单抗联合化疗治疗后DOR超过45个月,后成功行手术治疗,且术后病理为pCR,让患者“重获新生”。
该患者初诊为胃窦腺癌IV期,经替雷利珠单抗联合化疗治疗后DOR超过45个月,后成功行手术治疗,且术后病理为pCR,让患者“重获新生”。
本期特邀专家——李 南 教授
河北医科大学第四医院 消化内科 主治医师
河北省医学会消化分会肿瘤学组秘书
本期特邀专家——王英南 教授
河北医科大学第四医院消化内科主治医师,医学博士
北京癌症防治学会食管癌专业委员会青年委员会委员
河北省肿瘤防治联合会脑转移瘤专业委员会委员
河北省医药行业协会青年医师专业委员会委员
主要从事消化道肿瘤的内科治疗和临床研究,荣获河北省卫生厅一等奖2项,河北省科技厅三等奖1项,发表学术论文10余篇,SCI文章4篇
本期特邀专家——张瑞星 教授
河北医科大学第四医院消化内科主任
河北省医学会消化分会副主任委员
河北省医学会消化分会肿瘤学组组长
中国抗癌协会(CSCO)GIST专家委员会委员
中华医学会消化分会专科建设与医学人文协作组成员
河北省抗癌协会胃癌专业委员会副主任委员
河北省抗癌协会肝癌专业委员会副主任委员
北京癌症防治学会胃癌防治专委会常委
专家点评
该患者初诊为胃窦腺癌IV期(cT4NxM1),HER2(-),PD-L1 TAP≥5;伴全身多发脏器转移。一线经替雷利珠单抗联合XELOX方案治疗后疗效评价持续为PR状态, DOR超过45个月,在后续维持治疗过程中患者达到临床cCR状态,最终在MDT讨论后患者成功实施R0切除术,且术后病理状态为pCR;免疫治疗的加入让患者从死亡边缘转为“重获新生”。但是针对这例患者还是有很多值得思考的地方:
1. 患者治疗前PD-L1 TAP≥5,是免疫治疗的优势人群;目前公认的筛选胃癌免疫治疗优势人群除了PD-L1高表达/EBV(+)/MSI-H/高AFP,后续胃癌的治疗还需要筛选更多的biomarker,让胃癌治疗更加精准化;
2. 转化手术的时机:这例患者是在停药观察1年多后病情持续稳定经过MDT讨论后实施手术切除,且术后病理为pCR。出于卫生经济学和患者获益考虑对于晚期胃癌的转化治疗的手术时机是否可以再提前,例如在病情稳定后的3~6个月内行手术治疗;
3. 患者术前一线已经行35个周期的免疫治疗,在术后病理为pCR的情况下是否有必要做适当的术后辅助治疗以降低局部复发和远处转移风险,还是暂时继续观察待疾病进展后考虑免疫再挑战值得后续去思考和探索。
1. Data source: Globocan 2020;
2. Qiu MZ, et al. BMJ. 2024 May 28;385:e078876.
排版编辑:肿瘤资讯-高惠
下期预告
后腹膜淋巴结转移晚期胃癌患者经替雷利珠单抗联合化疗治疗后获得长期生存
往期回顾:
【胃癌】转“胃”为安——一例转移性胃癌患者经替雷利珠单抗联合SOX治疗后成功转化达到病理完全缓解
【胃癌】救难“介胃”,白鱼“入”舟——一例转移性胃癌患者经替雷利珠单抗联合介入后达到完全缓解并长期获益
【胃癌】“胃”来可期:一例HER2阳性胃癌患者围术期应用替雷利珠单抗联合方案达到病理完全缓解并长期获益
【胃癌】替雷利珠单抗联合化疗为晚期多发转移胃癌带来持久获益:持续PR至今,PFS已超17个月
【胃癌】一例胃癌肝转移患者经替雷利珠单抗联合化疗方案后获得手术机会并获得长期生存
【胃癌】一例食管胃结合部腺癌患者围手术期应用替雷利珠单抗联合方案达到病理完全缓解并长期获益











 苏公网安备32059002004080号
苏公网安备32059002004080号


