2024年3月14日,美国FDA召开了一场ODAC(肿瘤药物咨询委员会)会议,讨论一款同类首创的端粒酶抑制剂伊美司他(imetelstat)对较低危(LR)骨髓增生异常综合征(MDS)患者的疗效问题。召开此次会议的原因为,FDA认为,在伊美司他用于对红细胞生成刺激剂(ESA)耐药的LR-MDS人群的关键性MDS 3001 Ⅲ期研究中,虽然结果达到了主要终点8周红细胞输注不依赖(RBC-TI)和关键次要终点24周RBC-TI的统计学目标,然而,在反映疾病改善效应的其他次要终点上,包括红系造血改善(HI-E)、完全缓解(CR)/部分缓解(PR)和总生存(OS)均未观察到有显著改善。
最终,委员会专家以12票赞成、2票反对的投票结果,认为对于国际预后评分系统(IPSS)低至中-1风险的MDS成人患者,对ESA无反应或失去反应或不适用时,使用伊美司他治疗输血依赖性贫血,获益超过风险。
2024年10月8日19:30,中国医学科学院肿瘤医院GCP中心发起的临床研究大查房·监管科学系列之“FDA创新药物审评原则深度解析”第五期开播。本期会议由中国医学科学院肿瘤医院副院长李宁教授主持,中国医学科学院肿瘤医院GCP中心研究医生蒋雅乐博士介绍背景,清华大学医学院临床试验中心执行主任陈晓媛教授、中国医学科学院血液病医院MDS诊疗中心李冰教授、天津市海河医院血液科主任胡耐博教授、愈方生物创始人&CEO许效博士和愈方生物创始人&CSO张家毓博士参与讨论,对该期ODAC会议内容进行了复盘与深度解析。
讨论1:伊美司他从2005年制备成功到2023年申请上市,为何历经近20年?是药物机制问题还是临床验证难度问题?
许效博士:从药物开发的角度,端粒和端粒酶有三种开发思路。一是针对增生性的疾病如肿瘤,需要抑制端粒或端粒酶的活性;二是针对衰老性的疾病如阿尔茨海默症,需要延长端粒或激活端粒酶的活性。这两种开发都需要将药物精准地递送到细胞,否则就会产生很大的毒性,而在二三十年前,精准递送是很难做到的。第三种开发思路是调控端粒,针对的是心脏和神经这样的微分裂细胞,递送没有活性的端粒酶,这种方式产生的副作用比较小。
张家毓博士:之所以经历了这么长的时间,原因有如下几点。首先,端粒酶在大部分细胞中不表达,只在需要保证修复能力的细胞中表达,包括正常的干细胞以及肿瘤细胞。端粒酶抑制剂对端粒酶的作用是竞争性抑制而非溶解,通过抑制端粒酶而阻止端粒的延长,进而抑制肿瘤细胞的增殖,这种竞争性抑制是有难度的。第二,Geron公司当初开发伊美司他时,科学家对端粒和端粒酶的结构还了解不多,在当时的技术背景下,伊美司他的设计比较粗犷,基本上是模拟了人类的端粒酶RNA模板,在进入体内后,需要穿透细胞膜和核膜才能进入细胞核内作用于端粒酶,这种分布与代谢是非常困难的。第三,伊美司他作用于端粒酶后,细胞的分裂并不能马上停止,而肿瘤细胞的增殖速度又很快,因此伊美司他将随细胞的增殖而被稀释,如何在这种代谢条件下捕捉合适的药效窗口而又毒性可控也是有难度的。
讨论2:MDS是恶性肿瘤性疾病吗?其贫血原因是红细胞生成减少、无效造血还是红细胞运载能力下降?
李冰教授:WHO将MDS定义为肿瘤性疾病,但“恶性”这个词并不适用于所有患者,因为低危的患者中位生存期甚至超过5年,但其本质是肿瘤性质,是由干细胞突变驱动的不受控制的克隆性增生,因此大多数患者都伴有染色体核型异常或基因突变。其贫血原因有:①骨髓中的坏细胞过多,压制了正常细胞造血;②髓系细胞发育异常,导致无效造血,生成的红细胞不能发挥正常功能或存活时间变短。
讨论3:MDS3001的主要研究终点为什么选择了一个非生存的终点——8周不依赖输血率?
陈晓媛教授:首先,MDS尤其是低危MDS患者的生存时间通常都比较长,而影响总生存(OS)的因素比较多,以OS作为主要研究终点未必能反映治疗药物的疗效;第二,对于输血依赖的LR-MDS患者,输血改善意味着活得更好,其本身就是一个很重要的治疗目标。8周不依赖输血是申办方与FDA沟通后设定的终点,当然FDA也提醒申办方会结合其他指标来综合评估疗效。
讨论4:MDS治疗的临床需求是什么?是如MDS3001方案所设计的脱离输血吗?输血的标准又是什么?
胡耐博教授:MDS患者需要定期输血,如果不能及时输血会像挠脚心一样难受,虽然输血本身会导致铁过载及增加白血病转化的风险,但相对于不能输血带来的痛苦,这已经不是患者首要考虑的问题了。
李冰教授:对于像MDS这样的慢性髓系血液病,长期贫血对于患者心理和生活质量的影响以及对疾病危险度的影响都超过了白细胞减少、粒细胞缺乏和血小板减少带来的影响。而且,MDS是老年性疾病,贫血带来的相关并发症可能导致患者死亡,这种死亡风险超过了感染和出血而导致的死亡风险。因此,即使伊美司他无生存获益,能减少输血依赖也是有意义的。至于输血的标准,不同国家和地区因国情、医疗制度、文化、宗教信仰以及患者个体的自我感受等的不同而不同。我个人更倾向于以血红蛋白绝对值升高的水平以及维持时间来作为评估的标准,这在国内可能来讲会更客观一些。
讨论5:安慰剂组有37%的患者出现了端粒酶活性的下降,其机制是什么?
张家毓博士:第一可能是患者病情恶化,造血干细胞和祖细胞的比例总体下降;第二,细胞在极度衰老的时候,端粒酶的活性会被抑制,而在检测端粒酶活性的时候,我们无法保证所检测的细胞是同一阶层的。
讨论6:持续输血会延长MDS患者的生存吗?
胡耐博教授:答案是否定的。一是输血会造成铁过载,铁过载会增加氧自由基,进而加重造血衰竭和恶性克隆;二是长期反复输血会使体内产生同种异型抗体,导致输入的红细胞寿命越来越短,输血间期越来越短,疾病进展风险越来越大。MDS本身是一种衰竭性疾病,输血越多,衰竭越重,向恶性克隆的进展越快,OS更短。
讨论7:伊美司他组输血减少,但OS没有相应的获益,这是为什么?
胡耐博教授:伊美司他是一个端粒酶抑制剂,而MDS是一种衰竭性疾病,端粒酶的抑制可能加重了MDS的骨髓衰竭,虽然说造血异常的具有肿瘤性质的细胞的端粒酶也会受到抑制,但在筛选压力下,这类细胞也可以通过不依赖端粒酶的其他途径如同源重组的途径进行扩增。
讨论8:减少输血次数对MDS患者来说很重要吗?监管方在药物审评时有必要倾听患者的声音吗?
陈晓媛教授:以患者为中心、倾听患者的声音,这是药物监管的大趋势。监管方在考虑以何种指标来判断临床获益的时候,的确是要了解真正使用这个药物的患者的心声,了解患者希望达到怎样的预期目标,FDA的每场ODAC会议都会邀请患者代表发声。当然,患者的声音要客观地采信,数据还是第一位的,在此基础上兼顾考虑患者的声音。
就这个问题,蒋雅乐博士事先采访了两位输血依赖的MDS患者及家属:
讨论9:伊美司他组3~4级白细胞减少和血小板减少发生率增加,这种血液学毒性在临床上可控吗?发生血液学毒性的机制是什么?
李冰教授:白细胞减少和血小板减少对血液科医生来说都是比较容易处理的,而且在真实世界中,伊美司他不会单药应用,我们会配合其他药物应用,在保证安全性的同时,甚至有可能达到1+1>2的效果。
张家毓博士:MDS患者的骨髓中,既有健康的造血细胞,也有肿瘤性的造血细胞,当然肿瘤细胞的繁殖更快,我们是期望端粒酶抑制剂将坏的造血细胞压制,释放空间给健康的细胞造血,但端粒酶抑制剂对这两种细胞的无差别攻击也可能会造成血细胞的减少。
讨论10:如何看待患者自报告结局(PRO)这个指标在评价药物获益-风险中的价值?PRO可以作为主要研究终点吗?
胡耐博教授:PRO量表的填写具有主观性,在评价药物的获益-风险时,PRO只能作为辅助,不能作为主要的证据指标。
陈晓媛教授:PRO的数据质量往往存在很多问题,到目前为止,还没有任何一个产品是单独以PRO作为主要终点批准的,能基于PRO批准也基本是因为某一种症状的改善。
李宁教授:做一个新药、尤其是做一个first-in-class的新药不易,MDS的临床治疗需求尚未被满足,伊美司他至少是满足了减少患者输血这个需求,未来我们也要满足延长患者生存的需求,希望有更多的研发力量投入到这个领域,为MDS治疗需求的满足贡献力量。
关于MDS
MDS是由造血祖细胞的克隆扩增引起的一组异质性疾病,其引发骨髓增生异常、无效造血,并有转化为急性髓性白血病的高风险。MDS按国际预后评分系统(IPSS)分为2组:较低危(lower risk)组(包括IPSS低危组和中危-1组)和较高危(higher risk)组(包括IPSS中危-2组和高危组)。较低危MDS(LR-MDS)患者大多遭受贫血的折磨,并因贫血对生活质量产生负面影响,而贫血和输血依赖也与MDS患者的生存期缩短相关。由LR-MDS引起的输血依赖性贫血的一线治疗包括ESA和罗特西普。一旦ESA治疗复发/难治,只有2种FDA批准的药物可用:罗特西普和来那度胺,这两种药物仅限于特定亚组的患者使用:来那度胺的批准仅限于伴有del5q染色体异常的患者(约10%的MDS人群),而罗特西普仅限于骨髓检查发现环形铁粒幼细胞(RS+)发育异常的患者(约35%的MDS人群)。因此,ESA复发/难治LR MDS患者的治疗存在高度未满足的需求。
关于端粒、端粒酶和imetelstat
端粒是位于染色体末端的重复DNA序列,随细胞分裂次数的增加而逐渐缩短,在一定数量的分裂后,端粒长度缩短至临界长度,会阻止进一步的细胞分裂,导致细胞衰老或凋亡。
端粒酶是一种通过在端粒末端添加核苷酸来维持端粒长度的酶,防止细胞分裂期间端粒缩短。端粒酶在MDS患者的恶性骨髓细胞中高度表达,使得端粒酶成为LR-MDS的治疗靶点。
伊美司他是Geron公司研发的同类首创的(first-in-class)端粒酶活性竞争性抑制剂。2023年6月16日,Geron提交新药申请(NDA),申请伊美司他用于不适合ESA治疗或ESA治疗失败后的LR-MDS患者的输血依赖性贫血。申请依据为MDS3001研究的结果。
关于MDS3001
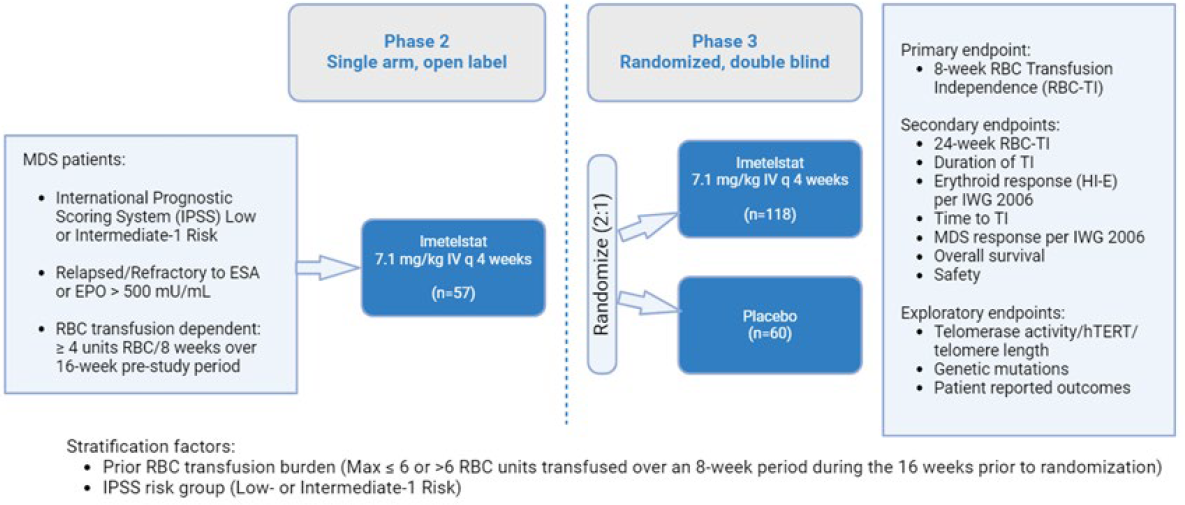
MDS3001是一项全球、多中心、Ⅱ/Ⅲ期研究,在患有输血依赖性贫血伴IPSS定义的低危或中危-1 MDS且不适合ESA治疗或ESA治疗后复发/难治性(R/R)的患者中开展。该研究由两部分组成:第1部分是单臂、开放标签的Ⅱ期试验;第2部分是随机、双盲、安慰剂对照的Ⅲ期试验。在Ⅱ期研究入组了32例患者时,申办方在非del5q和未用过低甲基化药物或来那度胺的亚组中观察到更好的8周红细胞(RBC)输注不依赖(TI)应答。因此定义了以下“目标人群”,并相应增加了Ⅱ期研究剩余部分和整个III期研究的入组要求:非del5q核型;既往未接受过低甲基化药物或来那度胺。III期研究共入组178例患者,以2∶1的比例随机接受伊美司他(n=118)或安慰剂(n=60)治疗。Ⅲ期的主要终点是8周RBC-TI(任何时间连续8周),关键次要终点为24周RBC-TI(任何时间连续24周)。其他次要终点包括TI持久性、根据IWG 2006评估的HI-E率、至TI时间、根据IWG 2006评估的MDS缓解情况、OS和安全性。PRO为探索性终点。

III期研究达到了主要终点:伊美司他组和安慰剂组的8周RBC-TI率分别为39.8%和15.0%(P≤0.001),24周RBC-TI率分别为28.0%和3.3%(P≤0.001)。
FDA的质疑
FDA承认,MDS 3001 III期研究的结果达到了主要终点8周RBC-TI和关键次要终点24周RBC-TI的统计学目标,然而,在反映疾病改善效应的其他次要终点上,包括HI-E(63.6% vs 51.7%)、CR/PR(0% vs 0%)和OS(HR=0.98)均未观察到统计学显著性。此外,MDS 3001 Ⅲ期研究中收集的PRO未反映疲乏或其他贫血相关症状的改善。由于MDS 3001中的绝大多数患者(93%)在非美国研究中心入组,而美国和非美国研究中心之间的主要疗效结果差异很大,因此试验结果对美国人群的适用性存在不确定性。安全性方面,MDS 3001 III期研究伊美司他组血细胞减少发生率更高,因血细胞减少而需要的干预更多,患者感染或出血的风险也更高。
讨论问题
根据MDS 3001研究的结果,结合其安全性特征,讨论伊美司他对LR-MDS患者的疗效。
投票问题
IPSS低至中-1风险的MDS成人患者,对ESA无反应或失去反应或不适用时,使用伊美司他治疗输血依赖性贫血是否利大于弊?
排版编辑:肿瘤资讯-Shelley











 苏公网安备32059002004080号
苏公网安备32059002004080号


