急性早幼粒细胞白血病(Acute Promyelocytic Leukemia, APL)是一种以早幼粒细胞异常增生为特征的急性髓系白血病(AML),约占急性非淋巴细胞白血病的5%~10%,具有独特的临床和生物学特征[1]。APL通常被认为是一种临床表现极其凶险的白血病类型,患者常伴有严重的凝血异常,如不及时治疗,可能导致严重的出血和器官功能衰竭,增加死亡风险。2024年9月,中国学者在血液学重磅期刊Haematology发表了一例罕见的APL患者,患者呈PLZF-RARα阳性。经过初步的全反式维甲酸(ATRA)、三氧化二砷(ATO)治疗无效后,联合使用维奈克拉和去甲基化药物地西他滨进行救治,最终实现了形态学缓解和PLZF/RARα基因阴性[2]。

病例介绍:一例罕见基因融合PLZF-RARα阳性APL患者的诊疗历程
这是一例 47 岁女性患者,2021 年 10 月因皮肤瘀点、瘀斑就诊于当地医院。血常规检查显示血小板和血红蛋白降低,骨髓涂片提示 APL。43 种白血病融合基因的 PCR 分析显示 PLZF-RARα 阳性。基于分子生物学证据,该患者被诊断为“PLZF-RARα (+) 的 APL”。患者在当地医院接受了一个疗程的 ATRA 和 As2O3 治疗,诱导治疗后未达到完全缓解。由于个人原因,患者未定期检查和接受化疗。
2022 年 5 月,患者因胸闷、背痛再次住院。血常规:WBC 19.7 × 10^9/L,HGB 34 g/L,PLT 7 × 10^9/L,骨髓涂片:异常早幼粒细胞占 83.5%,PLZF-RARα 阳性,FLT3-ITD 阴性。胸部 CT 显示肺部有多个结节和片状致密影。考虑存在细菌和真菌性肺炎,患者接受了全反式维甲酸(ATRA) (45 mg/m2 d1–28) + 三氧化二砷 (10 mg/d d1–28) + 伊达比星 (8 mg/m2, d1–3) 化疗。治疗后 35 天复查骨髓穿刺,免疫分型显示异常早幼粒细胞占 69.5%,PLZF-RARα 仍为阳性,表明疾病未缓解。
治疗经过:PLZF-RARα 阳性 APL 患者对传统治疗耐药,维奈克拉联合地西他滨带来希望
初始治疗困境
该患者(47 岁女性)确诊为罕见的 PLZF-RARα 基因融合阳性APL。APL 通常由 t(15; 17) (q22; q12) 染色体易位导致 PML-RARα 融合蛋白产生,是目前唯一不依赖化疗即可治愈的血液系统恶性肿瘤。然而,约 1-2% 的 APL 患者携带罕见的 RARα 基因变异易位,被称为变异型 APL。PLZF-RARα 是其中一种预后不良的分子遗传学异常,对传统的ATRA和三氧化二砷(ATO)治疗通常无效。
该患者初始接受了 ATRA-ATO 联合诱导化疗,这是中低危 APL 的标准治疗方案,理论上治愈率可达 90%。然而,治疗后患者并未达到完全缓解,提示存在耐药机制。
复发与治疗方案调整
2022 年 5 月,患者因胸闷、背痛再次入院。血常规检查显示:白细胞(WBC)19.7 × 10^9/L,血红蛋白(HGB)34 g/L,血小板(PLT)7 × 10^9/L;骨髓涂片显示:异常早幼粒细胞占 83.5%,PLZF-RARα 基因仍为阳性,FLT3-ITD 阴性。胸部 CT 提示存在细菌和真菌性肺炎。
鉴于患者对 ATRA-ATO 治疗耐药,且既往研究表明 PLZF-RARα 阳性 APL 对传统化疗方案(包括含蒽环类药物的方案)反应不佳,医生决定调整治疗策略。
挽救治疗:维奈克拉联合地西他滨
2022 年 6 月 28 日,患者开始接受 BCL-2 抑制剂维奈克拉联合去甲基化药物地西他滨(30 mg/d,d1-5)的治疗。维奈克拉起始剂量为 400mg,三天后因经济原因调整为 100mg。由于患者合并真菌感染,同时服用了伏立康唑(一种 CYP3A 抑制剂)。研究表明,维奈克拉与中效或强效 CYP3A 抑制剂联用时,建议剂量减少 50%-75%。治疗的第 7 天,测得维奈克拉的最大血药浓度为 13,400 ng/ml。
治疗期间,患者在第 7 天出现发热,第 9 天出现 IV 度骨髓抑制。给予刺激造血和抗感染治疗 3 天后,体温恢复正常。骨髓抑制期间输注了 4 个单位的红细胞,但未输注血小板。
治疗前,研究团队对患者的肿瘤细胞进行了体外实验。结果证实,这些细胞过表达 BCL-2,并且对维奈克拉高度敏感。加入 500nM 维奈克拉后,细胞凋亡显著增加(见图 1)。
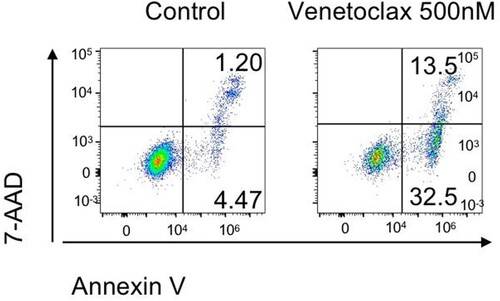
经过28天的维奈克拉治疗,患者在骨髓复查中显示异常前髓细胞占比降至0.5%,且PLZF/RARα基因转为阴性,最终实现完全缓解。患者的胸闷和背痛症状明显改善,且在后续的治疗中,PLZF/RARα状态保持阴性。
目前,患者定期接受维奈克拉与地西他滨的巩固化疗,治疗效果良好。该病例表明,维奈克拉联合地西他滨对PLZF-RARα阳性APL患者具有显著的治疗效果,为类似患者的治疗提供了新的思路。
寻根溯源:因地制宜,破解PLZF-RARα阳性APL的复杂挑战
在本病例中,患者的初步诊断为APL,但由于其特殊的PLZF-RARα基因融合,治疗过程显得尤为复杂。APL通常由经典的PML-RARα融合基因引起,而PLZF-RARα的存在则使得患者对常规治疗(如ATRA-ATO)产生耐药性。这一现象在文献中已有报道,表明PLZF-RARα阳性APL患者的预后较差,且对传统化疗的反应不佳。
在患者接受初始治疗后未能实现完全缓解,医生面临着如何调整治疗方案的挑战。考虑到患者的病情和基因特征,最终选择了维奈克拉与地西他滨的联合治疗。这一选择不仅基于PLZF-RARα阳性患者对ATRA的耐药性,还考虑到维奈克拉在其他类型AML中的有效性。研究表明,维奈克拉能够有效诱导BCL-2过表达细胞的凋亡,而患者的肿瘤细胞在体外实验中显示出对维奈克拉的敏感性,这为治疗方案的制定提供了理论依据。
在治疗过程中,患者经历了IV度骨髓抑制和发热等不良反应,但经过及时的支持治疗,患者的体温恢复正常,且在28天的维奈克拉治疗后,骨髓复查显示异常前髓细胞占比降至0.5%,并且PLZF/RARα基因转为阴性,最终实现完全缓解。
该病例强调了在面对复杂的基因融合血液病时,必须保持开放的思维,灵活调整治疗策略。医生应根据患者的具体情况,结合最新的研究进展,制定个体化的治疗方案。同时,跨学科的合作与沟通也显得尤为重要,尤其是在处理罕见或不典型病例时,综合各方面的专业知识能够更好地指导临床决策。
小结
本文报告了一例罕见的 PLZF-RARα 基因融合阳性的急性早幼粒细胞白血病(APL)病例。该患者对传统的 ATRA、砷剂和化疗方案治疗无效。通过使用维奈克拉联合地西他滨作为挽救治疗,患者成功获得了形态学缓解,并且 PLZF-RARα 基因转为阴性。体外实验证实患者的肿瘤细胞过表达 BCL-2,并且对维奈克拉敏感。
这一病例提示,维奈克拉联合地西他滨可能是 PLZF-RARα 阳性 APL 的一种有效治疗选择,特别是对于传统治疗无效的患者。该病例也强调了去甲基化药物在 APL 治疗中的潜在作用,因为融合蛋白 PML-RARα 可导致造血细胞分化关键途径的过度甲基化和沉默。
尽管该病例显示了积极的治疗结果,但仍需要更多的研究来确定维奈克拉联合地西他滨治疗 PLZF-RARα 阳性 APL 的长期疗效和安全性,以及最佳治疗方案。此外,探索其他靶向药物在治疗这种罕见类型 APL 中的应用也具有重要意义。
患者,女,47岁,因皮肤出血点和瘀斑入院,实验室检查结果显示血小板和血红蛋白水平低,骨髓涂片提示急性早幼粒细胞白血病(APL)。进一步的PCR分析确认存在PLZF-RARα融合基因。在治疗过程中,患者对传统的ATRA-ATO治疗方案未能达到完全缓解。为了评估该患者的预后和最佳治疗方案,最应完善以下哪项检查?
A. 核磁共振成像(MRI)
B. 基因突变检测
C. 骨髓穿刺细胞学检查
D. 细胞遗传学分析
E. 血清生化指标检查
上期《寻根溯源 | 揭秘同一患者体内克隆无关与克隆相关DLBCL的复杂转化过程》答案为B
[1] YILMAZ M, KANTARJIAN H, RAVANDI F. Acute promyelocytic leukemia current treatment algorithms [J]. Blood Cancer Journal, 2021, 11(6): 123.
[2] ZHOU Z, CHEN E, JIANG J, et al. Successfully treatment of PLZF-RARα positive acute promyelocytic leukemia by Venetoclax combining with decitabine: a case report and literature review [J]. Hematology, 2024, 29(1): 2399362.
排版编辑:Ashelin











 苏公网安备32059002004080号
苏公网安备32059002004080号


