近年来,基于放射性核素标记的前列腺特异性膜抗原(PSMA)配体逐渐成为前列腺癌诊断和治疗领域的热门探索方向。2024年欧洲肿瘤内科学会(ESMO)年会于9月13日至17日在西班牙巴塞罗那盛大召开,来自全球172 个国家和地区的超过 35,000 名肿瘤专业人士代表将参与此次盛会,交流肿瘤领域最新前沿进展。会中,多项探索放射配体在前列腺癌诊断与治疗中应用的研究将报告最新结果。【肿瘤资讯】特邀北京协和医院纪志刚教授、霍力教授分享并点评最新研究进展,探讨放射配体在前列腺癌诊疗中的应用。
中国医学科学院北京协和医院泌尿外科教研室主任、教授、博士生导师
中华医学会泌尿外科分会常委
中国医师协会泌尿外科医师分会副会长
中华医学会泌尿外科分会肿瘤学组副组长
中国医师协会泌尿外科医师分会数字与人工智能学组组长
《中华泌尿外科杂志》常务编委
《机器人外科学杂志》常务编委
中央保健会诊专家
发表SCI文章100余篇,编写专著3部
北京协和医院核医学科主任
国家核医学质控中心主任
国家药典委员会委员
中华医学会核医学分会常委
北京医师协会核医学分会会长
北京医学会核医学分会、中国医学影像技术学会核医学分会及中国医学装备学会核医学专业委员会副主任委员
《中华核医学与分子影像学杂志》、《中国医学影像杂志》和《国际放射医学与核医学杂志》编委
PSMA诊疗一体化开启前列腺癌新时代
前列腺癌是我国男性的一类常见恶性肿瘤,根据国家癌症中心2024年初发布数据[1],我国前列腺癌年新增病例数和死亡病例数分别达到13.42万例和4.75万例,对比此前呈上升趋势。纪志刚教授指出,前列腺癌病程较长,病情往往较为复杂,对于每位患者,通常都需要结合其个体情况、疾病分期、治疗耐受性等,进行多治疗手段的综合治疗,以多学科协作模式为其制定个体化治疗方案。
霍力教授则表示,前列腺特异性膜抗原(PSMA)在前列腺癌的诊断治疗中均具有重要价值。不仅可通过PSMA PET/CT作为尖端分子影像学检查技术,捕捉传统影像学手段(如CT、MRI或骨扫描)不能发现的病灶,还可利用放射配体疗法(如177Lu-PSMA-617)进行特异性靶向治疗,其中,基于177Lu-PSMA-617的放射配体疗法已经在美国、欧盟和加拿大等多个国家或地区获批上市。
纪志刚教授指出,此前在国际性、前瞻性、随机、开放标签、多中心临床研究VISION中[2],对于831例既往接受紫杉类和雄激素受体通路抑制剂(ARPI)治疗后病情进展、PSMA-PET扫描阳性的转移性去势抵抗性前列腺癌(mCRPC)患者中,177Lu-PSMA-617联合标准治疗(SOC)对比单独SOC,显著延长了总生存期(中位OS:15.3个月 vs 11.3个月;HR=0.62,95%CI:0.52-0.74;p<0.001)和放射学无进展生存期(中位rPFS:8.7个月 vs 3.4个月;HR=0.40;99.2%CI:0.29-0.57;p<0.001)。纪志刚教授总结,PSMA放射配体疗法以其独特的作用机制切中了前列腺癌患者未被满足的诊疗需求,其中177Lu-PSMA-617拥有令人期待的应用前景。而在本次ESMO大会中,也有多项相关的临床研究进展报道。
2024 ESMO重点研究盘点:诊断篇
1608P – 使用PSMA PET/CT的前列腺癌工作组4(PCWG4)反应评估标准:PRINCE试验的事后分析[4]
霍力教授介绍,PCWG4制定了PSMA PET/CT反应评估的影像学标准,本次研究则在PRINCE研究中使用PCWG4标准回顾了36例患者的数据。研究数据指出,PSMA PET/CT在针对反应水平(CR、PR、SD、PD)或疾病进展(PD vs非PD)方面的一致性分别达到高水平(0.69 [95% CI: 0.61 - 0.76])和接近完美(0.90 [95% CI: 0.85 -0.96]),对比PCWG3标准更为精确,可以更早预测到影像学进展,该结果提示了PSMA PET/CT在所有反应水平(特别是PD与否)的检测中高度一致性,这将值得在更大队列中进一步验证该标准的有效性。
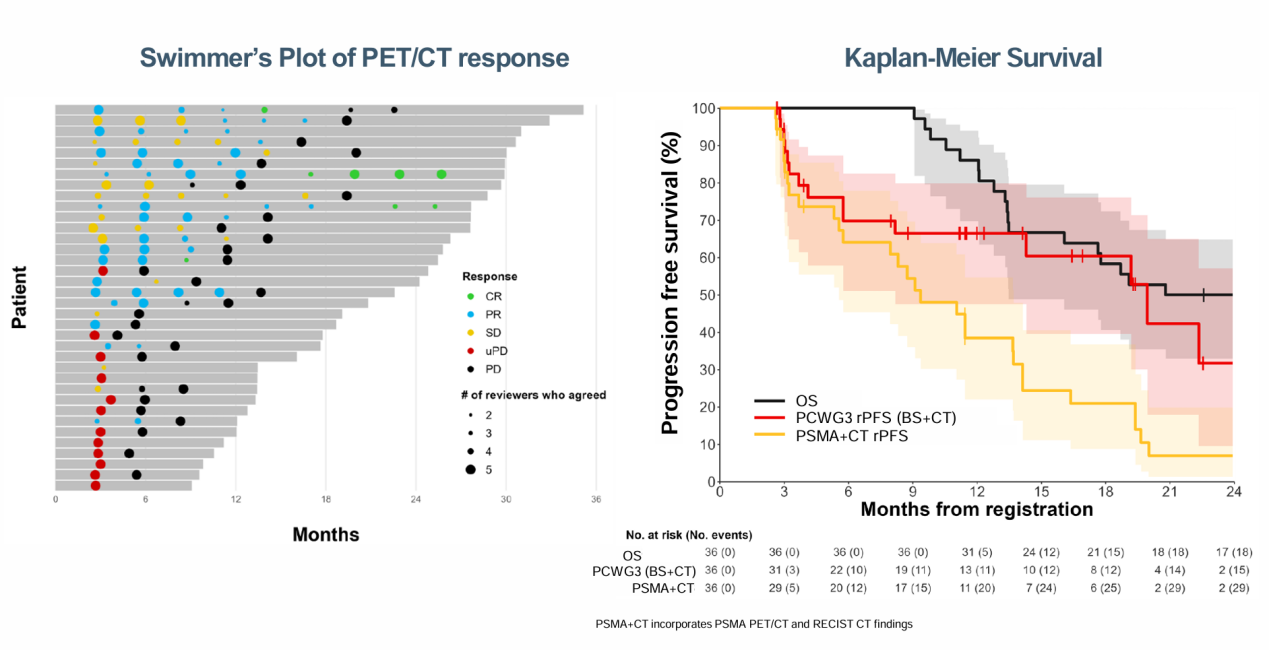
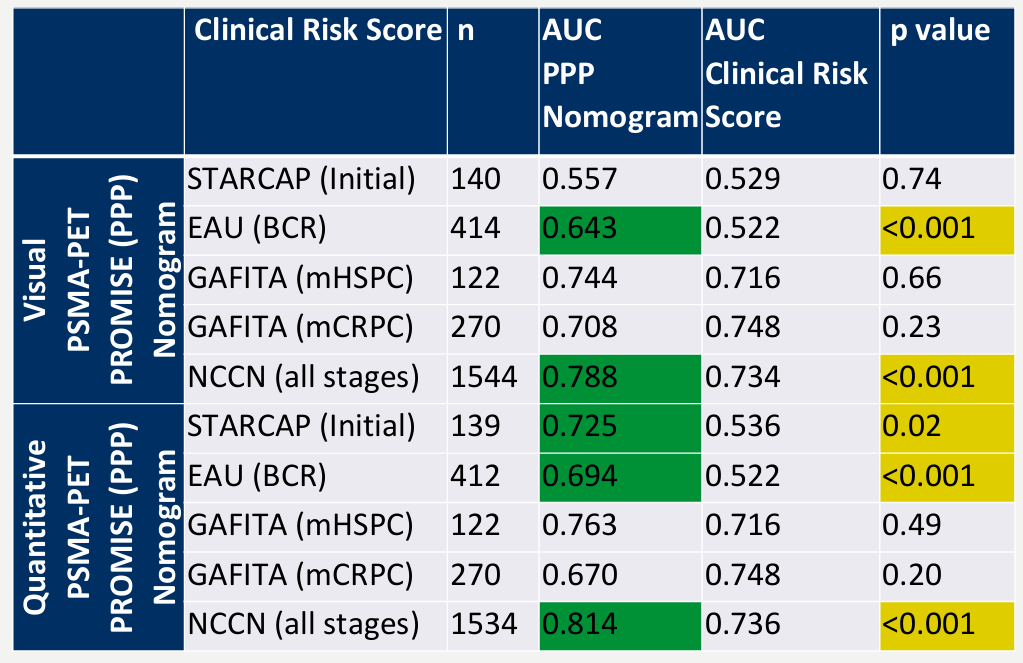
1609P - PSMA-PET和PROMISE重新定义前列腺癌患者的分期和风险[5]
霍力教授介绍,该组研究者基于中心患者数据中开发了一款基于PROMISE标准的PSMA-PET预后预测模型(PPP),并在内部和外部患者数据中进行了验证。其中包括的预测因子包括局部区域淋巴结转移(miN2)、远处转移(miM1a、miM1b模式、miM1c)、肿瘤体积和肿瘤SUVmean。验证结果显示了该PPP模型对比STARCAP、EAU、NCCN标准的优势,可以准确对早期、晚期前列腺癌患者的风险进行分层。目前该模型正在更长时间的随访中进行验证(NCT06320223,promise-pet.com),结果令人期待。
1616P – 利用循环肿瘤DNA(ctDNA)测量和PET成像评估Ib期PRINCE研究中接受177Lu-PSMA-617+帕博利珠单抗(PRINCE)治疗的mCRPC患者反应[6]
霍力教授介绍,此前PRINCE试验显示了177Lu-PSMA-617与帕博利珠单抗联合使用具有令人鼓舞的抗肿瘤活性,本次研究者则提出了基于ctDNA监测和PSMA-PET成像的探索性分析,以识别177Lu-PSMA-617联合帕博利珠单抗的疗效预测因子。
研究者对PRINCE研究中基线(n=37)和治疗12周后(n=35)患者的血浆ctDNA和PSMA-PET成像进行了分析。评估结果显示,基线ctDNA百分比与FDG代谢肿瘤体积(rho=0.47,p<0.01)和PSMA总肿瘤体积(rho=0.53,p<0.01)中等相关;PSMA-SUVmean<10的患者(21/37)对比PSMA-SUVmean≥10患者,ctDNA百分比更高(中位数:30% vs 4%,p=0.03)。基线ctDNA<30%(HR 0.4,95%CI 0.2-0.8)和PSMA-SUVmean≥10(HR 0.3,95%CI 0.1-0.7)的患者有更好的rPFS,同时具有ctDNA<30%和PSMA-SUVmean≥10的患者具有最长的rPFS(n=12;中位rPFS未达到)。
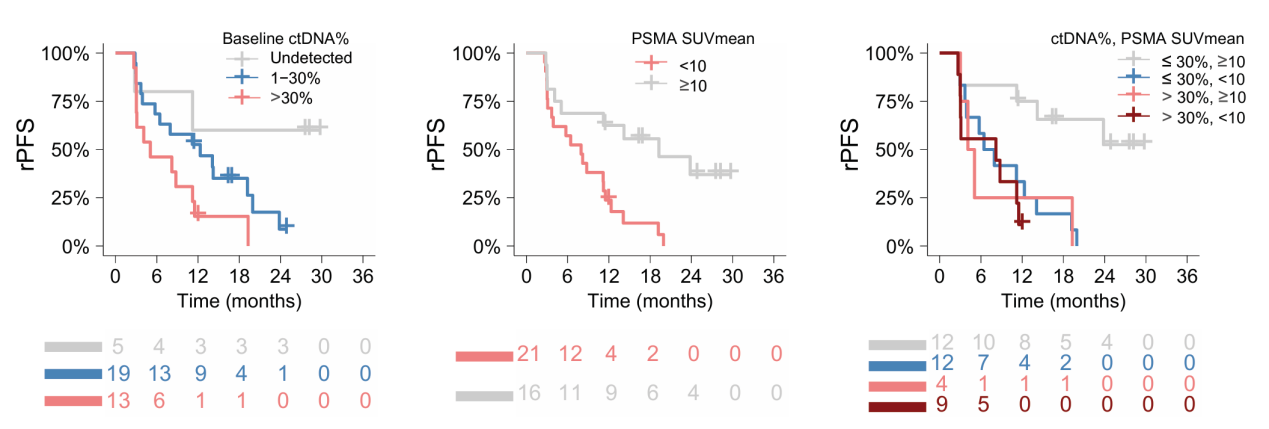
相比之下,ctDNA>30%(n=4;8.0个月)、PSMA-SUVmean<10(n=11;4.6个月)或两者兼有(n=10;6.0个月)的患者中位rPFS相似。在第12周时未检测到ctDNA的患者对比12周时持续检测到ctDNA的患者(1/18;6%),PSA90 RR更高(16/17;94%),12周时持续检测到ctDNA的患者的rPFS更差(HR 6.3,95% CI 2.5-15.7)。霍力教授指出,这些研究结果提示了PSMA SUVmean和基线ctDNA百分比均显示出了对rPFS的预后潜力,未来可以结合这两项参数进一步研究,以确定它们在提高预后准确性中的互补作用。
2024 ESMO重点研究盘点:治疗篇
LBA66 - UpFrontPSMA:一项对比177Lu-PSMA-617序贯多西他赛与多西他赛单药治疗转移性激素敏感性前列腺癌(mHSPC)的随机II期研究[6]
纪志刚教授介绍,这项由研究者发起的随机、双臂、多中心、II期研究尝试在新诊断的mHSPC患者中评估在多西他赛前使用177Lu-PSMA-617能否带来更好的疗效。研究在2020年4月至2023年4月期间,总计将130例高体积mHSPC患者纳入随机化,患者分别接受2周期177Lu-PSMA-617后序贯接受多西他赛(A组),或直接接受多西他赛单药(B组),所有患者均接受ADT和多西他赛的治疗。
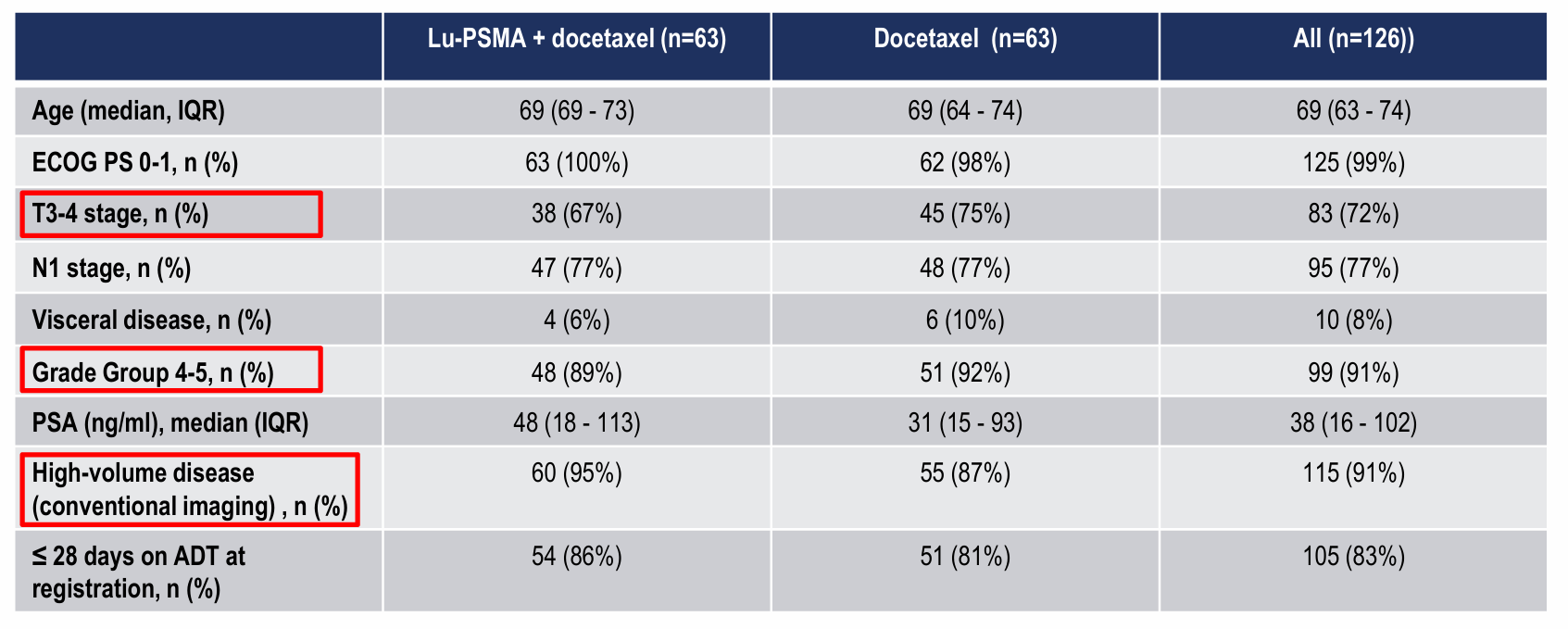
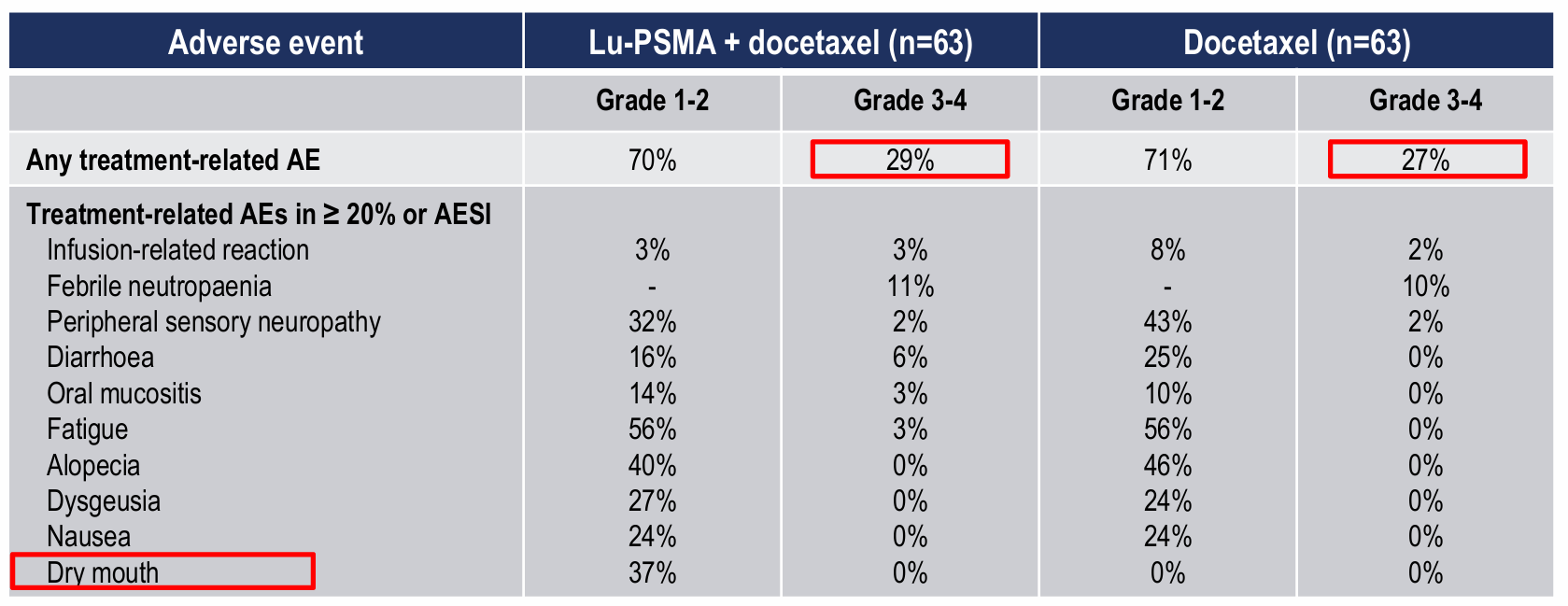
研究结果显示,在48周时A组对比B组PSA不可测率更高:41%(25/61)vs 16%(10/61),比值比3.9(95% CI 1.6-9.4),p=0.002。
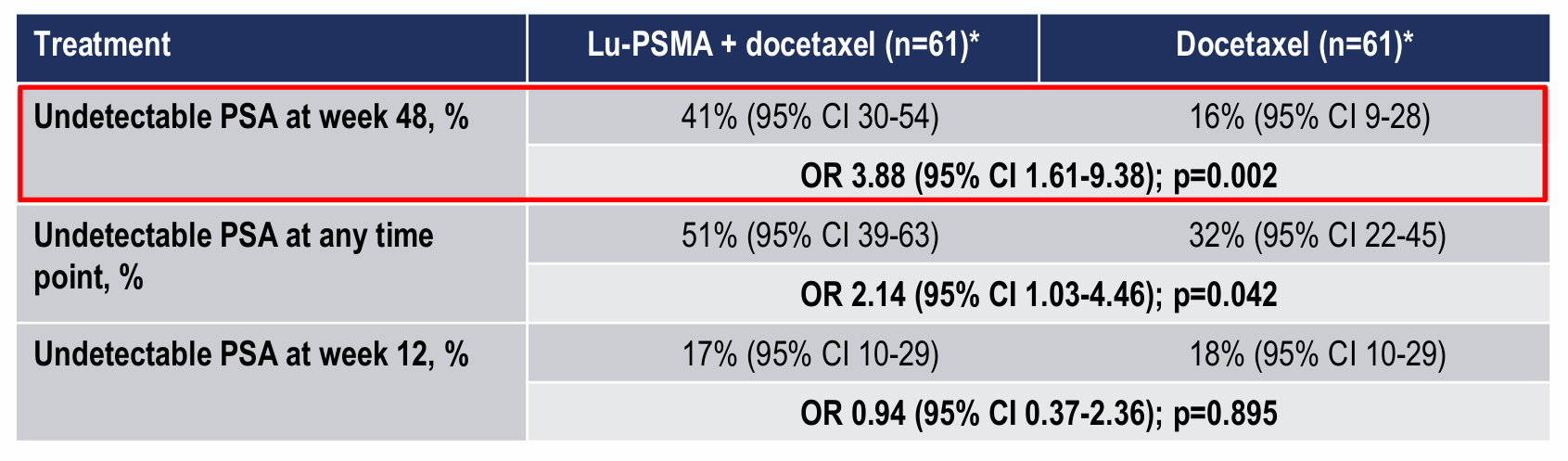
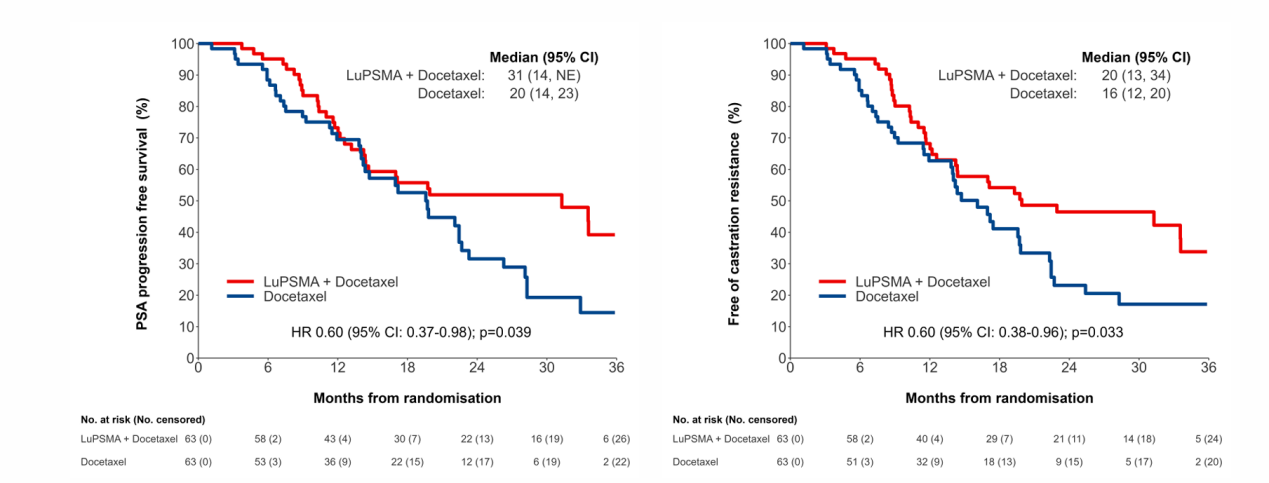
A组的PSA-PFS(中位PSA-PFS:30个月 vs 21个月;HR 0.60,95% CI:0.4-1.0;p=0.039)、无去势抵抗生存期(中位:20个月 vs 16个月;HR 0.60,95% CI:0.4-1.0;p=0.033)和影像学PFS(中位:NR vs 22个月;HR 0.58,95% CI:0.3-1.0;p=0.067)均更长。
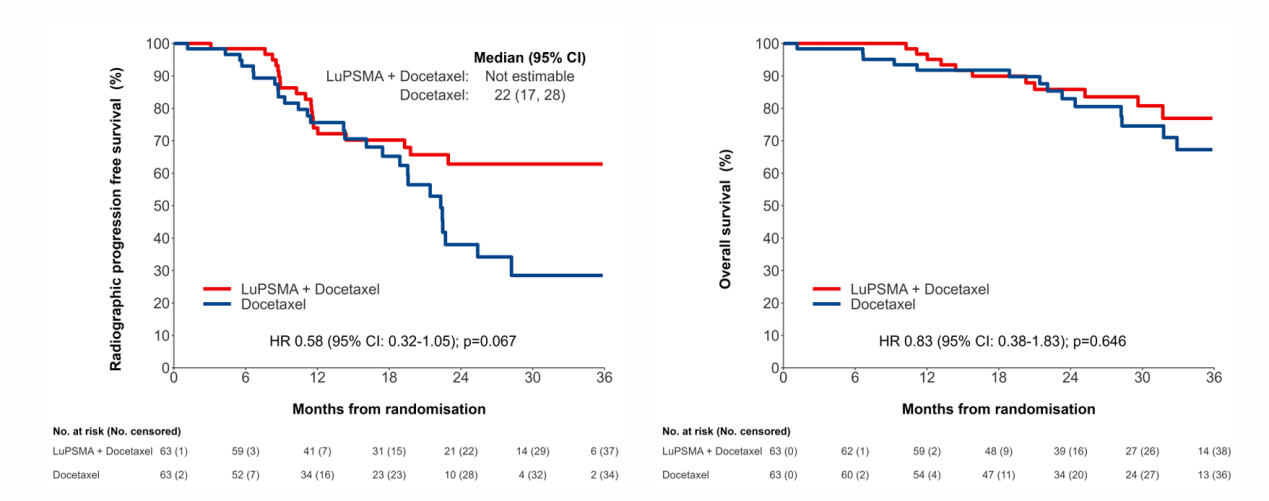
两组中的3-4级不良反应发生率分别为29%(18/63)和27%(17/63),通常由多西他赛引起。纪志刚教授表示,数据显示了177Lu-PSMA-617后序贯多西他赛对比多西他赛单药治疗新诊断的高体积mHSPC患者,可改善临床结局且未增加毒性,该结果将支持177Lu-PSMA-617在mHSPC患者中的应用。
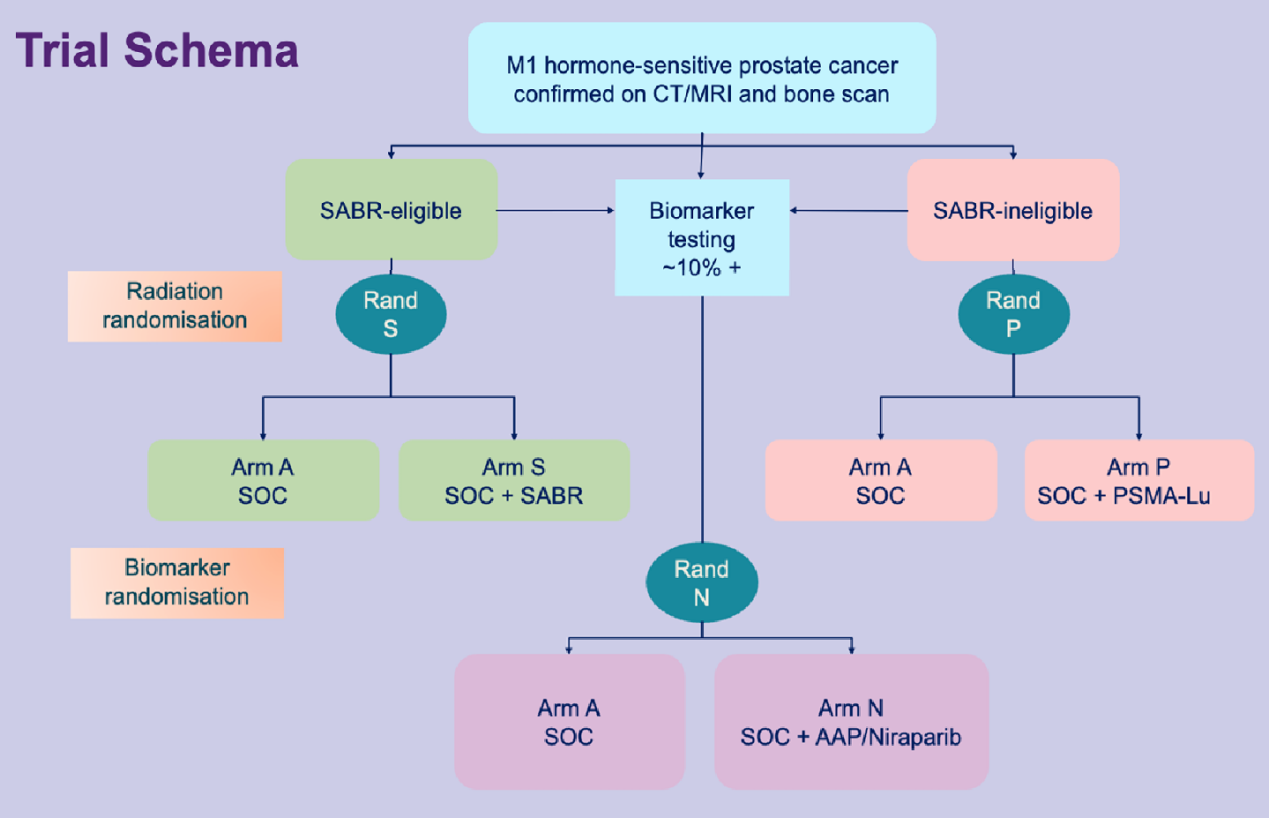
1658TiP - STAMPEDE2 177Lu-PSMA-617试验:一项III期、随机、开放标签试验,针对开始雄激素剥夺治疗(ADT)的转移性前列腺癌(mPC)患者[7]
纪志刚教授介绍,这项正在进行中的III期、随机、开放标签、多中心研究旨在评估在开始ADT治疗的转移性PC患者中,接受SOC或SOC+177Lu-PSMA-617治疗的疗效,其中SOC包括长期ADT、ARSI、±前列腺放疗、多西他赛。此外还将分析接受2周期177Lu-PSMA-617治疗后的PSMA PET/CT和全身MRI,并检测生物标志物,生物标志物阳性的患者将二次随机化至STAMPEDE2 Niraparib试验。研究计划招募1876名患者,双重主要研究终点是rPFS和OS。
循证医学证据持续丰富,PSMA一体化诊疗深入前列腺癌临床探索与应用
本次ESMO大会中,PSMA一体化诊疗的循证医学证据得到进一步丰富,177Lu-PSMA-617在mHSPC和mCRPC中均显示出更高的临床应用价值;基于PSMA-PET的检测也将对患者的风险分层、疗效评估具有重要价值。
纪志刚教授和霍力教授均表示,诊疗一体化的发展趋势逐渐明晰,期待未来随着放射配体疗法的持续发展,为前列腺癌诊疗带来更多革命性改变,造福更多患者。
[1] HAN B F, ZHENG R S, ZENG H M, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1): 47-53.
[2] Sartor O, De Bono J, Chi K N, et al. Lutetium-177–PSMA-617 for metastatic castration-resistant prostate cancer[J]. New England Journal of Medicine, 2021, 385(12): 1091-1103.
[3] Michael S. Hofman, et al. Prostate cancer working group 4 (PCWG4) preliminary criteria using serial PSMA PET/CT for response evaluation: Analysis from the PRINCE trial. 2024 ESMO. 1608P.
[4] Wolfgang P. Fendler, et al. PSMA-PET and PROMISE re-define stage and risk in patients with prostate cancer. 2024 ESMO. 1609P.
[5] Sofie H. Tolmeijer, et al. Circulating tumour DNA (ctDNA) measurements and PET-imaging to evaluate response in a phase Ib trial of metastatic castration-resistant prostate cancer (mCRPC) treated with Lutetium-177-PSMA-617 (LuPSMA) plus pembrolizumab (PRINCE). 2024 ESMO. 1616P.
[6] Arun A. Azad, et al. UpFrontPSMA: A randomised phase II study of sequential 177Lu-PSMA-617 and docetaxel (D) versus docetaxel in metastatic hormone-sensitive prostate cancer (mHSPC). 2024 ESMO. LBA66.
[7] Minal Padden-Modi, et al. The STAMPEDE2 177Lutetium-PSMA-617 (177Lu-PSMA-617) trial: A phase III, randomised, open-label trial in patients with metastatic prostate cancer (mPC) starting androgen deprivation therapy (ADT). 2024 ESMO. 1658TIP.
审批码RLT0031628-74439,有效期至2025.09.24,资料过期,视同作废。
排版编辑:肿瘤资讯-YX











 苏公网安备32059002004080号
苏公网安备32059002004080号


