肝细胞癌(HCC)是全球癌症死亡的第三大原因,高达90%的HCC确诊患者伴发潜在的肝硬化[1],Child-Pugh分级是最常用的肝功能分级指标,根据腹水、脑病、胆红素、白蛋白和凝血酶原时间/国际标准化比值等严重程度赋予1~3分,将患者分为Child-Pugh A级(5~6分,肝功能正常),B级(7~9分,中度肝功能损伤)和C级(10~15分,严重肝功能损伤)。全球BRIDGE队列研究显示Child-Pugh B级患者占HCC患者的23%[2]。
近年来,随着免疫疗法的出现,包括免疫疗法与靶向药物的结合,晚期HCC的治疗格局发生了巨大变化。但是多项大规模、多中心、Ⅲ期随机对照临床试验将Child-Pugh B级HCC患者排除在外,因此Child-Pugh B级肝癌患者的全身治疗方式有限。【肿瘤资讯】特邀内蒙古医科大学附属医院的赵海燕教授基于临床视角,从疗效和安全性两方面总结免疫治疗药物在Child-Pugh B级肝癌患者的相关临床试验,以探讨免疫治疗是否对这特殊群体有益。
内蒙古医科大学附属医院肿瘤内科,内蒙古抗癌协会化疗专业委员会秘书,主持CSCO课题1项,省级课题1项,厅级课题4项。发表SCI及核心期刊10余篇。
(一)PD-1/PD-L1抑制剂在晚期肝细胞癌Child-Pugh B患者中的疗效
免疫单药
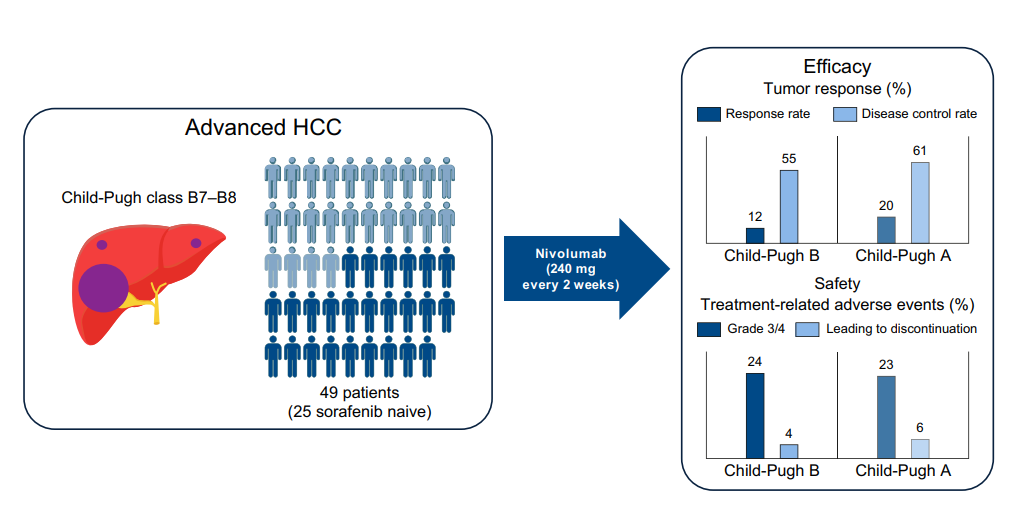
CheckMate040 研究是关于免疫检查点抑制剂(ICI)治疗晚期HCC患者的一项I/II期研究,其第5队列是首个纳入Child-Pugh B级的前瞻性研究[3],49例Child-Pugh B级HCC患者入组,客观缓解率(ORR)为12%(95%CI,5%~25%),缓解持续时间(DOR)为9.9个月。262例Child-Pugh A级HCC患者中,ORR为20%(95%CI,16%~26%),DOR为12.4个月。Child-Pugh B级HCC患者ORR低于Child-Pugh A级HCC患者,但Child-Pugh B级队列入组患者较少,且两组患者ORR的95%CI高度重叠,因此需要扩大队列进一步验证。Child-Pugh B患者的中位OS为7.6个月,其中 B7级为7.6个月、 B8级 7.4个月。所有Child-Pugh B级HCC患者的无进展生存期(PFS)为2.7个月。值得注意的是,在Child-Pugh B级HCC患者中,部分治疗有效的HCC患者肝功能从Child-Pugh B级改善至Child-Pugh A级,并且持续改善时间超过6个月,这一获益可能与纳武利尤单抗治疗有效后,肝脏的代谢异常得到纠正有关。
在Scheiner等人[4]开展的回顾性队列研究中,发现纳武利尤单抗或帕博利珠单抗在Child-Pugh A级HCC患者和B级HCC患者中疗效相当。Child-Pugh A组和B组的ORR和DCR分别为9% vs.14%和56% vs.46%,且两组间PFS无差异,分别为4.4 vs. 4.6个月。Child-Pugh B组的中位总生存(OS)较短,两组中位OS为16.7 vs. 8.6个月,但是无统计学意义(P=0.065)。然而,Fessas等人[5]在纳武利尤单抗治疗HCC患者的多中心回顾性队列研究中发现,Child-Pugh B级HCC患者的中位OS较Child-Pugh A级HCC患者更短(7.3 vs. 16.3个月;HR=2.30;P<0.001)。
免疫联合大分子抗血管生成药物
D'Alessio等人[6]回顾性评估了阿替利珠单抗+贝伐珠单抗在肝癌中的疗效,其中Child-Pugh A级154例、Child-Pugh B级48例,Child-Pugh B级的中位OS较Child-Pugh A级更短,16.8 vs. 6.7个月(P=0.0003)。同样,A级PFS显著长于B级患者,7.6 vs. 3.4个月(P=0.03)。但是A级与B级的ORR为26% vs. 21%,DCR为74% vs. 68%。由此可以发现肝癌患者接受免疫治疗,除了药物疗效影响患者的生存时间外,患者肝硬化程度、肝功能状态对生存期的影响也是值得我们注意的,在评价药物针对不同Child-Pugh级别的疗效时,ORR和DCR可能具有更直观的参考价值。
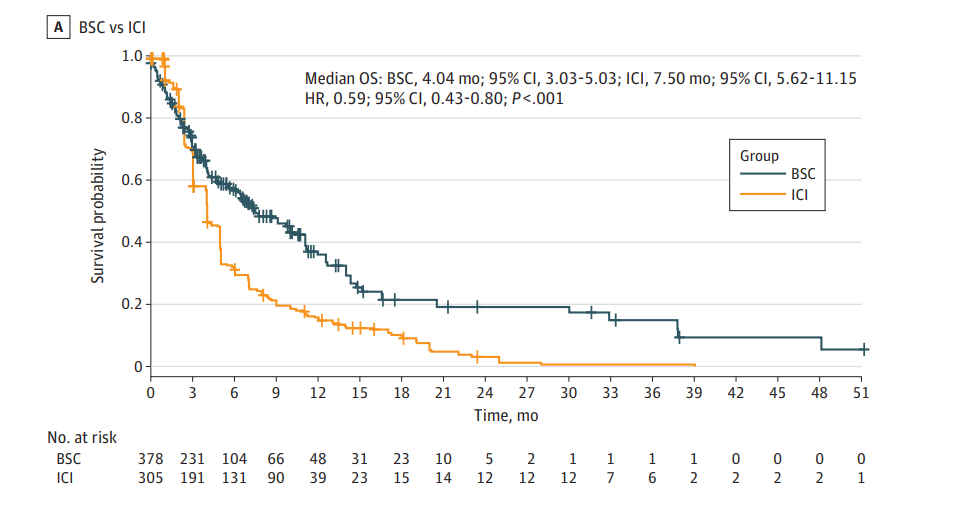
JAMA Oncol新发表一篇汇总2项多中心注册研究的回顾性分析报告[7],其中对比了ICI和最佳支持治疗(BSC)用于Child-Pugh B级HCC患者的结局。ICI组治疗方案包括阿替利珠单抗+贝伐珠单抗和纳武利尤单抗。结果显示接受积极治疗的患者OS显著延长,两组分别是7.50 vs. 4.04个月(HR=0.59,P<0.001),多变量分析确定ICI治疗和死亡风险降低显著相关(HR=0.55,P<0.001)。
免疫联合小分子TKI
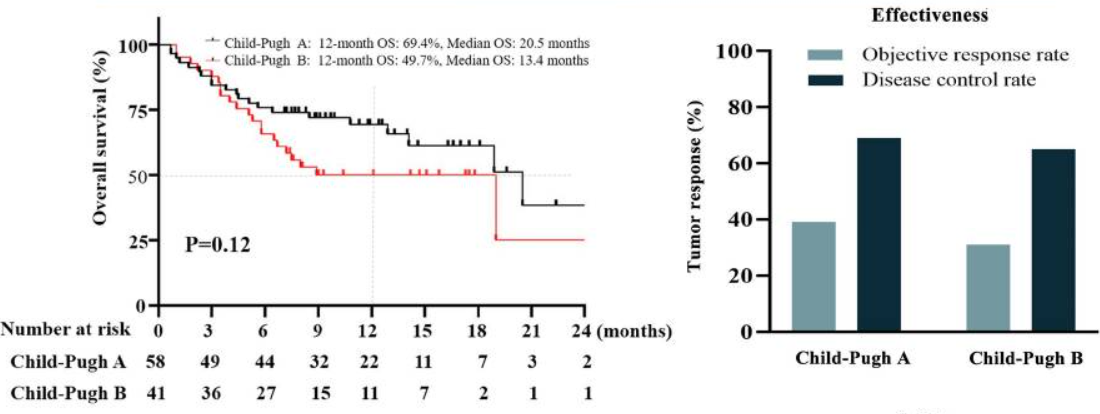
Li等人[8]在中国的多中心回顾性队列研究中评估了卡瑞利珠单抗联合小分子酪氨酸激酶抑制剂(TKI)治疗后患者的预后情况。研究纳入了99名晚期HCC患者(Child-Pugh A级58例,Child-Pugh B级41例),其中84例患者接受了治疗。对于Child-Pugh B级HCC患者,12个月的OS率、ORR和DCR分别为49.7%、31.7%和65.9%,中位PFS为5.1个月,与Child-Pugh A患者相当,但Child-Pugh B患者中位OS较A患者短(13.4 vs. 20.5个月,P=0.12)。
总体而言,与Child-Pugh A级HCC患者相比,免疫疗法在Child-Pugh B级的HCC患者中的疗效似乎有所降低,这可能与不同程度肝硬化预后本身不同相关。
(二)PD-1/PD-L1抑制剂在晚期肝细胞癌Child-Pugh B级患者中的安全性
CheckMate 040队列纳入49例初治和经治Child-Pugh B(B7-B8分)的HCC患者,使用纳武利尤单抗治疗。结果显示方案安全性良好,3~4级治疗相关不良反应(TRAEs)发生率为24%[3]。同样,Fessas等人[4]和Scheiner等人[5]进行的回顾性队列研究发现,免疫治疗在Child-Pugh不同分级的HCC患者间没有观察到安全性差异。
既往研究显示,阿替利珠单抗+贝伐珠单抗的治疗方案在Child-Pugh B级HCC患者中也具有良好耐受性[6],D 'Alessio等人在不可切除或转移性HCC患者中开展的回顾性队列研究,共202例不可切除或转移性HCC患者接受阿替利珠单抗+贝伐珠单抗方案治疗,研究纳入Child-Pugh B级48例(23.8%),其中B7级21例,B8级21例,B9级6例。结果观察TRAE发生率在Child-Pugh不同分级中概率相当。53.2%的Child-Pugh A级和39.6%的Child-Pugh B级患者发生了TRAE。
总体来说,目前研究显示免疫治疗在Child-Pugh A级与Child-Pugh B级安全性相当。但是如选择与抗血管生成药物联合应用时,仍需谨慎,需要充分评估出血风险、是否门脉高压等。
(三)Child-Pugh B级晚期肝癌患者免疫治疗的选择
Child-Pugh B级是肝癌患者中的一个异质性亚组,包括了不同程度的肝功能损害。选择治疗方案时,应充分考虑个体评分(B7、B8或B9)和临床特征(例如,是否存在肝脾互通性高压)进行治疗。例如,由于B9评分的患者通常存在明显的肝硬化,他们的预后更多地取决于患者本身的基本情况,肝功能损害比肿瘤负荷对预后影响更重要。这些患者可能很难从免疫疗法或任何其他癌症治疗中受益。因此,对于B9评分的患者,最好采取BSC,并首先考虑进行肝移植。Child-Pugh B级伴肝硬化的HCC患者目前缺乏系统性治疗手段,尽管免疫疗法在HCC患者中的疗效似乎在Child-Pugh B级中有所降低,但多项研究结果提示其仍能给患者带来生存获益[1]。
在CheckMate040 I/II期研究中,纳武利尤单抗在晚期Child-Pugh B级HCC一线治疗具有疗效和良好安全性,这一结果可能会对接受其他抗PD-1/PD-L1抗体作为单一药物的治疗方案提供参考价值,但最终确认仍需要通过前瞻性研究来实现。阿替利珠单抗+贝伐珠单抗在HCC的疗效和安全性得到了验证[6,9],但在另一项研究中却显示出了不同的研究结果[10]。因此在选择此方案时需谨慎评估门脉高压及出凝血异常等影响预后的合并症。在STRIDE方案中[11],未观察到明显的治疗相关的肝脏毒性,并且未观察到治疗相关的胃肠道或食管静脉曲张出血事件,因此度伐利尤单抗+替西木单抗也是可以考虑的方案之一,尽管仍然缺乏其在Child-Pugh B级HCC患者中疗效及安全性的证据。
小结
晚期HCC常合并肝硬化肝功能不全,Child-Pugh评分常被用来评估肝功能不全分级,但其本身具有一定的局限性,容易受到主观评估的影响,特别是关于肝性脑病和腹水的评分。ALBI分级方法(基于血清胆红素和白蛋白的一种评分)正在成为一种新的评估肝功能的方法,但其与免疫治疗的相关性研究非常少。无论是真实世界研究还是随机对照研究,在晚期HCC合并中度肝功能不全患者中开展都是临床迫切需要的,也是符合中国肝癌发病的特征的。
排版编辑:肿瘤资讯-HYF
参考文献
[1]Roth GS, Villeret F, Decaens T, et al. Immunotherapy in hepatocellular carcinoma: How does underlying liver disease influence therapeutic strategy and outcomes[J].Liver In,2023,43(3):546-557.
[2] Park JW, et al. Global patterns of hepatocellular carcinoma management from diagnosis to death: the BRIDGE Study. Liver Int. 2015;35:2155-2166.
[3] Kudo M, Matilla A, Santoro A, et al. CheckMate 040 cohort 5: A phase I/II study of nivolumab in patients with advanced hepatocellular carcinoma and Child-Pugh B cirrhosis[J].J Hepatol,2021,75(3):600-609.
[4] Scheiner B, Kirstein MM, Hucke F, et al. Programmed cell death protein-1 (PD-1)-targeted immunotherapy in advanced hepatocellular carcinoma: efficacy and safety data from an international multicentre real-world cohort[J].Aliment Pharmacol Ther,2019,49(10):1323-1333.
[5] Fessas P, Kaseb A, Wang Y, et al. Post-registration experience of nivolumab in advanced hepatocellular carcinoma: an international study[J].J Immunother Cancer,2020,8(2).
[6] D'Alessio A, Fulgenzi C, Nishida N, et al. Preliminary evidence of safety and tolerability of atezolizumab plus bevacizumab in patients with hepatocellular carcinoma and Child-Pugh A and B cirrhosis: A real-world study[J].Hepatology,2022,76(4):1000-1012.
[7] Fulgenzi C, Scheiner B, D'Alessio A, et al. Immunotherapy vs Best Supportive Care for Patients With Hepatocellular Cancer With Child-Pugh B Dysfunction[J].JAMA Oncol,2024 .
[8] Li T, Guo J, Liu Y, et al. Effectiveness and tolerability of camrelizumab combined with molecular targeted therapy for patients with unresectable or advanced HCC[J].Cancer Immunol Immunother,2023,72(7):2137-2149.
[9] Kikugawa C, Uchikawa S, Kawaoka T, et al. Outcomes of Patients with Child-Pugh B and Unresectable Hepatocellular Carcinoma Undergoing First-Line Systemic Treatment with Sorafenib, Lenvatinib, or Atezolizumab Plus Bevacizumab[J].Oncology,2024,102(3):239-251.
[10] Rimini M, Persano M, Tada T, et al. Survival outcomes from atezolizumab plus bevacizumab versus Lenvatinib in Child Pugh B unresectable hepatocellular carcinoma patients[J].J Cancer Res Clin Oncol,2023,149(10):7565-7577.
[11] Abou-Alfa GK, Lau G, Kudo M, et al. Tremelimumab plus Durvalumab in Unresectable Hepatocellular Carcinoma[J].NEJM Evid,2022,1(8):EVIDoa2100070.











 苏公网安备32059002004080号
苏公网安备32059002004080号


