
HER2靶点如今是实体瘤治疗中的热门靶点,已在多个瘤种中已取得了令人瞩目的研究结果。在肺癌领域,目前FDA已批准德曲妥珠单抗(DS-8201/T-DXd)用于HER2突变晚期非小细胞肺癌(NSCLC)的后线治疗;亦批准了德曲妥珠单抗用于HER2过表达实体瘤的后线治疗。在精准治疗新时代,深入了解HER2生物学功能,为临床实践中HER2变异的检测和临床治疗提供更多依据和信息。
【肿瘤资讯-HER2学社】第六期特邀中山大学孙逸仙纪念医院欧阳能太教授深入解析HER2的生物学特征。
细胞分子诊断中心教授
中国抗癌协会肿瘤基因诊断专委会 常委
中国抗癌协会肿瘤标志专委会 常委
中国医学装备协会基因检测分会 常委
HER2基因的致癌作用机制
原癌基因ERBB2发现于20世纪80年代中期,位于人类17号染色体长臂(17q11.2-q12)。人类表皮生长因子受体2(HER2)是一种185kDa的跨膜糖蛋白,属于1型跨膜生长因子受体家族,该家族由HER1(EGFR/ERBB1),HER2(ERBB2)、HER3(ERBB3) 和HER4 (ERBB4)组成,每个受体由胞外配体结构域(ECD)、α-螺旋跨膜结构域(TM)和细胞内酪氨酸激酶结构域(TKD)三部分组成。在特定条件下,配体与受体细胞外结构域结合,可导致HER蛋白受体的同源或异源二聚化,随后细胞内酪氨酸残基发生磷酸化而启动MAPK、PI3K/AKT、PKC和STAT等下游信号通路,进而可能导致肿瘤细胞的增殖、分化和侵袭。
值得注意的是,HER2与其家族成员具有结构同源性,但不同之处是目前尚未发现HER2的直接配体。HER2能保持其活性构象,使连续二聚化成为可能。另外,HER2表现为内化和降解的减少,从而能在细胞膜上保持长期活化。而HER3缺乏内在酪氨酸激酶活性,只能与其他HER受体形成异源二聚体,HER2/HER3异源二聚体在相互作用强度、配体诱导的酪氨酸磷酸化和激活下游信号传导方面是最有效的[1]。另外,HER2优异的异源二聚化能力,结合其独特的基础酪氨酸激酶活性,赋予了HER2在激活信号转导通路方面的关键功能。因此当HER2功能异常时,将发挥重要的致癌作用。
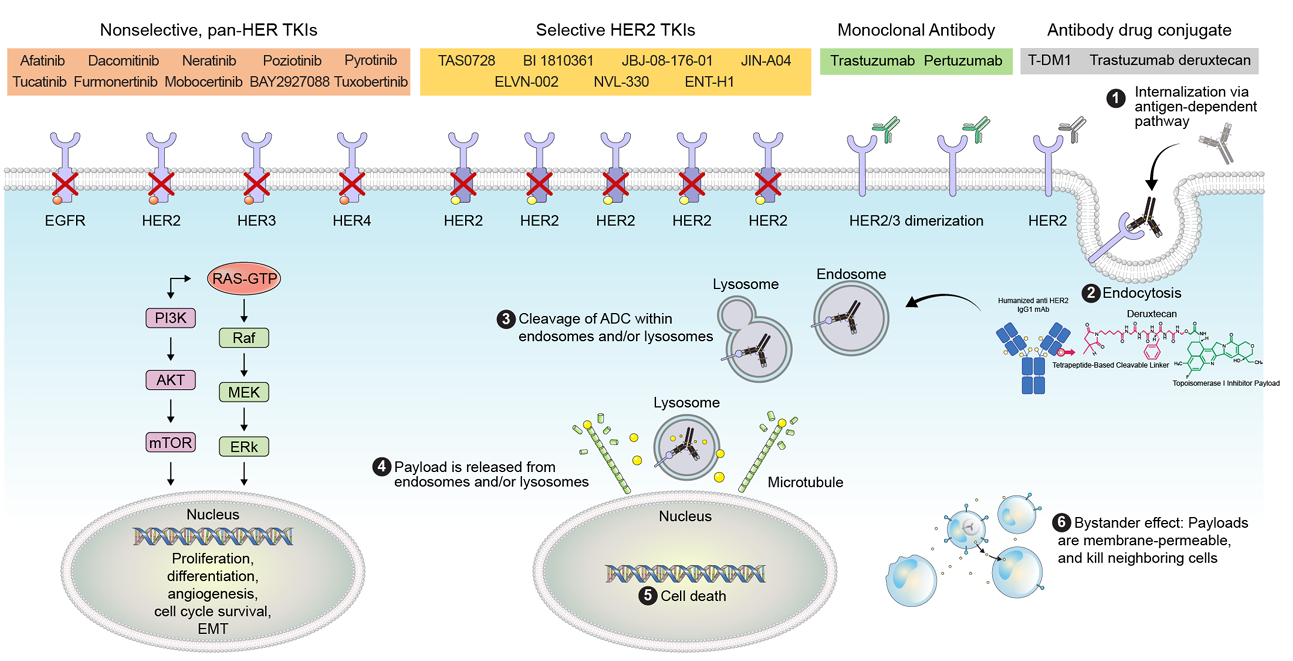 图1 NSCLC中HER2靶向疗法作用机制示意图
图1 NSCLC中HER2靶向疗法作用机制示意图
HER2变异的类型及在不同瘤种中的
差异与相关性
HER2变异发生率:
NSCLC中HER2基因突变、HER2基因扩增和HER2蛋白过表达三种变异形式,均可能导致下游MAPK、PI3K/Akt、Jak-STAT信号通路的激活。NSCLC中HER2突变、HER2扩增和HER2过表达在不同人群中的发生率分别为1-3%、1.4-22%、7.7-23%,三者在中国人群中的发生率分别为2-4%、1.7%、15.4%[2-5]。
不同变异类型的特点与差异:
HER2突变
HER2突变包括胞外配体结构域(ECD)、α-螺旋跨膜结构域(TM)和细胞内酪氨酸激酶结构域(TKD)的异质性改变。HER2遗传多样性低,与女性、从不吸烟、腺癌组织学类型和脑转移相关。HER2突变主要发生在细胞内酪氨酸激酶结构域(TKD)中,能诱导ATP结合口袋的构象变化,从而增加酪氨酸激酶活性并诱导PI3K/AKt和MEK致癌信号通路的激活。由于缺乏有效的靶向治疗药物,HER2突变NSCLC患者的预后相比EGFR突变或ALK融合患者更差。早期研究显示,HER2突变常与其他致癌驱动因子相互排斥,但随着NGS的广泛应用,临床上发现HER2突变可伴随EGFR突变、ALK重排、ROS重排同时发生。
HER2过表达
HER2过表达的潜在致癌机制尚不完全明确,但细胞表面HER2蛋白的增加会增强含HER2异源二聚体的形成,从而改变细胞极性和粘附并激活相关致癌信号传导通路[8]。过表达的机制还可归因于染色体复制和多体性(HER2基因拷贝数高于5或6,但HER2/CEP17比值<2)。HER2过表达与较差的生存期相关,但可能的原因还有对放化疗的耐药性,目前研究结果不完全一致,仍需要更多探索。HER2过表达在高分化腺癌中更常见,由于应用方法、不同研究的患者人群和HER2阳性定义的不同,HER2过表达的鉴别仍存在争议。
HER2扩增
与乳腺癌不同的是,NSCLC中HER2扩增的发生率较低,在未接受靶向治疗的NSCLC中,HER2扩增也是主要的致癌驱动因素;而HER2扩增可能是EGFR-TKI的获得性耐药机制。研究显示,HER2扩增能增加NSCLC细胞的侵袭能力;且不依赖于配体,可组成性激活HER2和EGFR[6]。HER2扩增与胸膜浸润、从不吸烟和女性等因素密切相关,目前而言其预后意义尚不明确[7]。
HER2扩增的定义来源于乳腺癌领域,通常被定义为HER2基因扩增拷贝数与着丝粒的比值(HER2/CEP比值≥2)和/或基因拷贝数>6。必须注意的是,目前临床上其他临界值也在使用中,因此导致不同研究间HER2扩增定义的不同。
HER2热点突变、基因组特征与肿瘤微环境
热点突变:
HER2最常见的突变发生于20号外显子的框内插入突变,是在密码子775- A775_G776insYVMA处12个碱基的重复插入,可能影响激酶结构域的αC-B4环,其次为G776 delinsVC、G778_P780insGSP。20号外显子YVMA突变尤其与脑转移的发生率高和化疗疗效差相关[9]。
HER2 20号外显子插入与EGFR 20号外显子插入突变在结构具有同源性,并影响相同的结构区域:770-774残基处的αC-螺旋和包含残基775-783的环区。与EGFR相似,HER2活性受αC-螺旋调控,αC-螺旋在无活性外向构象和活性内向构象之间切换。与不发生HER2信号传导通路相比,HER2 20号外显子插入突变表现出信号转导通路放大、EGFR磷酸化、细胞增殖和侵袭性增加的特点。
一项在中国开展的回顾性研究发现,HER2突变包含47 种突变亚型,最常发生在酪氨酸激酶结构域(TKD)(80.1%),包括发生在20号外显子(76.2%)、19外显子(3.0%) 和21外显子(1.2%)的突变,可见20号外显子突变最常见[10]。
HER2 突变最常见位点包括:Y772_A775dup(55.0%, 371/674)、G776delinsVC (8.3%,56/674)、S310F (7.7%,52/674)、G778_P780dup (5.6%,38/674)、V659E(4.1%,28/674)、L755P(1.9%,13/674)。
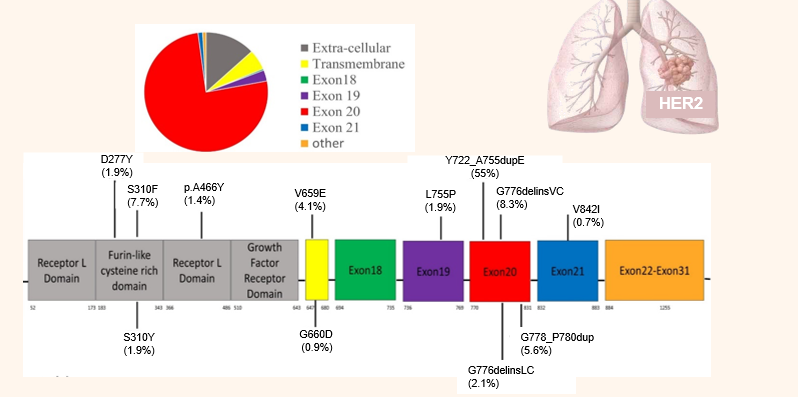 图2 NSCLC中HER2热点突变
图2 NSCLC中HER2热点突变
基因组特征与肿瘤微环境:
携带HER2 20号外显子插入突变NSCLC的全外显子组测序显示,此类患者肿瘤突变负荷(TMB)较低,共突变少,与EGFR突变NSCLC的特点类似。其他非20号外显子插入突变显示出与EGFR野生型NSCLC相似的特征,TMB水平相对较高、共改变突变较多、和吸烟相关的突变特征[11,12]。
HER2突变NSCLC具有非炎性肿瘤微环境,与PD-L1高表达发生率低、中位TMB较低相关。临床前研究显示,HER2突变NSCLC可抑制调控先天免疫机制的cCAS-STING通路,以阻滞TBK1- STING信号传导。总之,诸多特征导致了HER2突变NSCLC的免疫“冷”环境。
HER2突变是NSCLC新兴靶点,
具有重要临床价值
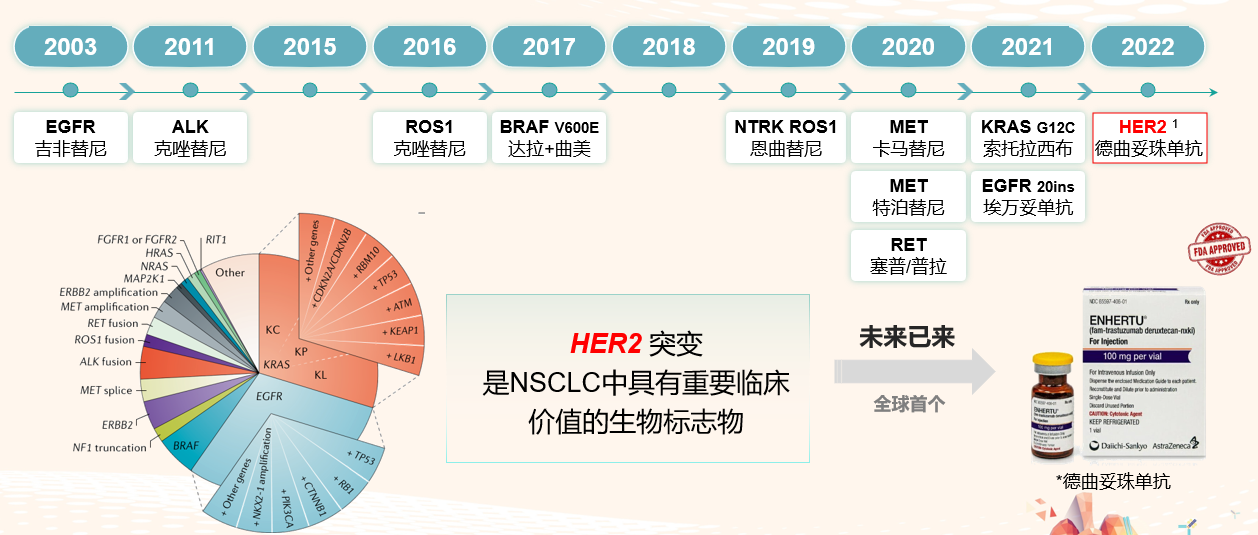 图3 肺癌的可用靶点及发展
图3 肺癌的可用靶点及发展
肺癌的精准治疗发展至今,已有多种驱动基因突变已有可及靶向治疗药物可用。2022年8月,FDA加速批准德曲妥珠单抗用于HER2 激活突变、不可切除或转移性NSCLC的后线治疗,因此德曲妥珠单抗成为肺癌领域首款获得FDA批准的ADC药物;且德曲妥珠单抗用于HER2突变晚期NSCLC的后线治疗目前是NCCN指南(2A类推荐)和CSCO指南(II级推荐)的重要治疗推荐。HER2突变作为NSCLC治疗领域具有重要临床价值的生物标志物,目前已有可及药物可用,期待德曲妥珠单抗在中国的上市。
总结
HER2变异在不同瘤种中具有不同的生物学作用机制,HER2独特的结构是其发挥致癌作用的关键。NSCLC中HER2 20号外显子插入突变是最常见的突变类型,可能与化疗疗效差、脑转移相关,且HER2突变NSCLC属于非炎性肿瘤微环境(冷肿瘤),这可能是此类患者免疫疗效不佳的原因之一。令人鼓舞的是,随着新型药物和精准治疗的快速发展,目前已有HER2 ADC德曲妥珠单抗获得FDA批准,期待德曲妥珠单抗早日在中国的获批上市,以造福更多中国患者。
[1]I.A. Vathiotis, A. Charpidou, N. Gavrielatou, K.N. Syrigos, HER2 Aberrations in Non-Small Cell Lung Cancer: From Pathophysiology to Targeted Therapy, Pharmaceuticals (Basel) 14 (12) (2021), https://doi.org/10.3390/ph14121300.
[2]Jebbink M, et al. Cancer Treat Rev, 2020, 86:101996;
[3]Song Zhengbo,et al. Oncotarget vol. 7,47 (2016): 78152-78158;
[4]Song Z,et al. Ann Oncol. 2020;31:S859;
[5]Li X,et al. BMC Cancer. 2016;16(1):828
[6]J. Zeng, W. Ma, R.B. Young, T. Li, Targeting HER2 genomic alterations in non- small cell lung cancer, J. Natl. Cancer Center 1 (2) (2021) 58–73, https://doi.org/ 10.1016/j.jncc.2021.04.001.
[7]S.S. Ramalingam, J.C. Yang, C.K. Lee, T. et al.Osimertinib As First-Line Treatment of EGFR Mutation-Positive Advanced Non-Small-Cell Lung Cancer, J Clin Oncol 36 (9) (2018) 841–849, https://doi.org/10.1200/jco.2017.74.7576.
[8]M.A. Olayioye, Intracellular signaling pathways of ErbB2/HER-2 and family
members, Breast Cancer Res 3 (6) (2001) 385, https://doi.org/10.1186/bcr327.
[9]S. Yang, Y. Wang, C. Zhao, et al. X. Exon 20 YVMA insertion is associated with high incidence of brain metastasis and inferior outcome of chemotherapy in advanced non-small cell lung cancer patients with HER2 kinase domain mutations, Transl Lung Cancer Res 10 (2) (2021) 753–765. https://doi.org/10.21037/tlcr-20-559.
[10] Fan Xu, et al. J Clin Oncol 40, 2022 (suppl 16; abstr 8546)
[11] A.C. Tan, S.P.L. Saw, J. Chen, et al.Clinical and Genomic Features of HER2 Exon 20 Insertion Mutations and Characterization of HER2 Expression by Immunohistochemistry in East Asian Non-Small-Cell Lung Cancer, JCO Precis Oncol 6 (2022) e2200278.
[12] K. Chen, G. Pan, G. Cheng, F. et al, Immunemicroenvironment features and efficacy of PD-1/PD-L1 blockade in non-small cell lung cancer patients with EGFR or HER2 exon 20 insertions, Thorac Cancer 12 (2) (2021) 218–226, https://doi.org/10.1111/1759-7714.13748.
排版编辑:肿瘤资讯-Ale











 苏公网安备32059002004080号
苏公网安备32059002004080号


