这篇文章
2023
年
8
月发表于
Cancer Cell
(
IF=48.8, A distinct stimulatory cDC1 subpopulation amplifies CD8+ T cell responses in tumors for protective anticancer immunity
),该文章利用机器学习发现了一群可以调控
CD8+T
细胞抗肿瘤免疫功能的树突细胞亚群,其行文思路和关于文章研究重点的把握值得学习。
研究背景 : I 型经典树突细胞( cDC1 )是抗肿瘤免疫的重要细胞,小鼠肿瘤模型中的研究表明: T 细胞介导的肿瘤杀伤以及机体对免疫检查点阻滞疗法( ICB )的应答均需要 cDC1 的参与,且 cDC1 的数量与患者存活时间和对 ICB 疗法的应答强度有关。 cDC1 影响抗肿瘤免疫主要是由于其可以调控肿瘤特异性细胞毒性 CD8+T 细胞应答,而这能反映出 cDC1 (主要指表达趋化因子受体 CCR7 的迁移型 cDC1 )获得肿瘤抗原,并将其转运至淋巴结激活 CD8+T 细胞功能的强弱。
除了激活 T 细胞, cDC1 还参与调控 T 细胞抗肿瘤免疫。 cDC1 分泌募集 CD8+T 细胞至肿瘤的趋化因子,然后通过向 T 细胞呈递肿瘤抗原并分泌调控 T 细胞存活和效应功能的细胞因子,激活 CD8+T 细胞,促进其扩增。 但 cDC1 如何调控 T 细胞抗肿瘤免疫,以及 cDC1 在抗肿瘤免疫中发挥多大的作用未知 。此外,尽管 T 细胞活化能有效启动抗肿瘤 T 细胞应答,但仍很难完全清除肿瘤。 研究指出,淋巴结内激活的 CD8+T 细胞由 TCF1+CD8+T 细胞(干细胞样 / 耗竭 T 细胞前体细胞)组成,虽然其不具有细胞毒性,但可以产生 TCF1-TIM3+ 的效应 T 细胞,其转化调控的具体机制未知 。淋巴组织里的 T 细胞应答的启动需要幼稚 T 细胞和特异性 cDC1 亚群直接相互作用,但 cDC1 对 TCF1+CD8+T 细胞激活和效应分化功能的调控重要性未知。
研究结果:
1 、 Tumor imaging-based deep learning reveals a spatial organization of intratumoral cDC1 and CD8+ T cells associated with cancer immunity outcome.
为确定肿瘤组织参与抗肿瘤免疫的免疫细胞种类,作者分别在进展性和退行性肿瘤模型进行验证。在缺少 cDC1 或者 CD8+T 细胞的情况下,退行性肿瘤可继续进展,表明这写些细胞是抗肿瘤免疫所必须的(图 1A )。作者猜测这两种细胞在肿瘤内的互作可能影响肿瘤进展,所以训练出了一个基于肿瘤内细胞分布 3D 照片的 AI 深度学习模型,该模型建立起了肿瘤内细胞分布方式和肿瘤严重程度间的关系,可用于肿瘤预后的预测(图 1B )。验证结果显示,该模型能成功区分进展性和退行性肿瘤,精度和准确率高(图 1C-D )。这里作者构建了高精度和高准确度的 AI 大模型,可根据 cDC1 和 CD8+T 细胞的空间位置对肿瘤预后进行预测。
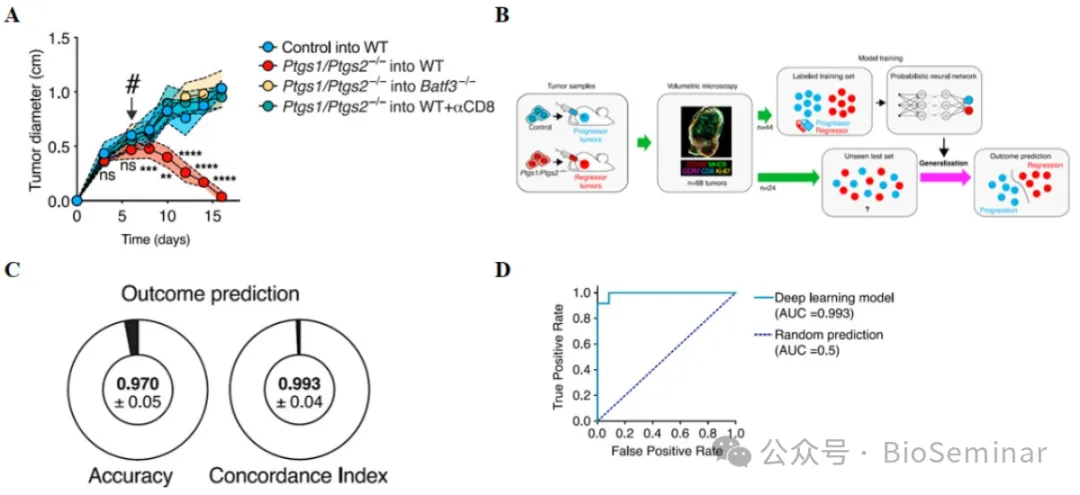
图1
2 、 Formation of cDC1-CD8+ T cell clusters in tumors is associated with protective anti-cancer immunity.
接下来,作者用 AI 大模型对肿瘤组织内 cDC1 和 CD8+T 细胞的空间位置与抗肿瘤免疫之间的关系进行了检测。肿瘤组织外周的 cDC1 和 CD8+T 细胞空间位置与肿瘤预后相关,这也被免疫荧光结果所验证(图 2A-B )。分析二者位置与肿瘤预后关系发现,肿瘤组织外周 cDC1 和 CD8+T 细胞互作更常见于退行性肿瘤,而在进展性肿瘤模型较为少见(图 2C , Control 为进展性肿瘤, Ptgs1/Ptgs2 -/- 为退行性肿瘤)。因此,作者通过使用 AI 模型对不同肿瘤模型进行检测,证实了 cDC1 和 CD8+T 细胞在肿瘤外周的相互作用能增强抗肿瘤免疫并抑制肿瘤进展。
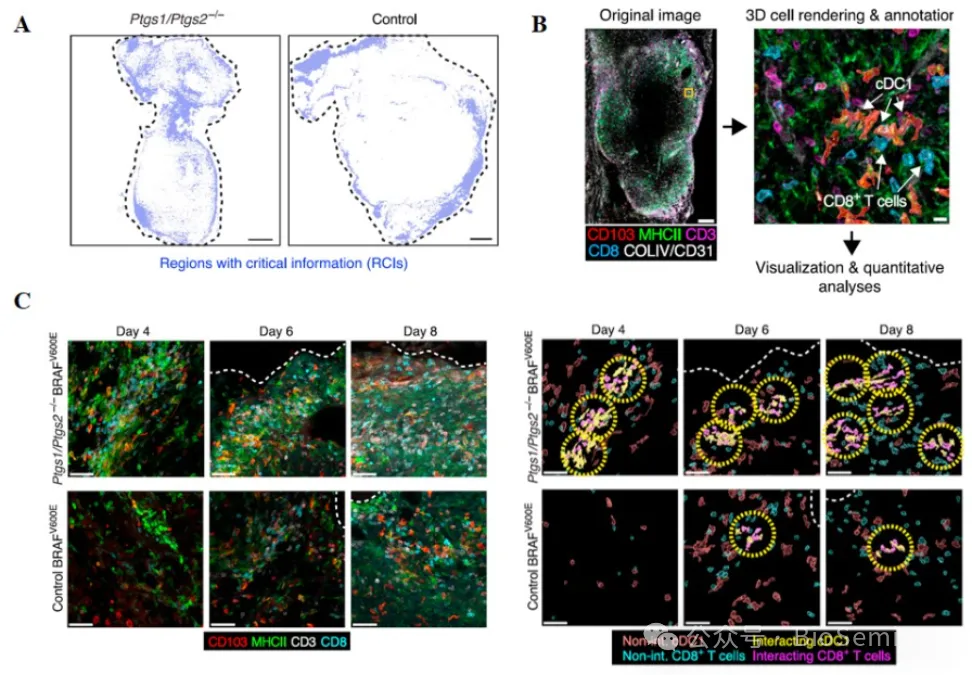
图2
3 、 cDC1-CD8+ T cell clusters form in the tumor stroma and constitute niches for T cell activation.
那么 cDC1 和 CD8+T 细胞相互作用对 CD8+T 细胞有什么影响,这种影响是否能调控抗肿瘤免疫呢?作者对二者互作发生的区域进行了验证。结果显示,二者互作主要发生在基质与肿瘤实质相接的区域,而没有互作的细胞则散在分布于肿瘤实质和基质(图 3A )。作者还分析了与 cDC1 互作 CD8+T 细胞功能。结果显示,与 cDC1 互作 CD8+T 细胞增殖能力更强,且具有抗原识别能力的 CD8+T 细胞更易与 cDC1 结合(图 3B-C )。因此, cDC1 和 CD8+T 细胞的相互作用有利于 CD8+T 细胞激活,增强抗肿瘤免疫。

图3
4 、 Protective immunity originates from TCF1+ T cells stimulated in stromal cDC1-CD8+ T cell clusters.
接下来,作者对与 cDC1 互作的 CD8+T 细胞进行了分析,以阐明这种互作对其功能的影响。已知 CD8+T 可以为有增殖和分化潜能的 “ 干细胞样 ”TCF1+ 细胞以及有效应功能的 TCF1-TIM3+ 细胞,而 TCF1+T 细胞可以分化生成 TCF-T 细胞,从而维持抗肿瘤免疫。作者检测了与 cDC1 互作 CD8+T 细胞是否表达 TCF1 。结果显示,这类 T 细胞可分为 TCF1+ 和 TIM3+T 细胞,且都表达 T 细胞重要的标志分子(图 4A )。此外, TIM3+T 细胞高表达 CXCR6 以及细胞毒性效应分子 GzmB 、 IFNγ 和 TNF ,表现出抗原特异性细胞毒性(图 4A-B )。相反, TCF1+T 细胞表达低水平的 CXCR6 、 GzmB 、 IFNγ 和 TNF ,细胞毒性低,但增殖能力强(图 4A-C )。作者将 TCF1 和 CXCR6 作为区分两群 T 细胞的标志物。分析发现, TCF1+T 细胞主要位于肿瘤间质,是结合 cDC1 的主要细胞亚群,而 TCF1-T 细胞主要位于肿瘤实质(图 4D )。在 TCF1+T 细胞定植到肿瘤组织时阻断淋巴结 CD8+T 细胞进入肿瘤组织, TIM3+CD8+T 细胞生成受阻,而在 TCF1+T 细胞进入肿瘤组织后阻断该过程, TIM3+CD8+T 细胞仍可以正常生成(图 4E )。这表明肿瘤组织的 TIM3+CD8+T 细胞是由前期定植到肿瘤组织的 TCF1+T 细胞分化而来。此外,阻断 T 细胞流入肿瘤组织并去除 cDC1 后, T 细胞增殖、扩增以及分化功能均严重受损(图 4F-H )。因此,迁 移到肿瘤组织并与 cDC1 相互作用的 TCF1+T 细胞可以活化并分化成熟为具有抗肿瘤免疫功能的 TIM3+CD8+T 细胞。
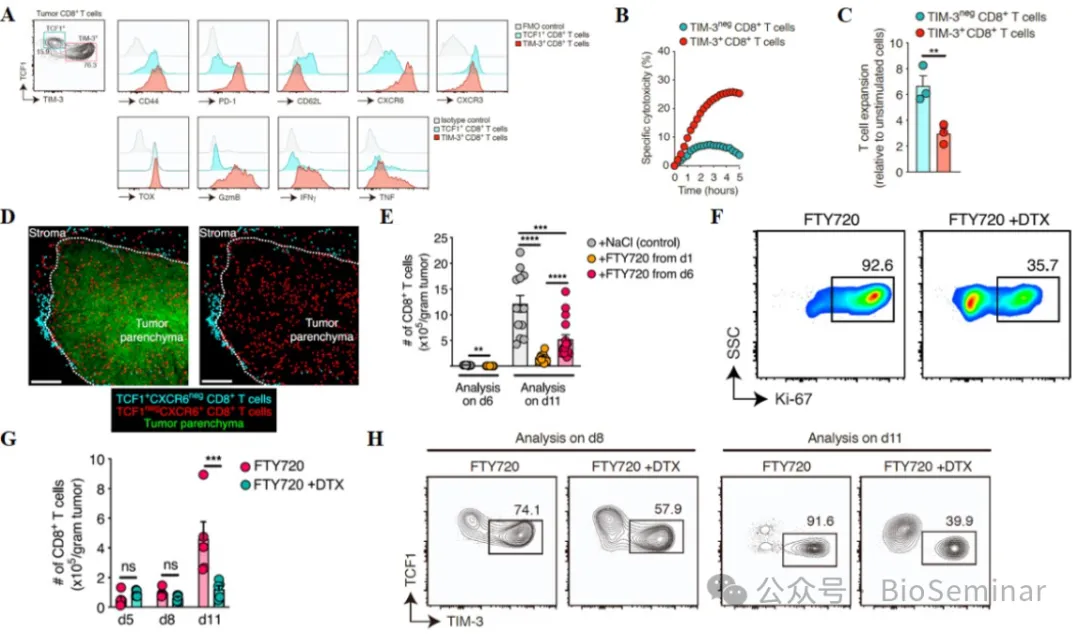
图4
5 、 Spatial organization of cDC1-CD8+ T cell interactions is conserved in human cancers.
为证实上述发现的临床意义,作者对临床患者样本进行了检测。肿瘤患者组织的确存在 cDC1 和 CD8+T 细胞互作,且其数量与肿瘤严重程度呈反比(图 5A-B )。患者样本 cDC1 和 CD8+T 细胞互作主要发生在肿瘤基质,与 cDC1 细胞互作的 CD8+T 细胞增殖能力更强(图 5C-D )。因此,在小鼠肿瘤模型中发现的 cDC1 和 CD8+T 细胞互作同样存在于肿瘤患者样本,且可以作为抗肿瘤免疫强度的参考指标。
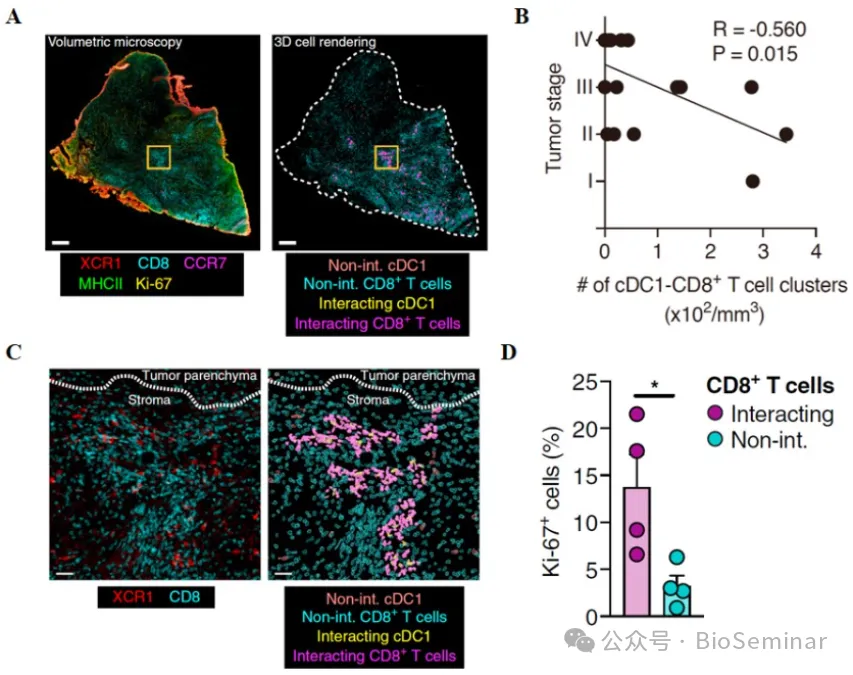
图5
6 、 Intratumoral cDC1-CD8+ T cell clusters are formed by a distinct immunostimulatory MHCIIhiCCR7neg cDC1 subpopulation.
接下来,作者分析了 cDC1 的组成。肿瘤 cDC1 单细胞测序结果显示, cDC1 细胞可以分为 5 个亚群,其中三群表达经典 cDC1 的标志物(图 6A )。经典 cDC1 细胞亚群中,一群为不成熟 cDC1 细胞、一群为激活的具有免疫刺激功能 cDC1 细胞,另一群为活化的迁移性 cDC1 细胞(图 6B )。用 MHCII 和 CCR7 作为标志分子可以很好的将上述三群细胞进行区分,其中, MHCII hi CCR7 neg 和 CCR7+cDC1 细胞处于激活状态,且只有前者分泌 CXCL9 (图 6C-E )。 MHCII lo 的 cDC1 细胞在肿瘤细胞 /TLR3 激动剂存在的情况下生成 MHCII hi CCR7 neg 和 CCR7+cDC1 细胞,且能够分泌 CCL5 和 CCL22 (图 6F-G )。 MHCII 和 CCR7 能很好的将肿瘤 cDC1 亚群分开, MHCII hi CCR7 neg cDC1 细胞是含量最多的亚群(图 6H-I )。另外,不成熟的 cDC1 细胞散在分布于肿瘤实质,而 MHCII hi CCR7 neg 和 CCR7+cDC1 细胞主要分布在间质,且与增殖 CD8+T 细胞互作的主要为 MHCII hi CCR7 neg 亚群细胞(图 6J-K )。因此, MHCII hi CCR7 neg cDC1 细胞是参与抗肿瘤免疫调控的主要亚群。
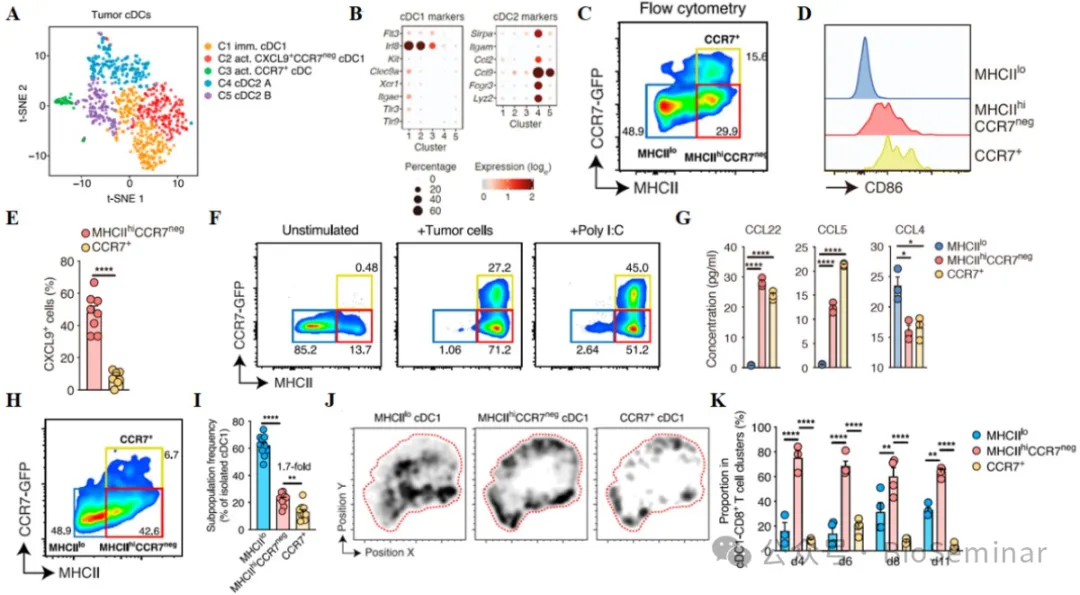
图6
7 、 MHCII hiCCR7 negcDC1 orchestrate CD8+ T cell clustering for protective anti-cancer immunity.
接下来就是搞清楚 MHCII hi CCR7 neg cDC1 细胞调控 CD8+T 细胞的机制。 MHCII hi CCR7 neg cDC1 细胞具有较强的抗原处理和呈递能力,且该细胞亚群能更好的激活 CD8+T 细胞(图 7A-B )。由于 MHCII hi CCR7 neg cDC1 细胞特异性分泌 CXCL9 ,作者推测其在激活 T 细胞过程中具有重要作用。考虑到 MHCII hi CCR7 neg cDC1 细胞通过分泌 CXCL9 和 CXCL10 作用于 CD8+T 细胞的 CXCR3 受体,作者检测了 CXCR3 在 MHCII hi CCR7 neg cDC1 细胞的抗肿瘤免疫中的作用。阻断 CXCR3 抑制 MHCII hi CCR7 neg cDC1 细胞和 CD8+T 细胞的相互作用和 CD8+T 细胞增殖,减少晚期肿瘤内的 CD8+T 细胞数量,促进肿瘤生长(图 7C-F )。因此, MHCII hi CCR7 neg cDC1 细胞通过 CXCL9/CXCL10-CXCR3 通路调控 CD8+T 细胞的激活和抗肿瘤免疫。
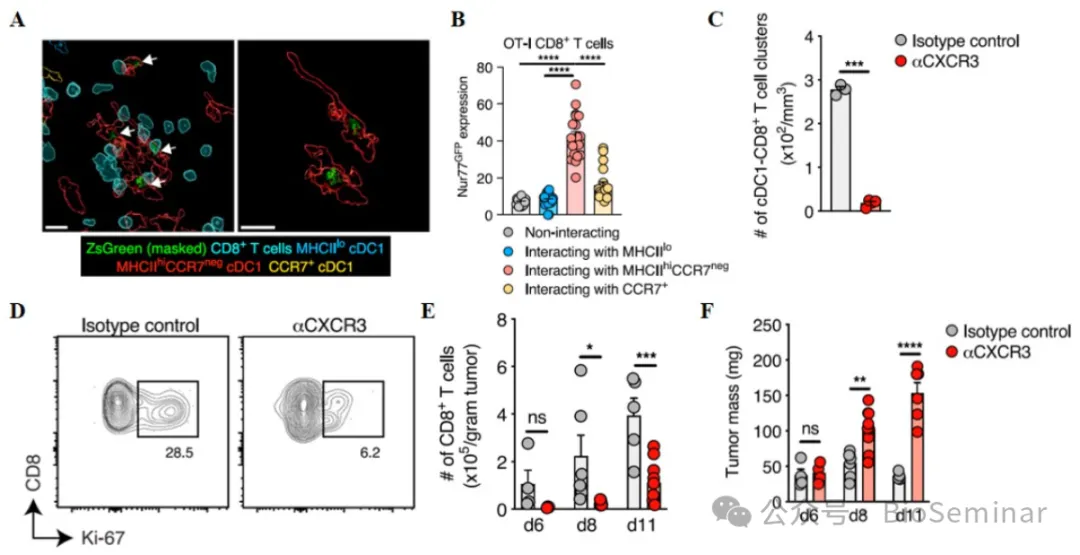
图7
8 、 Formation of cDC1-CD8+ T cell clusters in human cancers positively correlates with patient survival.
最后,作者在患者样本中对该细胞互作对进行了检测。已有患者测序结果显示,不同肿瘤患者 cDC 均存在 CXCL9+CCR7 neg 和 CCR7+cDC1 细胞(图 8A )。免疫荧光检测结果亦显示,患者肿瘤组织样本存在 CXCL9+CCR7 neg cDC1 细胞,且大部分位于互作的 cDC1 和 CD8+T 细胞对(图 8B-C )。这些细胞互作对的数量与患者生存率呈正相关(图 8D )。为了扩大本文发现的适用范围,作者在 TCGA 大数据中进行了检测。 CXCL9+CCR7 neg cDC1 细胞的标志性基因表达与不同癌症患者生存呈正比(图 8E )。此外,作者还在接受抗 PD1 免疫疗法的患者中进行了检测。结果显示, CXCL9+CCR7 neg cDC1 细胞的标志性基因表达水平与应答和患者生存呈正相关(图 8F-G )。因此,肿瘤患者组织存在 CXCL9+CCR7 neg cDC1 细胞刺激 CD8+T 细胞并增强其抗肿瘤免疫,与患者存活呈正相关。
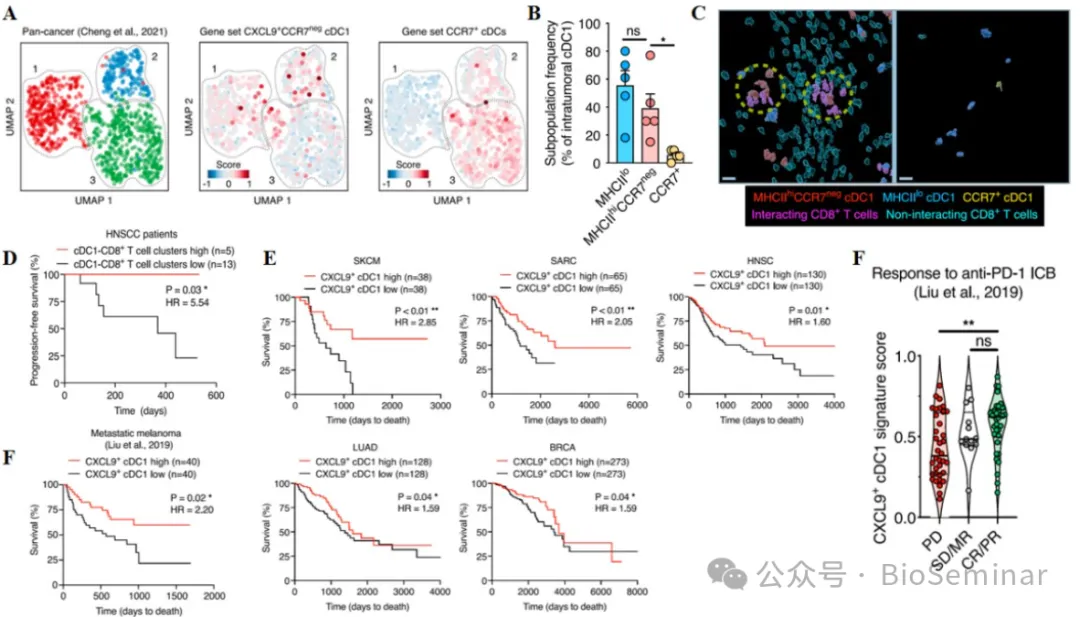
图8
Take-home message :
这篇文章利用人工智能来筛选研究对象,立意新颖,解决问题的方法也比较新颖有趣,而且其要解决的也是抗肿瘤免疫的重要问题,很显然,这类文章是追求热点的大子刊们所需要的。总的来说,全文利用 AI 大模型来进行类似于高通量的筛选,找到了影响肿瘤进展的靶细胞,然后利用单细胞测序对参与抗肿瘤免疫的细胞亚群进行分析,最后再在患者样本中进行验证(发 Cancer Cell 这类大子刊所必须的)。有意义的科学问题 + 有趣新颖的解决方法 + 有基础研究(新的抗肿瘤免疫细胞亚群)及临床(与患者预后直接相关)意义的重要发现,想发大子刊,上述要素是志在大子刊人所必须考虑的。
来源|BioSeminar
排版编辑:肿瘤资讯-ginger











 苏公网安备32059002004080号
苏公网安备32059002004080号


