
研究一:奥希替尼联合或不联合赛沃替尼作为1L方案治疗新发MET异常、EGFRm晚期NSCLC(CTONG 2008):一项II期试验
摘要号:PL04.10
汇报人:杨衿记 教授
CTONG 2008(FLOWERS)是一项前瞻性、双组、随机、多中心研究。研究对象为初治的IIIB-IV期NSCLC患者,其患有新发MET异常(MET amp 和/或 MET OE)和 EGFRm。主要终点为研究者评估的客观缓解率(ORR)。次要终点包括疾病控制率(DCR)、缓解持续时间(DoR)、无进展生存期(PFS)、总生存期(OS)、安全性和耐受性。
44 例患者入组并随机分组。23例和21例患者分别接受奥希替尼单药治疗,或奥希替尼联合赛沃替尼治疗。中位年龄为58岁(29-74岁);男性占52.3%(23例)。86.4%(38例)患者ECOG PS为1,34.1%(15例)患者有脑转移。截至2024年5月28日,中位随访时间为8.2个月。队列1和队列2的ORR分别为60.9%(95%CI 38.5-80.3%)和90.5% (95%CI 69.6-98.8%),DCR分别为87%(95%CI 66.4-97.2%)和95.2%(95%CI 76.2-99.9%)。中位 DoR分别为 8.4 个月和 18.6 个月,尚未成熟。队列1和队列2的中位PFS分别为9.3(95% CI 7.4-NE)和19.6(95% CI 10.2-NE)个月,成熟度分别为34.8%和23.8%。100%(44例)患者报告了治疗相关不良事件(TRAEs),队列1中17.4%(4例)患者报告TRAEs≥3级,队列2中57.1%(12例)报告TRAEs。队列1中最常见的TRAE是腹泻(56.5%)、皮疹(52.2%)和瘙痒(43.5%),队列2中最常见的TRAE是皮疹(52.4%)、血小板减少(52.4%)和外周水肿(42.9%),多为1级或2级。未观察到新的安全信号和治疗相关死亡。
总而言之,这是首个前瞻性随机研究,旨在探讨奥希替尼联合联合或不联合赛沃替尼治疗新发MET异常、EGFRm晚期NSCLC患者的有效性和安全性。奥希替尼和赛沃替尼联合治疗显示ORR有临床意义的改善,且安全性可控,可能为这些患者提供新的一线治疗选择。
研究二:SAFFRON-301:替雷利珠单抗联合Sitravatinib在化疗及抗PD-(L)1治疗期间/后进展的晚期/转移性NSCLC中的应用
摘要号:OA06.03
汇报人:吴一龙 教授

这项开放标签、随机、III期临床试验,旨在评估替雷利珠单抗联合Sitravatinib对比多西他赛(doc)用于既往经治局部晚期/转移性NSCLC患者的疗效(NCT04921358)。
结果显示,截至2023年12月20日,187例患者被随机分配至替雷利珠单抗联合Sitravatinib组,190例患者分配至多西他赛组。试验组和对照组的中位年龄为63.0/63.0岁,中位随访时间分别为8.0/7.6个月。大多数患者(TIS+sitra/doc)为男性(81.8%/79.5%)、亚洲人(93.6%/93.2%)、ECOG PS评分为1(74.9%/75.8%)、接受过1线既往化疗(75.9%/73.7%)、具有转移性疾病(77.0%/74.2%)。
替雷利珠单抗联合Sitravatinib组和多西他赛组的中位OS分别为11.5个月和11.4个月;HR为1.0。IRC评估两组的中位PFS分别为4.4个月和2.9个月(HR=0.82)。IRC评估两组的ORR分别为12.3%和12.6%。
不良反应方面,联合组不良事件(TEAEs)发生率高于多西他赛组。联合组/多西他赛组有≥5%的患者发生的3级及以上TEAEs。
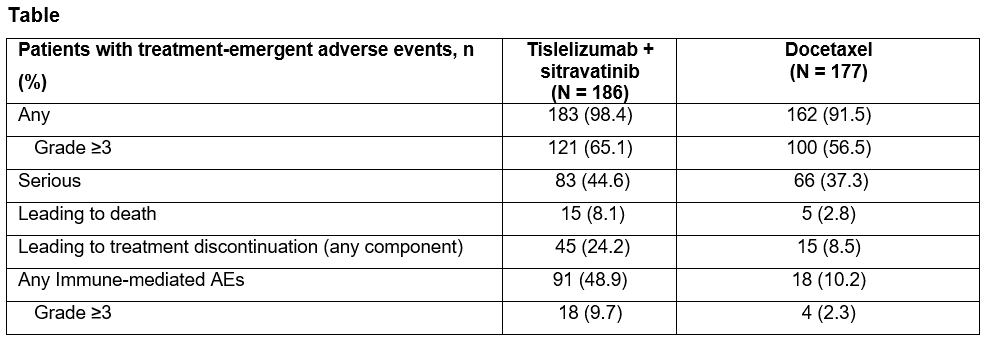
总体上,在既往经治晚期/转移性NSCLC患者中,替雷利珠单抗联合Sitravatinib表现出与多西他赛相似的疗效,并且与较高的不良事件发生率相关。
研究三:KRAS G12C抑制剂IBI351在晚期非小细胞肺癌的研究:II期研究更新分析
摘要号:OA14.05
汇报人:周清 教授
KRAS G12C突变是非小细胞肺癌(NSCLC)患者中一个被广泛认可且具有前景的治疗靶点,目前临床上对此存在显著的未满足需求。IBI351,也称为GFH925,是一种针对KRAS G12C的强效共价不可逆抑制剂。
在这项研究中,截至2023年12月13日,共有116名患者入组(ECOG PS 1:91.4%;脑转移:30.2%;既往接受过抗PD-1/PD-L1抑制剂和基于铂的化疗治疗:84.5%)。
根据IRRC评估,确认的ORR为49.1%(95% CI:39.7%-58.6%),DCR为90.5%(95% CI:83.7%-95.2%)。在57名确认反应的患者中,中位反应持续时间(DoR)未达到(22名(38.6%)患者发生事件)。中位 PFS 为 9.7个月(95% CI:5.6-11.0个月)。OS 数据尚不成熟。
107例(92.2%)患者出现了治疗相关不良事件(TRAEs),48例(41.4%)患者的TRAEs≥3级。常见的不良反应包括:贫血(44.8%)、丙氨酸氨基转移酶升高(28.4%)、天门冬氨酸氨基转移酶升高(27.6%)、衰弱(26.7%)和蛋白尿(25.0%)。9例(7.8%)患者因TRAEs中断治疗。在可进行生物标志物评估的患者(n=95 )中,所有患者的组织样本KRAS G12C均为阳性,其中72名患者的血液样本为阳性,23名患者的血液样本为阴性。血液和组织中均有KRAS G12C的患者基线肿瘤负荷较高(P <0.05),PFS较差(P <0.05)。肿瘤突变分析发现,TP53(45.3%)、STK11(30.5%)和KEAP1(21.1%)是与KRAS G12C最常见的共突变基因。在突变频率≥5%的13个基因中,6个基因(STK11、KEAP1、PIK3CG、POLE、SMAD4、BRINP3)的突变与较差的PFS显著相关(P<0.05)。此外,STK11基因的突变还与基线时较高的肿瘤负荷和较低的反应率显著相关(P<0.05)。
研究提示,在KRAS G12C突变的NSCLC中,IBI351单药治疗的最新结果继续支持其作为一种具有持久疗效和可控安全性的新治疗选择。
研究四:循环肿瘤DNA定义分子水平寡转移非小细胞肺癌
摘要号:OA05.05
汇报人:傅睿 教授
循环肿瘤DNA(ctDNA)可以在分子上重新定义具有诱导寡转移性疾病的人群,并指导LCT时机选择。在这项观察性研究中,入组了全身治疗后发生寡转移性疾病的晚期NSCLC患者(称为诱导寡转移性NSCLC)。使用靶向338个肺癌相关基因的高灵敏度面板测定在围手术期进行全面的ctDNA监测。
研究共分析了来自68例合格患者的339份血浆样本,主要为腺癌(n=63,92.6%)和寡持续性(n=58,85.3%)。建议符合放射学寡转移标准且LCT前血浆ctDNA阴性的患者应定义为分子寡转移(MO)NSCLC,而LCT前ctDNA阳性的患者应定义为非分子寡转移(non-MO)NSCLC。 MO NSCLC患者的无进展生存期(PFS)优于非MO疾病患者(P=0.004,HR=3.05,95%CI=1.16-8.05)。
关于LCT的时间,较长的全身治疗持续时间与较好的PFS相关(P<0.05),在药物治疗持续时间相同的患者中,MO患者的PFS长于非MO患者(P<0.05)。研究还发现,与维持或转变为阳性的患者相比,LCT后1个月维持或转变为阴性ctDNA的患者实现PFS的比例更高,其大于相应药物的相应III期试验中报告的中位PFS(P<0.05)。 值得注意的是,在11例患者的LCT后ctDNA中发现了耐药突变,其中10例患者经历了疾病进展。 此外,LCT后ctDNA监测显示放射学进展前长达14.9个月的潜在耐药机制,中位提前时间为5.0个月。当出现放射学进展时,它允许根据ctDNA结果立即修改治疗方案。
研究提示,未检测到的前巩固治疗(pre-LCT) ctDNA可能是真正的诱导寡转移性疾病,可将其定义为分子寡转移性NSCLC。pre-LCT ctDNA和全身治疗持续时间的组合有助于早期预测临床结局和确定诱导寡转移性NSCLC的LCT窗口。
研究五:中国IV期/复发性NSCLC和PD-L1≥1%患者中的纳武利尤单抗 + 伊匹木单抗 vs化疗(Checkmate 227 CHESS)
摘要号:MA11.05
汇报人:吴一龙 教授
这项桥接研究的目的是评价与CheckMate 227第1A部分相比OS获益(定义为风险降低≥50%)的一致性。
研究结果显示,253例患者被随机分配;126例接受NIVO+IPI治疗,127例接受化疗。治疗组之间的基线特征平衡。大多数患者为男性(85%);中位年龄为62.0岁(范围:29-77岁)。NIVO+IPI组的中位OS为20.99个月,化疗组为15.11个月(HR,0.85,符合显示一致OS获益的标准;表)。NIVO+IPI组未达到(NR)肺癌症状评分平均症状负担指数的至症状恶化中位时间,化疗组为22.6个月(95%CI,11.5-NR)(HR,0.52 [95%CI,0.30-0.90])。
不良反应方面,在两个治疗组中观察到任何级别的治疗相关不良事件(TRAE)发生率相似(NIVO+IPI,88.9%;化疗,92.7%)。NIVO+IPI组发生的3/4级TRAE低于化疗组(35.7% vs 48.8%)。
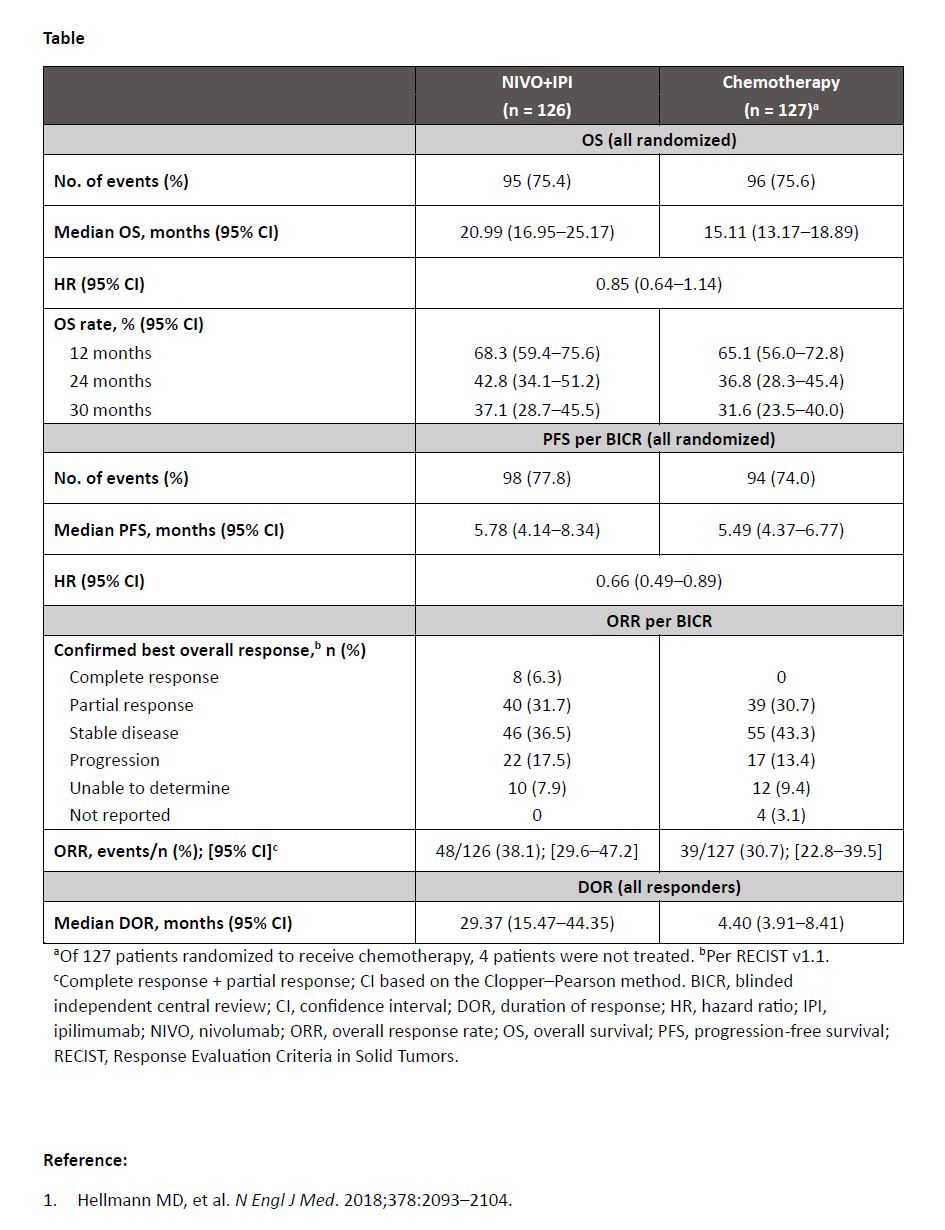
总体而言,与CheckMate 227全球研究相比,接受一线NIVO+IPI vs 化疗的晚期NSCLC和肿瘤PD-L1 ≥1%的中国患者的OS结局一致,无新的安全性信号。
研究六:晚期ROS1融合阳性非小细胞肺癌经克唑替尼和化疗治疗后使用洛拉替尼的II期研究
摘要号:MA06.05
汇报人:吴一龙 教授
这是在中国开展的一项多中心、单臂II期研究(NCT05297890),探讨接受洛拉替尼治疗的局部晚期或转移性ROS1+ NSCLC患者的疗效和安全性结果。
截至数据截止日(2023年12 月26 日),共入组70 名患者。中位年龄为 55.0 岁(范围:32岁-80岁)。其他基线特征包括:女性(61.4%);脑转移(62.9%);腺癌(94.3%)。中位治疗时间为 7.4 个月(范围:0.2-19.0 个月)。该研究达到了主要目标,ICR评估的ORR达到了临床意义和统计学意义的显著改善。在疗效可评估的患者人群中(n=65),ICR-ORR为44.6%。37名基线有颅内病灶的患者中,ICR ORR 达 43.2%,其中8人(21.6%)达到 完全缓解(CR)。详细疗效结果见表1。
不良反应方面,所有入组患者(n=70)都经历了至少一次治疗诱发的不良事件(TEAE);最常见的TEAE为高胆固醇血症*(95.7%)和高甘油三酯血症*(85.7%)。30例(42.9%)患者出现了≥3级治疗相关的AEs(TRAEs);最常见的≥3级TRAEs是高甘油三酯血症*(27.1%)和高胆固醇血症*(15.7%)。12例(17.1%)患者出现了TRAE而导致药物减量。没有导致永久性中断治疗或导致死亡的 TRAE 报告。
表1 洛拉替尼治疗晚期ROS1+ NSCLC患者的疗效 (ICR评估)
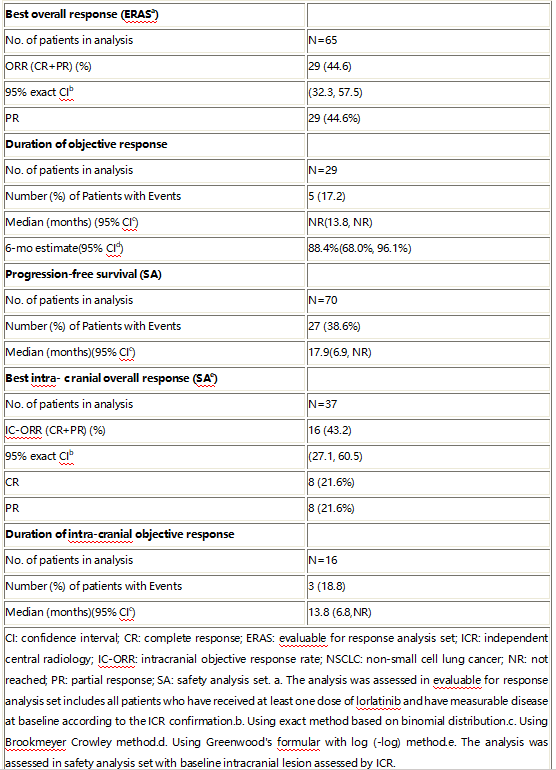
研究提示,在接受克唑替尼和化疗治疗后的晚期ROS1+ NSCLC患者中,洛拉替尼表现出稳健而持久的客观反应和显著的颅内活性。洛拉替尼耐受性良好,该研究的安全性数据与已知的安全性特征一致。
研究七:基于蛋白基因组的EGFR突变非小细胞肺癌脑膜转移分子分型研究
摘要号:MA07.08
汇报人:郑媚美 教授
EGFR突变的晚期NSCLC中,脑膜转移(LM)越来越常见,由于治疗选择有限,导致预后不良。 既往研究表明脑脊液(CSF)中的循环肿瘤DNA(ctDNA)检测提示预后不良。然而,尚缺乏对LM的分子表型更深入的了解,阻碍了潜在治疗靶点的探索。
为了探索代表侵袭性癌症表型的CSF ctDNA检测的蛋白质组学相关性,研究比较了阳性和阴性CSF ctDNA之间的蛋白质组学谱。结果发现,ctDNA阳性CSF中MUC1、SUSD2、RNPEP、SETPB、PDCD6IP、AMY2B等基因和基因组(细胞周期、代谢和炎症反应)表达显著上调。
使用定量蛋白质组学数据进一步研究分子模式,M组的CSF与BM组或非LM/BM组有明显区别:LM组中检测到的蛋白质数量显著较高; LM的上调蛋白质分为5个功能类别:血脑屏障破坏、肿瘤生长和迁移增加、内吞作用和免疫反应失调。与BM和非LM/BM组相比,蛋白质的差异表达被选为LM特异性的,并强调了LM中的分子异质性:我们使用LM特异性蛋白质组学将LM分为两种亚型,每种亚型与不同的临床特征和生存结局相关。亚型Ⅰ的特征是细胞外基质破坏和内吞作用增加,与总生存期显著缩短相关。Ⅰ型患者脑脊液细胞学阳性率高,同时脑脊液ctDNA检测TP53突变率高。
通过整合两个更多案例中LM前后的比较,研究发现了18个与LM相关的蛋白质,其高表达构成了LM特有的标志。其中,多聚免疫球蛋白受体(pIgR)表达增加可能与LM发生的更高倾向相关,这一点得到了非小细胞肺癌和LM患者CSF单细胞RNA测序和细胞系批量RNA测序的外部数据集的证实; pIgR的高表达也表明预后不良。ELISA检测表明,在30例患者的队列中,来自LM的CSF中的pIgR表达升高。 PIgR在软脑膜转移模型中上调。从机制上讲,pIgR增强了癌细胞的干性,以维持软脑膜空间内的癌症生长。
本研究将基因组变异与蛋白质组学联系起来,一致地揭示了更具侵袭性的癌症表型。 更重要的是,研究揭示了LM的蛋白质组分层,这为这种致命并发症的潜在生物学提供了见解,并提示了治疗靶点的机会。
研究八:浸润前病变至晚期肺腺癌演进基因突变图谱特征
摘要号:MA09.09
汇报人:林一多 教授
这项研究回顾性分析了1525个下一代测序(NGS)样本的腺癌,涵盖了根据国际肺癌研究协会TNM分期第八版临床0-IV期的肺腺癌,以识别不同分期的关键基因组特征。使用OncoSG的东亚血统数据集进行预后评估。
结果显示,侵袭前病变和IAC的IA期、IB-II期、III期和IV期分别占220、884、216、118和87个样本。ERBB2、MAP2K1、BRAF、MED12和TSC1在侵袭前病变中显著富集。同时,EGFR、TP53和LRP1B在IA期的IAC中显著富集,APC、KEAP1和POLE仅在IAC中观察到。ERBB2从IA期的IAC到IB-II期显示出持续的显著下降,而TP53显示出持续的显著增加。PTEN和BRCA2也在IB-II期富集。与IB-II期相比,TP53和RB1被确定为III期的关键突变。在III期和IV期之间没有发现显著的突变。包括PTEN、STK11、APC、BRCA2和LRP1B在内的突变与较差的生存相关。在致癌通路方面,RTK-RAS主要涉及侵袭前病变。TP53、细胞周期、WNT和NRF2最初在IA期的IAC中激活,而PI3K和TGF-β最初在IB期激活。
本研究提供了从侵袭前到晚期肺腺癌突变特征的连续描述。阐明这一主题有助于系统地理解肿瘤的发生和发展。
研究九:MRD在局限期非小细胞肺癌更新随访数据
摘要号:MA15.05
汇报人:张嘉涛 教授
研究团队此前的一项研究涉及261例I-III期非小细胞肺癌(NSCLC)患者,强调了纵向MRD的阴性预测值,确定为96.8%。而本次大会公布的研究旨在验证我们之前的发现,并阐明MRD在NSCLC中的临床应用。
在最新的随访中,共有77例(29.5%)复发,中位无病生存期为18.6个月。其中83.1%在复发前可检测到MRD信号,中位领先时间为5.2个月(95%CI:3.9-8.9个月)。总体而言,190例患者(n=190/261,72.8%)在手术后保持纵向未检测到MRD,其中177例保持无病状态,阴性预测值为93.2%。相比之下,有13例患者在纵向未检测到MRD的情况下经历了复发,可能受到两个主要的临床和非临床因素的影响:仅脑转移(n=7)和复发前六个月内缺乏血液样本(n=4)。
在更新的随访支持下,研究结果加强了这样一个论点:纵向未检测到MRD可以作为识别局部NSCLC患者术后治愈的有力指标。
研究十:新辅助信迪利单抗联合化疗治疗局部晚期EGFR突变非小细胞肺癌(CTONG2104): 预设中期分析结果
摘要号:MA15.11
汇报人:张潮 教授
这是一项开放标签的II期前瞻性试验,采用Simon两阶段设计。纳入了35名IIB-III B(N2)期EGFR突变(包括非敏感突变)患者,将接受最多3个周期的信迪利单抗加上化疗随后进行手术,I期队列患者观察,II期队列患者辅助奥希替尼治疗。
截至2024年7月15日,共有35名患者连续入组,其中33名完成了新辅助治疗和手术,而其他患者未接受手术。常见的与治疗相关的不良事件(TRAEs)包括脱发、恶心和感觉异常,17.1%的患者发生3-4级粒细胞减少症。确认的客观缓解率(ORR)为60.0%(21/35),1例患者疾病进展(PD)。在接受新辅助免疫化疗的患者中,主要病理缓解(MPR)和病理完全缓解(pCR)率分别为34.3%(12/35)和11.4%(4/35)。基线PD-L1表达与MPR状态无相关性(p=0.57),但无吸烟史的患者显示出更高的MPR率(p=0.005)。在两个阶段队列的中位随访时间为14.4个月,35名患者中有9名(25.7%)出现疾病复发/进展。中位无事件生存期(EFS)为21.1个月,12个月和18个月的EFS率分别为90.7%和71.9%。尽管基于病理学缓解状态的EFS无显著差异,但达到pCR的患者显示出EFS的有利趋势。
本研究中没有观察到OS事件。所有复发/进展疾病的患者随后接受EGFR-TKIs治疗的ORR为100%,1例患者达到完全缓解(CR)。接受新辅助免疫化疗后随后接受EGFR-TKIs或辅助奥希替尼治疗的患者耐受性良好。
研究中常见的TRAEs包括腹泻、皮疹和口腔溃疡。在接受辅助奥希替尼治疗的II期队列中,有4名(23.5%)患者发生3-4级ALT/AST升高,而在I期队列中疾病复发后接受奥希替尼治疗的患者中没有观察到3-4级TRAEs。
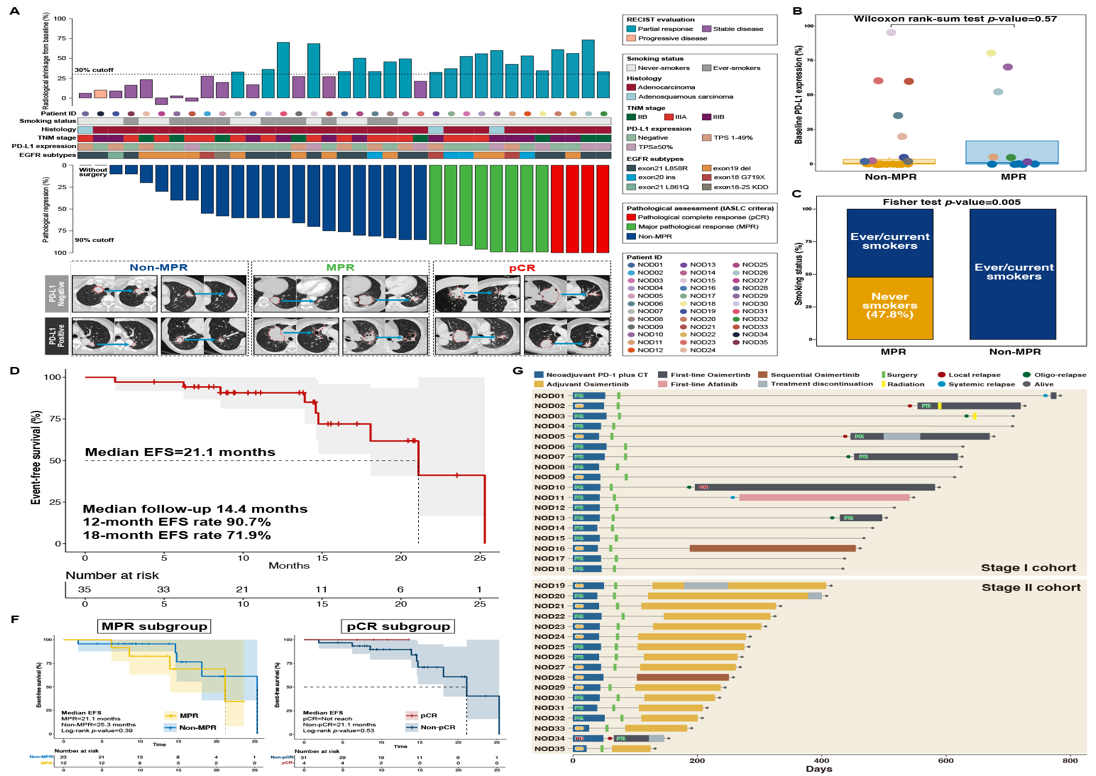
总体而言,新辅助信迪利单抗联合化疗可能是选定的EGFR突变NSCLC的一种可选治疗方式,且不会给辅助或随后的EGFR-TKIs治疗增加严重毒性。需要长期随访以进一步明确额外新辅助免疫化疗在EGFR突变NSCLC中的作用。
排版编辑:肿瘤资讯-G











 苏公网安备32059002004080号
苏公网安备32059002004080号


