早期非小细胞肺癌(NSCLC)的标准治疗模式是手术切除,对于无法耐受手术或不具备手术指征的患者,可通过立体定向体放射治疗(SBRT)进行治疗。然而,一些通过影像学检查无法排除的风险因素,可能导致患者的复发,通过非侵入性手段进行检测,识别这部分风险因素并进行干预,有望帮助患者得到更好的预后。近日,一项发表于International Journal of Radiation Oncology Biology Physics(IF=6.4)的研究[1],通过手术患者数据建立了放射组学模型,并成功在 SBRT 队列中进行了验证,显示出对患者复发风险的预测效能。【肿瘤资讯】特邀湖州市中心医院沈琦斌教授进行点评。
研究背景
隐匿性淋巴结转移(Occult Lymph Node Metastasis,OLNM),是术前检查中未被检测到但在术后病理分析中得到确认的淋巴结转移,在临床早期NSCLC患者中发生率超过20%,很可能是疾病复发和肿瘤转移的危险因素[2]。SBRT是早期不可切除NSCLC患者的标准治疗方法,在可手术的NSCLC患者中也是重要的替代疗法。在SBRT的实施过程中,通常只照射了在预处理影像中识别出的原发肿瘤病灶,而没有特意覆盖肺门或纵隔淋巴结,这可能导致局部治疗失败,影响患者的治疗结局。因此,SBRT治疗早期NSCLC患者,需要准确预测OLNM,从而对患者进行有效管理。
此前,已有研究使用CT、PET-CT等影像学手段结合临床病理特征预测NSCLC患者的OLNM,然而,却未能得到突破性结果,这可能是由于单一影像学检测技术的限制[3-5]。放射影像组学是快速发展的研究领域,它可以量化医学图像的特征,例如组织的异质性和病变的形状,可以进一步反映分析某一特定区域的潜在病理、生理特征。在预测手术治疗的NSCLC患者的OLNM方面,有报道指出放射组学模型的有效性优于传统方法。而在SBRT治疗的早期NSCLC患者中,同样也有放射组学在区域复发(RR)方面的探索[6,7],然而,并未进一步收集、随访患者的淋巴结状态和长期的RR状态,这可能影响到模型的预测性能。因此,研究者尝试开发基于CT的放射组学模型,用于预测接受根治性手术并进行了详细病理检查的临床分期I期NSCLC患者中的OLNM,并使用该模型对SBRT治疗的早期NSCLC患者的RR和预后进行预测。
研究方法
研究者收集了一家中心2013年1月至2018年12月(训练队列)和2019年1月至2020年12月(验证队列)期间接受根治性手术和淋巴结清扫的的临床分期I期(AJCC8th)NSCLC患者,以及两家中心分别在2016年1月至2021年12月和2008年2月至2020年2月期间使用PET-CT确认为临床分期I期并接受SBRT治疗的NSCLC患者的数据。CT影像组学模型则可以基于可非侵入性收集的四项术前临床特征(性别、年龄、肿瘤大小和肿瘤位置)开发,并在验证队列中进行验证。
研究结果
本次研究中设计的放射组学模型中选择了四个原始形状特征和四个LoG特征,F1-F4是在原始CT图像上计算的图像特征。其中,F1表示肿瘤表面网格顶点在冠状面上的最大成对欧几里得距离,F2表示灰度共生矩阵(GLCM)的偏度和均匀性,提供关于均值的不对称性的信息,F3使用GLCM测量原始CT图像中的均匀模式,并反映强度值对彼此邻近的频率,F4使用原始CT图像上的灰度大小区矩阵(GLSZM)表示区域大小体积的方差。F5-F8是在LoG图像上提取的特征,这些图像是使用LoG滤波器过滤的原始CT图像。其中,F5-F7指的是使用配置为1.0的sigma的LoG滤波器计算的特征。F5使用灰度运行长度矩阵捕捉较短运行长度与较高灰度值的联合分布,F6使用GLSZM测量图像中灰度强度值的变异性,较低的值表示更大的相似性,F7使用灰度依赖性矩阵描述小依赖性与较高灰度值的联合分布,F8表示图像区域内体素强度分布的第10百分位数,并使用配置为3.0的sigma的LoG滤波器计算。这表明纹理特征在预测OLNM中起着至关重要的作用。
下图1为训练和验证队列中CT放射组学模型、临床特征模型和放射组学-临床特征融合模型的ROC曲线。在训练(P = 0.176)和验证队列(P = 0.099)中,放射组学-临床特征融合模型与放射组学模型之间没有观察到显著差异。然而,放射组学模型和融合模型的执行显著优于临床特征模型(两者P < 0.002)。模型在训练和验证队列中的准确性、敏感性、特异性、阳性预测值和阴性预测值等定量预测指标也显示出与ROC曲线相同的趋势。
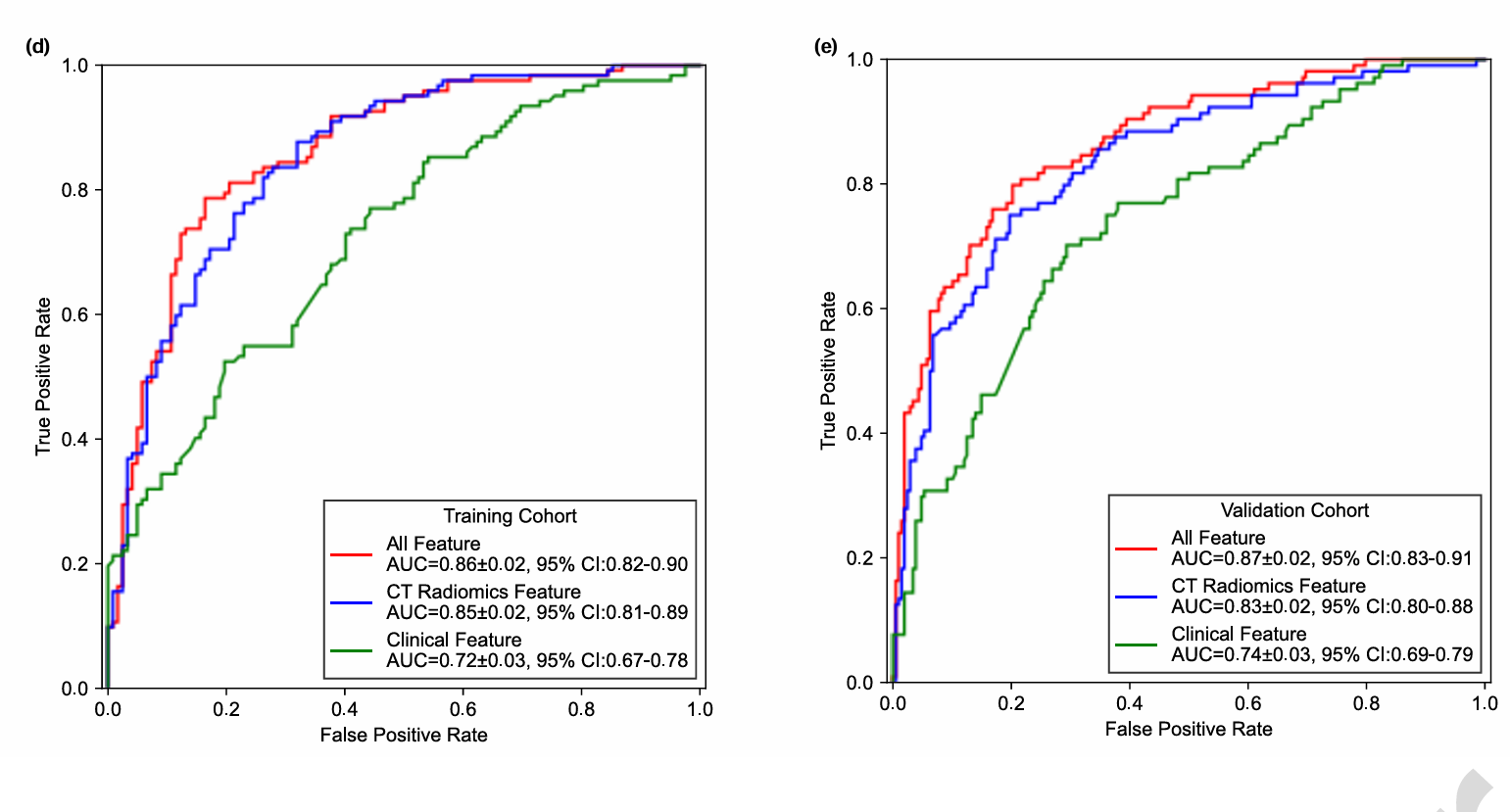 图1 训练和验证队列中CT放射组学模型、临床特征模型和放射组学-临床特征融合模型的ROC曲线
图1 训练和验证队列中CT放射组学模型、临床特征模型和放射组学-临床特征融合模型的ROC曲线
考虑到在训练和验证队列中融合模型与放射组学模型之间没有观察到显著差异,研究者进一步研究了放射组学模型的预后价值。下图2为训练和验证队列中放射组学模型预测分数的DFS K-M生存曲线。K-M生存分析表明,预测分数的分层效果在训练(P = 0.005)和验证(P < 0.001)队列中对估计DFS具有显著性(所有P < 0.01,对数秩检验)。
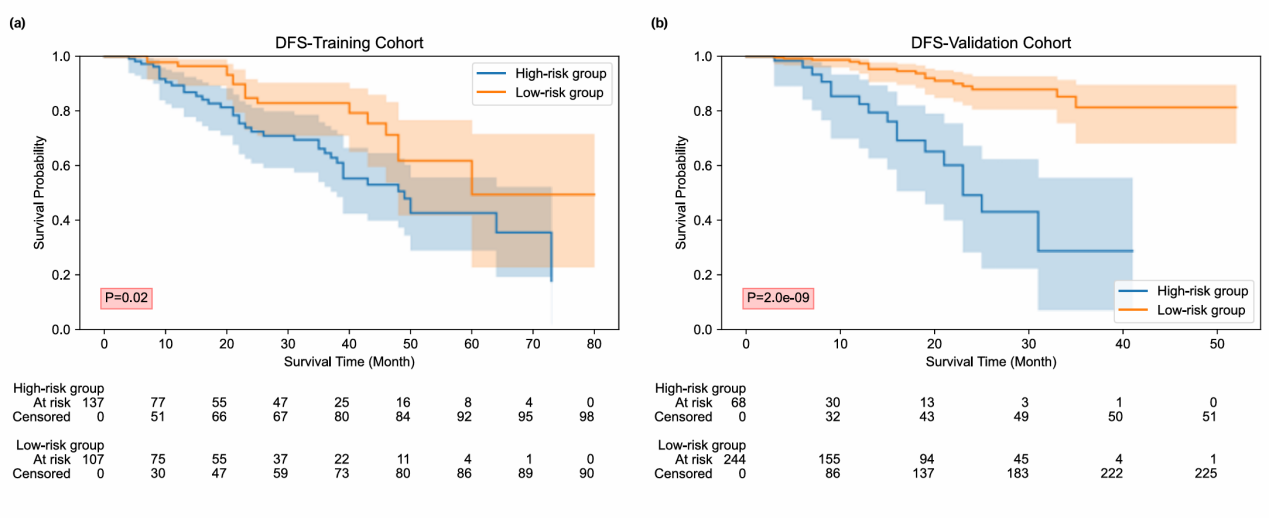 图2 训练和验证队列中放射组学模型预测分数的DFS K-M生存曲线
图2 训练和验证队列中放射组学模型预测分数的DFS K-M生存曲线
在接受SBRT的I期NSCLC患者队列中,中位随访时间为40.0个月(95% CI 35.2–44.8),分别有15、32、55、74和33名患者期间发生局部复发、RR、远处转移、任何部位的进展性疾病和死亡。值得注意的是,32名发展为RR的患者中有7名同时伴有局部复发。1年、2年和3年的RR(有或没有同时局部复发)的累积发生率分别为6.6%、9.9%和12.2%。根据放射组学模型的预测分数,将患者分为低风险组和高风险组,以中位数分数作为截断值。在评估患者生存的低风险组和高风险组中观察到了显著差异(所有P < 0.05,对数秩检验)。如下图3所示。
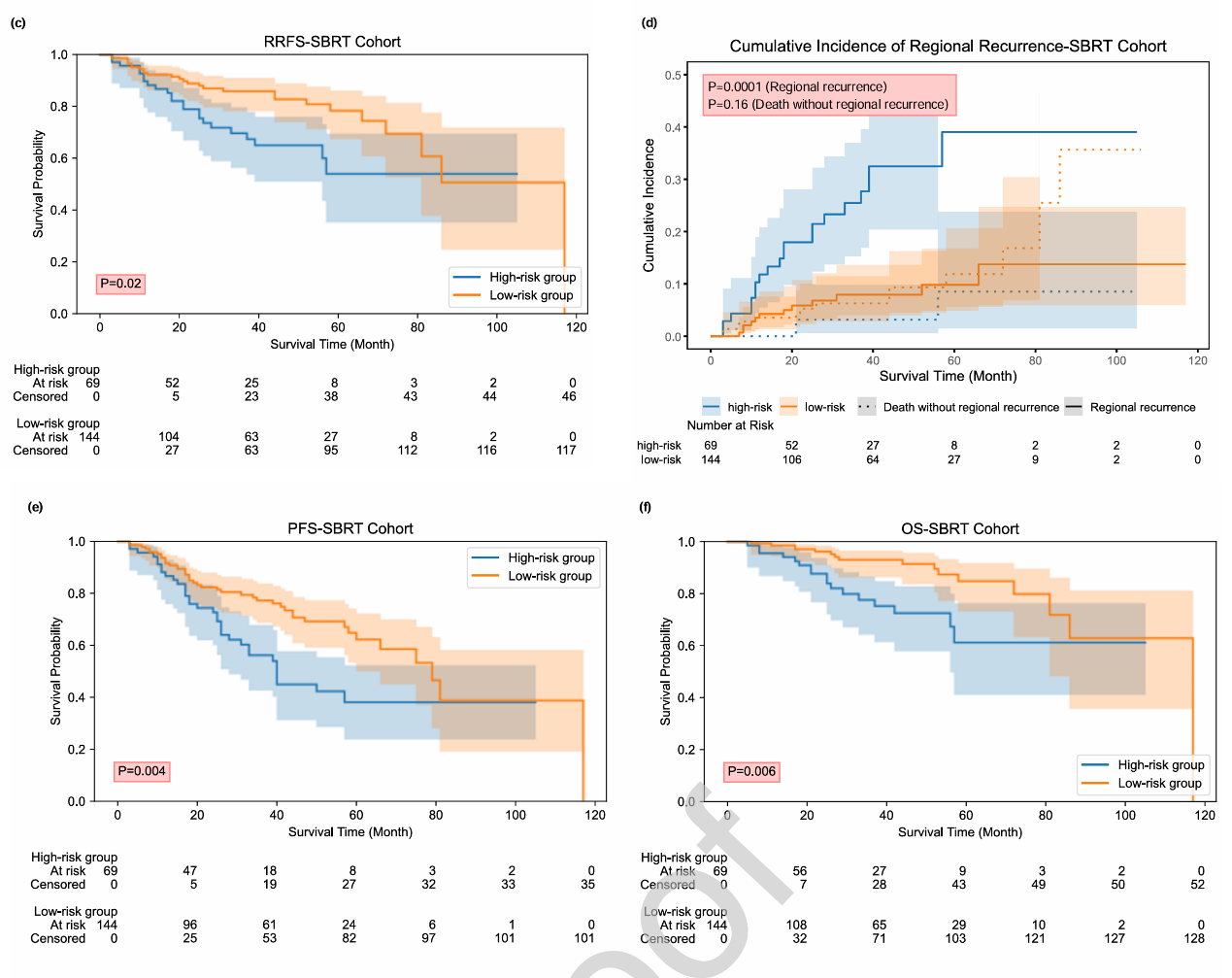 图3 SBRT队列中RRFS、RR的累积发生率、PFS和OS的K-M生存曲线
图3 SBRT队列中RRFS、RR的累积发生率、PFS和OS的K-M生存曲线
Cox比例风险回归分析表明,放射组学模型不仅在预测训练和验证队列中的DFS方面具有重要的预后价值,而且在评估SBRT队列中RR的累积发生率和患者生存方面也具有重要的预后价值。此外,基于放射组学模型的风险分层分数仍然是与RRFS、RR的累积发生率、PFS和OS相关的独立预后因素。
研究结论
本次使用手术数据构建的放射组学模型在预测OLNM方面显示有效,而且具备在预测接受SBRT的临床分期I期NSCLC患者的RR方面的能力。未来,可以尝试将此放射组学模型思路拓展到其他实体瘤中,基于金标准手术数据开发放预测隐匿性转移的模型。
[1] Ni J, et al. Predicting Regional Recurrence and Prognosis in Stereotactic Body Radiation Therapy-Treated Clinical Stage I Non-small Cell Lung Cancer Using a Radiomics Model Constructed With Surgical Data. Int J Radiat Oncol Biol Phys. 2024 Jun 25:S0360-3016(24)00743-0.
[2] Rusch V W, Hawes D, Decker P A, et al. Occult metastases in lymph nodes predict survival in resectable non–small-cell lung cancer: report of the ACOSOG Z0040 trial[J]. Journal of clinical oncology, 2011, 29(32): 4313-4319.
[3] Li L, Ren S, Zhang Y, et al. Risk factors for predicting the occult nodal metastasis in T1–2N0M0 NSCLC patients staged by PET/CT: potential value in the clinic[J]. Lung Cancer, 2013, 81(2): 213-217.
[4] Mattes M D, Weber W A, Foster A, et al. A predictive model for lymph node involvement with malignancy on PET/CT in non–small-cell lung cancer[J]. Journal of Thoracic Oncology, 2015, 10(8): 1207-1212.
[5] Ouyang M, Tang K, Xu M, et al. Prediction of occult lymph node metastasis using tumor-to-blood standardized uptake ratio and metabolic parameters in clinical N0 lung adenocarcinoma[J]. Clinical Nuclear Medicine, 2018, 43(10): 715-720.
[6] Huynh E, Coroller T P, Narayan V, et al. CT-based radiomic analysis of stereotactic body radiation therapy patients with lung cancer[J]. Radiotherapy and Oncology, 2016, 120(2): 258-266.
[7] Li H, Galperin-Aizenberg M, Pryma D, et al. Unsupervised machine learning of radiomic features for predicting treatment response and overall survival of early stage non-small cell lung cancer patients treated with stereotactic body radiation therapy[J]. Radiotherapy and Oncology, 2018, 129(2): 218-226.
[8] Dissaux G, Visvikis D, Da-Ano R, et al. Pretreatment 18F-FDG PET/CT radiomics predict local recurrence in patients treated with stereotactic body radiotherapy for early-stage non–small cell lung cancer: a multicentric study[J]. Journal of Nuclear Medicine, 2020, 61(6): 814-820.
[9] Thor M, Fitzgerald K, Apte A, et al. Exploring published and novel pre-treatment CT and PET radiomics to stratify risk of progression among early-stage non-small cell lung cancer patients treated with stereotactic radiation[J]. Radiotherapy and Oncology, 2024, 190: 109983.
本材料由阿斯利康提供支持,仅供医疗卫生专业人士参考,不可用于推广目的。
审批编号:CN-141278
过期日期:2024-11-11
排版编辑:肿瘤资讯-邓文普











 苏公网安备32059002004080号
苏公网安备32059002004080号


