作者信息
刘巍峰
北京积水潭医院骨肿瘤科 科主任、党支部书记
主任医师,教授,博士生导师
国家重点研发计划 首席科学家
中华医学会骨科学分会青委会骨肿瘤学组 副组长
中国医药教育协会骨与软组织肿瘤青委会 副主任委员
中国初级保健基金会骨与软组织肿瘤专委会 副主任委员
CACA肉瘤专业委员会智能骨科与精准诊疗学组 组长
CACA骨肿瘤与骨转移癌专委会数字骨肿瘤学组 副组长
CACA肉瘤专业委员会基础研究及转化学组副组长
CACA骨肿瘤与骨转移癌专委会青年学组 副组长CSCO黑色素瘤专家委员会常务委员&青委会 副主委
CSCO肉瘤专家委员会 委员
国家卫健委 儿童恶性实体瘤外科专家委员会委员
国家癌症中心 国家肿瘤质控中心专家委员会委员
主要研究方向:骨与软组织肿瘤的外科与药物治疗
参与国家重点研发计划重点专项1项
概述
韧带样纤维瘤病(硬纤维瘤)是一种罕见的局部侵袭性肿瘤,无转移能力,但具有浸润性生长及局部复发的倾向,可严重影响患者功能,造成沉重的临床负担甚至死亡。近20年来,该病的治疗理念发生了巨变,从传统的积极手术转变为以主动监测为一线治疗的保守策略,治疗手段也更加丰富,呈现多学科管理的发展趋势。相关研究指出硬纤维瘤的发病与Wnt及Notch信号通路失调有关,以Nirogacestat为代表的多款针对该发病机制的新型药物正在研发之中,有望成为该病未来治疗的新方向。本文旨在介绍硬纤维瘤的分子发病机制、治疗进展及治疗策略,以期为广大肿瘤医务工作者对该病的治疗及研究提供思路。
硬纤维瘤(demoid tumor,DT),也称为侵袭性纤维瘤病、韧带样纤维瘤、深部肌腱膜纤维瘤病,是一种罕见的局部侵袭性肿瘤,2020年世界卫生组织(WHO)将其定义为发生在软组织深部的单克隆性成纤维细胞增殖,具有浸润性生长和局部复发的倾向,但不会转移。DT发病率较低,为每年每百万人5~6例,约占所有肿瘤的0.03%及所有软组织肿瘤的3%,发病高峰为30~40岁,男女比例约为1:2[1]。该病可发生于身体的任何部位,如:腹外(头颈部、胸部、四肢)、腹壁或腹内[2]。虽无转移或去分化的可能,但因其具有浸润性生长及复发的倾向,所以仍可能造成疼痛、畸形,甚至是危及生命的器官损伤[2]。
磁共振成像(MRI)是硬纤维瘤的首选影像学检查,可显示肿瘤向肌肉的浸润,还可反映肿瘤成分(胶原纤维、梭形细胞、细胞外基质)的比例。硬纤维瘤的MRI特征多变,T1加权像多为低信号或与肌肉等信号;T2加权像主要为高信号,低信号为紧密聚集的胶原束。DT进展时在T2加权像上呈高信号,对应高细胞性,且可通过静脉注射钆增强,可用于判断疾病状态[3]。CT扫描可显示DT的软组织肿块,但难以区分肿瘤浸润,主要用于腹腔内DT及相关并发症(如小肠梗阻)的诊断和随访,超声则主要用于四肢、胸部或腹壁肿瘤(孕妇)的初步评估和引导活检[3]。
硬纤维瘤肉眼下切缘为棕白色的硬块,边缘不清,组织学特征为单克隆性成纤维细胞增殖,表现为大量纤维间质中的梭形细胞小束[4]。其免疫组织化学染色的特点是核β-连环蛋白(β-catenin)、平滑肌肌动蛋白、波形蛋白、环氧合酶-2(cyclooxygenase-2,COX-2)、雌激素受体β阳性,desmin、S100、CD34和KIT阴性[3]。
根据病因硬纤维瘤可分为散发性和家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)相关性两种。散发性约占85%~90%,多因体细胞的β连环蛋白基因(CTNNB1)突变所致;而FAP相关性(10%~15%)主要发生在腺瘤性息肉病大肠基因(adenomatous polyposis coli,APC)突变的患者中,主要人群为FAP患者,其发病风险约为一般人群的800~1000倍[2]。二者的发病部位有所区别,散发性DT常发生在腹外;而FAP相关性DT则常发生于肠系膜或腹壁,更具侵袭性,且肿瘤呈多发性、巨大性的概率也更高[5]。
1 分子发病机制
1.1 经典Wnt信号通路
Wnt蛋白家族涉及多种细胞功能,可调节细胞更新、分化、凋亡和存活之间的平衡,与DT的发病密切相关,其中β-连环蛋白失调起核心作用[6]。在未受Wnt配体激活时,细胞质中的β-连环蛋白分子被支架蛋白Axin、APC、糖原合成酶激酶3β(GSK3β)和酪蛋白激酶1(casein kinase,CK1)等形成的破坏复合物结合并加工,依次被CK1α和GSK3β磷酸化,后与E3泛素连接酶(β-TrCP)发生相互作用,被靶向降解,以维持在细胞质中的低水平浓度,并阻止其发生核易位(图1)。当β-连环蛋白缺乏时,细胞核中的T细胞因子/淋巴细胞增强因子(TCF/LEF)家族转录因子与Groucho蛋白相互作用,抑制与细胞生长有关靶基因的转录。而当Wnt配体存在时,胞外Wnt在细胞膜上与卷曲蛋白(frizzleds,Fzd)和LRP5/6(低密度脂蛋白受体相关蛋白5/6)结合,诱导LRP5/6磷酸化。此后,Fzd受体适配蛋白(disheveled,Dvl)和Axin会被募集到细胞膜上,破坏复合物随之失活,导致β-连环蛋白蓄积并发生核易位,经转导β样蛋白1(transducin β-like protein 1,TBL1)和TBL受体1(TBLR1)的作用,取代Groucho蛋白与TCF/LEF结合,从而激活与细胞生长有关的靶基因转录[6]。同理,APC蛋白的突变同样会导致破坏复合物失活,使β-连环蛋白蓄积并发生核移位,激活相关靶基因的转录[6]。
虽均涉及Wnt信号通路失调,但散发性DT和FAP相关性DT失调的主要原因却并不一致。约85%~90%的散发性DT病例在CTNNB1的3个外显子T41A(55%),S45F(35%),S45P(10%)的n端区域突变,影响了β-连环蛋白与APC蛋白的相互作用,最终导致β-连环蛋白蓄积和核移位[7]。S45F突变常提示较差的临床结局和较高的复发风险,与携带T41A突变的DT(57%)或未发生突变的DT(65%)相比,S45F突变DT的5年无复发生存率明显更低(23%)[8]。而FAP相关性DT,大多是由于APC基因的种系突变和散发性突变导致APC蛋白的过早截短及β-连环蛋白调节结构域丢失,使其发生蓄积和核易位,过度激活转录因子[8]。Wnt通路的失调将过度表达众多参与增殖、纤维化及血管生成的基因,如解整合素金属蛋白酶(a disintegrin and metalloprotease,ADAM)12、COX-2等[9]。虽然硬纤维瘤更具体的发病机制、治疗靶点、生物标志物仍不明确,但越来越多的证据表明DT的发生几乎均涉及Wnt信号通路,为该病的发病机制及治疗研究提供了新的方向。
1.2 Notch通路
Notch信号通路是另一个调节胚胎发育及人体稳态的基本途径,包括4个受体(Notch1~4)和至少5个配体(jagged-1/2和delta-like ligand1/3/4),配体结合后,Notch受体发生两次蛋白水解裂解(图2):第一次在胞外区域通过ADAM10/17水解,第二次通过γ-分泌酶在胞内区域水解[10]。酶切过程会释放Notch胞内结构域(NICD),并转移到细胞核内,与相关转录因子形成NICD转录复合体,激活包括转录因子HES、HES相关蛋白及其他靶基因[11]。
2 局部治疗
2.1 主动监测
近20年来,DT的治疗理念已从传统的积极手术转变为以主动监测为一线治疗的保守策略。英国的一项研究表明最初接受主动监测的患者比例已从1998年的10%增加到2016年的40%[12]。2018年Gounder等在索拉非尼的Ⅲ期安慰剂病例对照试验中发现安慰剂组的客观缓解率(objective response rate,ORR)为20%,证明了DT具有自行消退的可能[13]。
与其他治疗相比,主动监测在避免无意义手术的同时可更好地预测疾病的发生,利于进一步治疗策略的制定。另一方面,DT发展缓慢,患者生存期长,更应评估治疗的真正获益,保障患者生活质量。硬纤维瘤协作组(DTWG)及美国国立综合癌症网络(NCCN)建议:对于潜在可切除但没有症状、不危及生命且没有引起重大功能损害的硬纤维瘤,可选择主动监测作为初始治疗;对于不可切除或手术可能导致严重并发症的肿瘤也可选择主动监测[14]。
主动监测建议行MRI或CT检查,频率为每月1次(2个月内),每3个月1次(1年内),每6个月1次(1年后),每年1次(5年后)。但对于肿瘤位于危及生命的部位、发展迅速、有严重疼痛及明显临床症状的患者,可直接进行其他治疗[15]。
2.2 手术
同大多数软组织肿瘤一样,手术曾被认为是治疗DT的金标准,但近年来因术后复发率高、手术相关并发症多等问题,手术已不再是DT的首选治疗方法。Penel等纳入771例DT患者的大型前瞻性研究显示,手术组与主动监测组之间的无事件生存率(event-free survival,EFS)分别为53%和58%(P>0.01),其中在不利位置(胸壁、头颈部和上肢)患者中主动监测的2年EFS(52%)优于手术治疗(25%)[16]。
对于需要截肢的DT手术更应谨慎,仅在DT快速进展且不可局部切除,反复发生,其余手段无法控制或其他治疗副作用严重损害功能时考虑[15]。但手术仍是不可忽视的治疗手段,DTWG建议在DT进展到需要药物或放射治疗时,应根据肿瘤的位置及患者的年龄考虑手术可能性,但手术应放在其他有效的治疗手段之后,且需尽量保持功能;对于与FAP无关的位于肠系膜或腹膜后肿瘤病例,可根据其发病的严重程度,初始即采用手术治疗[14, 15]。
DT手术切缘是否要求显微镜下阴性切除仍具有争议。一项纳入426例硬纤维瘤患者的大型病例对照研究显示,显微镜下阴性切除(R0)组(110人)与微镜下切缘阳性(R1)组(107人)相比,2年无进展生存率(progression-free survival,PFS,76.5%vs73.7%)和5年PFS(62.5%vs60.5%)无显著差异,而37例肉眼下切缘阳性(R2)患者的2年和5年PFS(43.4%和22.0%)则显著低于R0及R1组[17]。而另一项纳入16项回顾性报告,共1295例腹外或腹壁DT患者的meta分析则显示,在仅接受手术切除治疗的患者中,R1切除的局部复发风险几乎高出R0两倍(risk ratio,RR,1.78,95%CI:1.40~2.26)[18]。
值得注意的是,大部分研究并未阐明肿瘤清除的范围(即肿瘤与切缘的距离),且肿瘤的生物学行为以及回顾性研究存在偏倚,所以切缘状态与DT复发率的关系仍存在争议。由于DT呈特殊的浸润性生长,获得阴性切缘通常需要大面积切除,常伴有潜在的功能和外观改变,鉴于DT的性质,当R0切除会严重损害患者功能时,可行R1切除联合新辅助放疗或全身治疗等方法代替,而R2切除则是不可接受的[15]。
2.3 放射治疗
放射治疗通常用于治疗不可切除或复发性DT,具有良好的局部控制效果。一项纳入209名接受单独放疗或联合放疗的DT患者的回顾性研究显示,放疗的5年和10年的局部控制率(LC)分别为71%和69%(中位随访时间98个月),局部复发率28%(中位随访时间23个月)[19]。该研究在解剖部位、肿瘤大小、年龄、治疗年代(2005年前或后)、治疗方法(单纯放疗vs联合放疗)的多变量分析中发现年龄≤30岁(Hazard Ratio,HR,2.94,95%CI:1.38~6.27,P<0.01)和肿瘤>10cm(HR,2.51, 95%CI:1.09~5.78,P<0.05)与较差LC的相关[19]。
硬纤维瘤对于放疗具有一定的敏感性,对于复发风险较低的患者人群(年龄>30岁;肿瘤范围<10cm)可考虑单纯放疗或联合放疗[19]。单纯放疗推荐剂量为50~56Gy,每次1.8~2Gy,持续5~7周。更高剂量的放疗似乎并不能降低局部复发率,在青年患者中不推荐[19]。
对于切缘阳性的四肢DT,尤其是R1/R2切除的复发性DT,辅助放疗似乎可降低术后局部复发的风险[18]。Crago等报道,四肢肿瘤患者行辅助放疗可降低15%无复发生存率(辅助放疗71%vs无辅助放疗56%,P<0.05)[20]。
新辅助放疗理论上可减小腹外DT,降低切除难度,但相关研究病例数较少,且应用的经验不足,仍需进行更大型的前瞻性随机试验证实其有效性,此外,为避免辐射暴露,似乎辅助全身治疗是更为合适的方案。
2.4 其他局部治疗
对于其他治疗手段不理想的晚期远端及多发性DT患者,可考虑孤立肢体灌注肿瘤坏死因子α和马法兰作为有效局部控制替代治疗[21]。
高强度聚焦超声(HIFU)是一种微创超声技术,可将超声光束精确地聚焦在目标上,产生热凝固坏死,一项针对111例DT患者的病例研究显示,HIFU治疗3个月的肿瘤体积缩小率为36%,未发生严重不良事件[22]。
3. 全身治疗
硬纤维瘤术后复发率较高,并发症较多,为避免传统治疗手段的缺点,全身治疗地位有所提高,被认为是有效的替代方法,尤其是对于腹腔内DT及局部治疗失败的患者。全身治疗主要包括非甾体抗炎药(NSAIDs)、抗激素治疗、化疗、酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)等。
3.1 NSAIDs
β-连环蛋白的蓄积和核易位可增强靶基因的转录,其中PTGS2是编码COX-2的基因,在部分DT患者中可出现COX-2过表达,导致血小板衍生生长因子水平上升,刺激血管生成,促进肿瘤细胞抗凋亡[2]。非甾体类抗炎药似乎可通过阻断COX2或前列腺素介导的β-连环蛋白通路治疗硬纤维瘤,并改善患者的疼痛,常使用的药物有舒林酸、吲哚美辛、美洛昔康和塞来昔布[15]。一项病例系列研究显示,14例接受舒林酸治疗(中位剂量300mg/d)的患者中,12例有临床获益(定义为客观缓解或疾病稳定)[23]。然而,唯一的前瞻性Ⅱ期临床研究显示NSAIDs联合内分泌治疗效果有限,且硬纤维瘤可自行消退,尚不清楚NSAIDs的抗肿瘤的真正获益,在NCCN指南(2022版)中,舒林酸及其他NSAIDs药物已不作为首选推荐,目前仅用于症状较轻的患者,或单纯疼痛控制[2, 14]。
3.2 抗激素治疗
DT的发生与激素有一定相关性:散发性DT中女性的发病率较高;DT的生长速度与内源性雌激素水平有直接关系;FAP相关性DT的雌激素受体为阳性[24]。最常使用的药物是他莫昔芬和托瑞米芬,可单独使用或与抗炎药物联合使用,其他药物包括雷洛昔芬、甲地孕酮、黄体酮等。然而目前还没有将单独抗激素治疗与主动监测对照的前瞻性研究,尚不清楚该治疗的真正获益,最新的治疗指南已不推荐将其作为一线治疗。
3.3 化疗
化疗主要适用于:其他治疗无效,进展迅速的DT;肠系膜DT损害了胃肠道功能,有穿孔风险或存在口服药物吸收不良;DT不可切除,进展迅速,威胁患者生命或重要功能。
化疗方案通常包括以蒽环类药物为基础的常规剂量方案和使用甲氨蝶呤联合长春碱类药物的低剂量方案[14]。
以蒽环类药物为基础的常规剂量方案可单独或联合使用阿霉素,或是聚乙二醇脂质体阿霉素(常与达卡巴嗪联用)。该方案与肉瘤的方案类似,使用6~8个周期,无论采用何种组合,80%的病例可获得客观缓解或稳定,45%的患者可获得持续反应[25]。聚乙二醇化脂质体阿霉素具有显著的活性,比传统的阿霉素心脏毒性更小,推荐在年轻病人中使用。
大多数DT患者的预期寿命较长,蒽环类药物存在毒性累积,甲氨蝶呤联合长春碱类药物的低剂量化疗是有效的替代方案。Li等研究显示,71例患者接受长春瑞滨联合小剂量甲氨蝶呤的化疗,ORR为35.2%,2、3、5年PFS分别为79.9%、68.4%和36.3%[26]。该联合方案在FAP相关性DT及儿童DT患者中同样有效,且耐受性良好,具有长期临床获益[2]。
3.4 酪氨酸激酶抑制剂(TKI)
TKI对于DT的具体作用机制仍不清楚,但多项研究证明TKI具有抗DT作用[13, 27, 28]。使用的药物包括伊马替尼、尼洛替尼、索拉非尼、舒尼替尼、帕唑帕尼等。
Chugh等针对不可切除疾病患者(51名)的伊马替尼Ⅱ期试验(300mg每天2次)显示,1年PFS为66%,ORR为6%[27]。
索拉非尼是目前治疗DT疗效最为显著的TKI,在2022年的NCCN指南中被作为1类推荐。Gounder等在索拉非尼III期安慰剂对照随机试验显示,在中位27个月的随访中,索拉非尼(50例)和安慰剂组(37例)的ORR分别为33%和20%,索拉非尼组的2年PFS为81%,显著高于安慰剂组的36%[13],常见的不良反应为:皮疹、疲劳、高血压、疼痛和胃肠道症状[13]。
培唑帕尼是第一个获批软组织肉瘤适应证的靶向药,在2019年的Ⅱ期非盲试验(NCT01876082)中,,培唑帕尼组(48例,800mg/天)6个月PFS明显优于化疗组(24例,甲氨蝶呤联合长春新碱)(84%vs45%),其常见的不良事件主要有:疲劳、胃肠道症状、手足综合征等[28]。
TKI对于DT有明显的临床获益,相比于治疗周期有限的细胞毒性药物,TKI通常可持续使用,直到出现耐受或疾病进展。TKI的选择主要由患者对于药物的敏感性、不良反应、耐受度等综合考量,目前尚无随机对照研究证明最佳方案,总的来说索拉非尼、培唑帕尼或舒尼替尼治疗更为推荐使用[14]。
4. 在研药物
4.1 γ-分泌酶抑制剂
γ-分泌酶抑制剂可结合Notch信号通路中的γ-分泌酶,阻断Notch受体蛋白水解及NICD的核易位(图2)。一种选择性小分子γ-分泌酶抑制剂—Nirogacestat在单药治疗硬纤维瘤患者的I期和II期试验中均取得阳性结果[29, 30]。Nirogacestat随机双盲安慰剂对照Ⅲ期试验(DeFi,NCT03785964)纳入142名进展性硬纤维瘤患者,随机分至接受Nirogacestat或安慰剂组,剂量为150mg每天两次,28天为一个周期,直至疾病进展[31]。中位随访19个月时,与安慰剂组相比,Nirogacestat组改善了PFS(HR,0.29,95%CI:0.15~0.55,P<0.001)、ORR(41%vs8%)和完全缓解率(7%vs0%),Nirogacestat还改善了肿瘤相关负荷、疼痛、身体机能、社会角色功能和健康相关生命质量[31]。Nirogacestat的常见不良事件包括腹泻、恶心、疲劳、低磷血症和丘疹等,95%的治疗不良事件为1级或2级[31]。此外75%(27/36)育龄期女性发生了卵巢功能障碍,但74%在停药后消退[31]。鉴于Ⅲ期试验的阳性结果,Nirogacestat于2023年11月27日成功通过美国食品和药物管理局(FDA)的批准,成为首款用于需要系统治疗的DT成人患者的药物。
其他的γ-分泌酶抑制剂如AL101、AL102、crenigacestat等,同样在相关临床试验中表现出一定的抗DT活性。
4.2 β-连环蛋白抑制剂
β-连环蛋白在DT发生中起核心作用,其拮抗剂Tegavivint有可能成为治疗DT的新型药物。Tegavivint可直接和选择性地干扰TBL1与TBLR1之间的相互作用,抑制β-连环蛋白核易位并促进其降解(图1)[32]。一项纳入24名DT患者的TegavivintⅠ期试验(NCT03459469)显示,所有患者的9个月PFS为76%(95%CI:54%~90%),ORR为17%;Ⅱ期试验推荐剂量(WHO和RECIST标准)患者的9个月PFS为79%(95%CI:51%~93%),ORR为25%,耐受性良好,不良事件多为1/2级[33]。
4.3 其他在研药物
除Nirogacestat和Tegavivint外,包括AL102、安罗替尼、Vactosertib等的多种治疗硬纤维瘤的药物正处于临床试验阶段(表1)。其中AL102的II/III期试验对42名患有进展性DT的成人评估疗效。在开放标签的A试验中,患者被随机接受3种给药方案(1.2mg每天、2mg/每周两次、4mg每周两次);部分缓解率分别为50%、45.5%、23.1%,疾病控制率分别为100%、97%、91%;第28周时,相对于基线的中位体积变化分别为51.9%、15.2%、9.5%[34]。另一项试验正在评估Vactosertib(TGF-β/Smad抑制剂)与伊马替尼在联用治疗晚期DT的疗效,Ⅰ期试验早期数据显示ORR为28.5%[35]。
5. 治疗策略
在治疗之前,所有患者都应由具有硬纤维瘤专业知识和经验的多学科团队进行评估和治疗。近期DTWG和NCCN根据硬纤维瘤发病的部位制订了以主动监测为初始治疗的治疗策略(图3),在治疗完成后患者还应进行相应的康复训练和定期随访[14]。临床上治疗策略的具体制定还需要综合考虑肿瘤发展速度、侵袭性、患者的年龄、症状等。
6. 总结
近20年来,硬纤维瘤的治疗逐渐趋于保守,治疗手段也更加丰富,整体呈多学科管理的发展趋势。相关研究证明DT具有自行消退的可能性,更是颠覆了该病传统的诊疗理念,为主动监测作为初始治疗提供了理论依据。硬纤维瘤相关的分子发病机制研究指出DT的发生与Wnt及Notch信号通路失调有关,针对其发病机制所研发的多款药物表现出一定的抗DT活性,其中作用于Notch信号通路的γ-分泌酶抑制剂—Nirogacestat在Ⅲ期试验中表现良好,成为了首款通过FDA批准用于DT成人患者系统治疗的药物,有望成为该病未来的首选治疗。
值得注意的是,硬纤维瘤更具体的发病机制仍不明晰,仍缺乏相关生物标志物,其诊断及预后判断仍是难题,亟待进一步的分子生物学研究予以解决。此外,DT不同治疗的真实有效性及治疗策略的合理性,也需要更多的高质量前瞻性随机对照试验予以证明。
[1] Kasper B, Ströbel P, Hohenberger P. Desmoid tumors: clinical features and treatment options for advanced disease [J]. Oncologist, 2011, 16(5): 682-693.
[2] Napolitano A, Mazzocca A, Spalato Ceruso M, et al. Recent Advances in Desmoid Tumor Therapy [J]. Cancers (Basel), 2020, 12(8): 2135.
[3] Riedel R F, Agulnik M. Evolving strategies for management of desmoid tumor [J]. Cancer, 2022, 128(16): 3027-3040.
[4] Zreik R T, Fritchie K J. Morphologic Spectrum of Desmoid-Type Fibromatosis [J]. Am J Clin Pathol, 2016, 145(3): 332-340.
[5] Koskenvuo L, Ristimäki A, Lepistö A. Comparison of sporadic and FAP-associated desmoid-type fibromatoses [J]. J Surg Oncol, 2017, 116(6): 716-721.
[6] Nusse R, Clevers H. Wnt/β-Catenin Signaling, Disease, and Emerging Therapeutic Modalities [J]. Cell, 2017, 169(6): 985-999.
[7] Huss S, Nehles J, Binot E, et al. β-catenin (CTNNB1) mutations and clinicopathological features of mesenteric desmoid-type fibromatosis [J]. Histopathology, 2013, 62(2): 294-304.
[8] Lazar A J, Tuvin D, Hajibashi S, et al. Specific mutations in the beta-catenin gene (CTNNB1) correlate with local recurrence in sporadic desmoid tumors [J]. Am J Pathol, 2008, 173(5): 1518-1527.
[9] Timbergen M J M, Smits R, Grünhagen D J, et al. Activated Signaling Pathways and Targeted Therapies in Desmoid-Type Fibromatosis: A Literature Review [J]. Front Oncol, 2019, 9: 397.
[10] Yuan X, Wu H, Xu H, et al. Notch signaling: an emerging therapeutic target for cancer treatment [J]. Cancer Lett, 2015, 369(1): 20-27.
[11] Federman N. Molecular pathogenesis of desmoid tumor and the role of γ-secretase inhibition [J]. NPJ Precis Oncol, 2022, 6(1): 62.
[12] van Houdt W J, Husson O, Patel A, et al. Outcome of Primary Desmoid Tumors at All Anatomic Locations Initially Managed with Active Surveillance [J]. Ann Surg Oncol, 2019, 26(13): 4699-4706.
[13] Gounder M M, Mahoney M R, Van Tine B A, et al. Sorafenib for Advanced and Refractory Desmoid Tumors [J]. N Engl J Med, 2018, 379(25): 2417-2428.
[14] Desmoid Tumor Working Group. The management of desmoid tumours: A joint global consensus-based guideline approach for adult and paediatric patients [J]. Eur J Cancer, 2020, 127: 96-107.
[15] Garcia-Ortega D Y, Martín-Tellez K S, Cuellar-Hubbe M, et al. Desmoid-Type Fibromatosis [J]. Cancers (Basel), 2020, 12(7): 1851.
[16] Penel N, Le Cesne A, Bonvalot S, et al. Surgical versus non-surgical approach in primary desmoid-type fibromatosis patients: A nationwide prospective cohort from the French Sarcoma Group [J]. Eur J Cancer, 2017, 83: 125-131.
[17] Salas S, Dufresne A, Bui B, et al. Prognostic factors influencing progression-free survival determined from a series of sporadic desmoid tumors: a wait-and-see policy according to tumor presentation [J]. J Clin Oncol, 2011, 29(26): 3553-3558.
[18] Janssen M L, van Broekhoven D L, Cates J M, et al. Meta-analysis of the influence of surgical margin and adjuvant radiotherapy on local recurrence after resection of sporadic desmoid-type fibromatosis [J]. Br J Surg, 2017, 104(4): 347-357.
[19] Bishop A J, Zarzour M A, Ratan R, et al. Long-Term Outcomes for Patients With Desmoid Fibromatosis Treated With Radiation Therapy: A 10-Year Update and Re-evaluation of the Role of Radiation Therapy for Younger Patients [J]. Int J Radiat Oncol Biol Phys, 2019, 103(5): 1167-1174.
[20] Crago A M, Denton B, Salas S, et al. A prognostic nomogram for prediction of recurrence in desmoid fibromatosis [J]. Ann Surg, 2013, 258(2): 347-353.
[21] Bonvalot S, Rimareix F, Causeret S, et al. Hyperthermic isolated limb perfusion in locally advanced soft tissue sarcoma and progressive desmoid-type fibromatosis with TNF 1 mg and melphalan (T1-M HILP) is safe and efficient [J]. Ann Surg Oncol, 2009, 16(12): 3350-3357.
[22] Zhang R, Chen J Y, Zhang L, et al. The safety and ablation efficacy of ultrasound-guided high-intensity focused ultrasound ablation for desmoid tumors [J]. Int J Hyperthermia, 2021, 38(2): 89-95.
[23] Tsukada K, Church J M, Jagelman D G, et al. Noncytotoxic drug therapy for intra-abdominal desmoid tumor in patients with familial adenomatous polyposis [J]. Dis Colon Rectum, 1992, 35(1): 29-33.
[24] Reitamo J J, Scheinin T M, Häyry P. The desmoid syndrome. New aspects in the cause, pathogenesis and treatment of the desmoid tumor [J]. Am J Surg, 1986, 151(2): 230-237.
[25] Gega M, Yanagi H, Yoshikawa R, et al. Successful chemotherapeutic modality of doxorubicin plus dacarbazine for the treatment of desmoid tumors in association with familial adenomatous polyposis [J]. J Clin Oncol, 2006, 24(1): 102-105.
[26] Li S, Fan Z, Fang Z, et al. Efficacy of vinorelbine combined with low-dose methotrexate for treatment of inoperable desmoid tumor and prognostic factor analysis [J]. Chin J Cancer Res, 2017, 29(5): 455-462.
[27] Chugh R, Wathen J K, Patel S R, et al. Efficacy of imatinib in aggressive fibromatosis: Results of a phase II multicenter Sarcoma Alliance for Research through Collaboration (SARC) trial [J]. Clin Cancer Res, 2010, 16(19): 4884-4891.
[28] Toulmonde M, Pulido M, Ray-Coquard I, et al. Pazopanib or methotrexate-vinblastine combination chemotherapy in adult patients with progressive desmoid tumours (DESMOPAZ): a non-comparative, randomised, open-label, multicentre, phase 2 study [J]. Lancet Oncol, 2019, 20(9): 1263-1272.
[29] Kummar S, O'Sullivan Coyne G, Do K T, et al. Clinical Activity of the γ-Secretase Inhibitor PF-03084014 in Adults With Desmoid Tumors (Aggressive Fibromatosis) [J]. J Clin Oncol, 2017, 35(14): 1561-1569.
[30] Villalobos V M, Hall F, Jimeno A, et al. Long-Term Follow-Up of Desmoid Fibromatosis Treated with PF-03084014, an Oral Gamma Secretase Inhibitor [J]. Ann Surg Oncol, 2018, 25(3): 768-775.
[31] Gounder M, Ratan R, Alcindor T, et al. Nirogacestat, a γ-Secretase Inhibitor for Desmoid Tumors [J]. N Engl J Med, 2023, 388(10): 898-912.
[32] Fiskus W, Sharma S, Saha S, et al. Pre-clinical efficacy of combined therapy with novel β-catenin antagonist BC2059 and histone deacetylase inhibitor against AML cells [J]. Leukemia, 2015, 29(6): 1267-1278.
[33] Cranmer L D, Razak A R A, Ratan R, et al. Results of a phase I dose escalation and expansion study of tegavivint (BC2059), a first-in-class TBL1 inhibitor for patients with progressive, unresectable desmoid tumor [J]. Journal of Clinical Oncology, 2022, 40(16_suppl): 11523.
[34] Gounder M M, Jones R L, Chugh R, et al. RINGSIDE phase 2/3 trial of AL102 for treatment of desmoid tumors (DT): Phase 2 results [J]. Journal of Clinical Oncology, 2023, 41(16_suppl): 11515.
[35] Kim H S, Ahn J-H, Kim J E, et al. A phase I study of TGF-β inhibitor, vactosertib in combination with imatinib in patients with advanced desmoid tumor (aggressive fibromatosis) [J]. Journal of Clinical Oncology, 2020, 38: 11557.
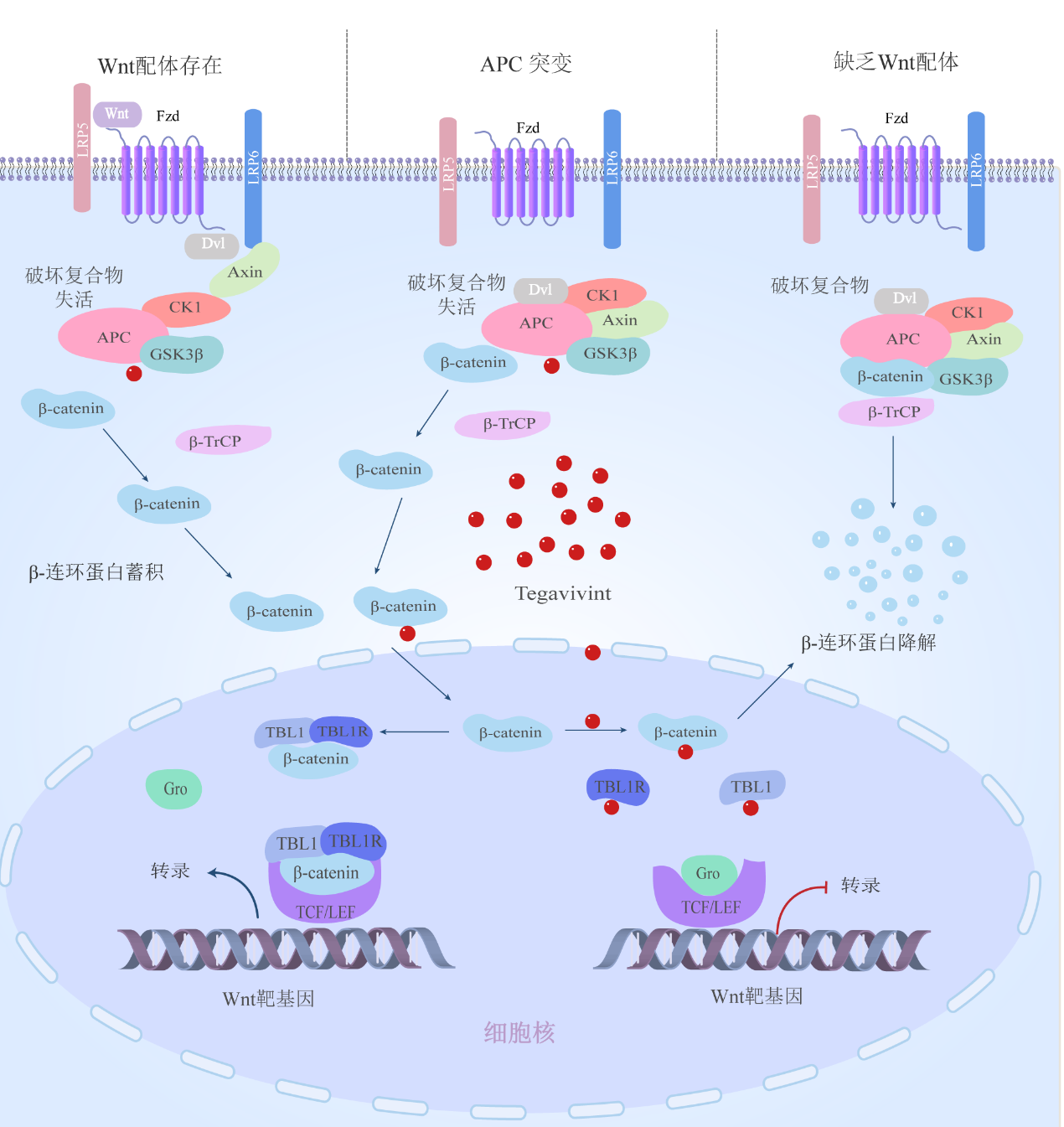 图1 Wnt信号通路及Tegavivint作用原理
图1 Wnt信号通路及Tegavivint作用原理
Tegavivint可直接和选择性地干扰TBL1与TBLR1之间的相互作用,抑制β-连环蛋白核易位,并促进其降解。
LRP5/6:低密度脂蛋白受体相关蛋白5/6;Fzd:卷曲蛋白; Dvl:Fzd受体适配蛋白; CK1:酪蛋白激酶1; Axin:支架蛋白; GSK3β糖原合成酶激酶3β;β-TrCP:E3泛素连接酶; APC:APC蛋白; Gro:Groucho蛋白; TBL1/TBLR1:转导β样蛋白1及其受体; TCF/LEF:T细胞因子/淋巴细胞增强因子
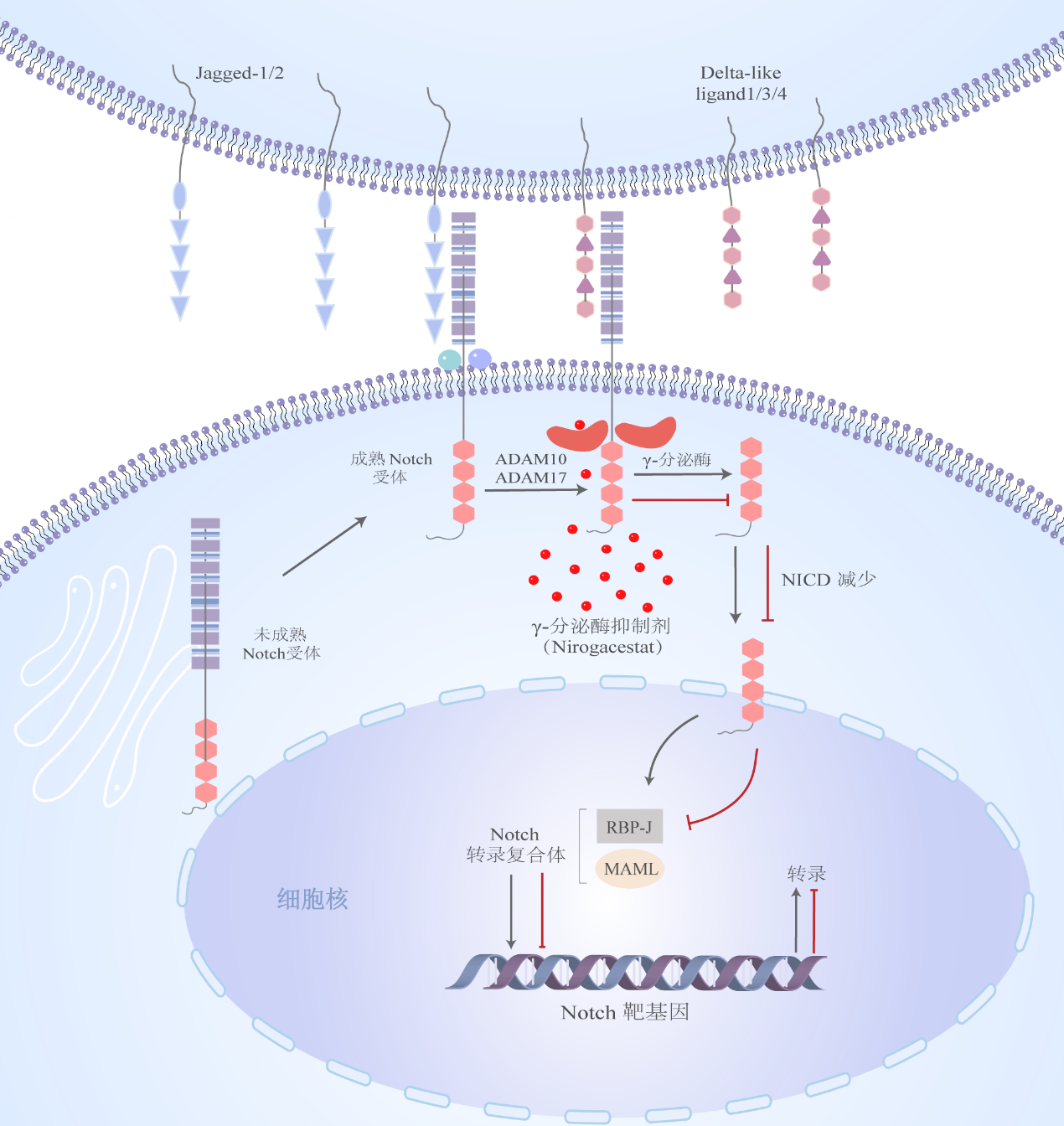 图2 Notch信号通路及γ-分泌酶抑制剂作用原理
图2 Notch信号通路及γ-分泌酶抑制剂作用原理
γ-分泌酶抑制剂可结合Notch信号通路中的γ-分泌酶,阻碍NICD形成及核易位,最终抑制Notch靶基因转录。
ADAM10/17:金属蛋白酶10/17; NICD:Notch胞内结构域; RBP-J/MAML:Notch通路转录因子
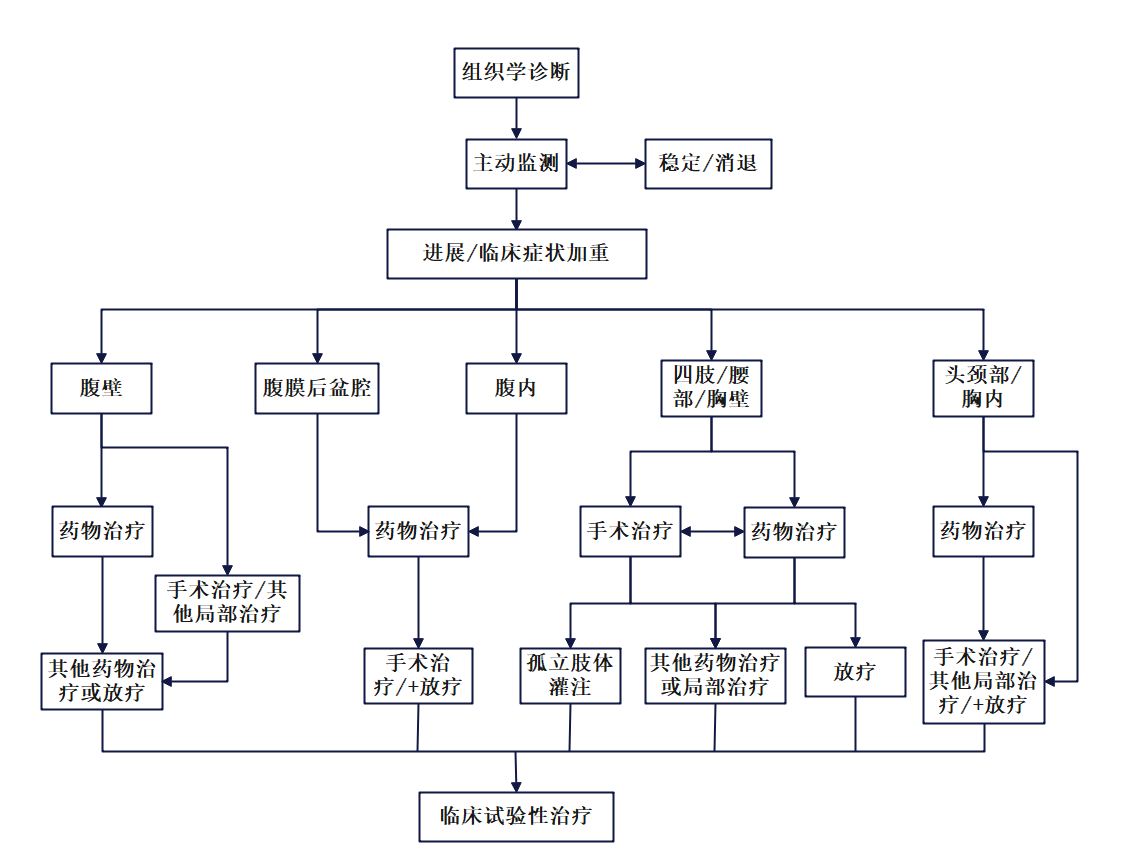
图3 DT患者治疗策略[14]
表1 其他在研药物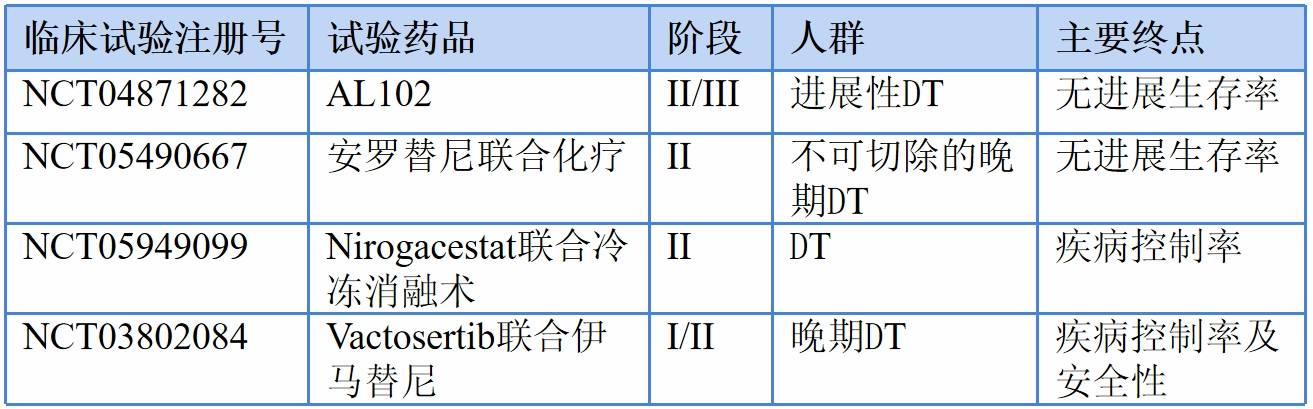
排版编辑:肿瘤资讯-Vicky











 苏公网安备32059002004080号
苏公网安备32059002004080号


