整理:肿瘤资讯
来源:肿瘤资讯
以下内容仅供中国大陆地区执业的医学药学专业人士阅读参考,如您非前述专业人士,请离开本页面
病例点评:苏州大学附属第一医院 周晓俊 教授
随着各种靶向药物的不断问世,晚期GIST的治疗逐渐从单独手术转变为手术联合靶向药物的综合治疗模式。在整个病程中,实现有效的减瘤手术能够很大程度上延长患者的生存,所以如何选择合适的药物和如何把握手术时机显得尤为重要。瑞派替尼因其独特的作用机制,可发挥良好的抗肿瘤疗效,给手术创造机会。本文报告一例既往经过两种TKI治疗进展的晚期GIST患者,三次基因检测结果均为KIT 9突变,瑞派替尼治疗15个月时肿瘤缩小并稳定后进行手术,术后继续瑞派替尼治疗,病灶保持稳定并部分液化,且治疗期间患者耐受性良好。该病例很好地诠释了药物与手术的“天作之合”。

专家点评
周晓俊教授点评
治疗小结

病例简介
基本情况
患者男性,63岁,2017年9月因黑便伴有呕吐,外院查血常规提示血红蛋白为30g/L,CT提示小肠间质瘤,行输血、禁食支持治疗,后转至我院。无高血压史和手术史。
治疗经过
第一次手术治疗
2017年9月27日于我院行十二指肠肿瘤切除术,十二指肠-空肠吻合术,术中见十二指肠水平部、升部和空肠起始部交汇处约6*5*5cm大小的肿物。 病理诊断:小肠间质瘤,核分裂象6个/50HPF,两切端未见肿瘤累及。 肿瘤细胞: CD117(+), CD34(+), DOG-1(+), SMA(-), Ki67(10%), S-100(-), Desmin(-)。 基因检测:KIT基因9外显子(KIT 9)突变(Y503_F504INSAY),未检测到PDGFRA突变。增强CT和肝脏磁共振提示:肝内多发病变,约14枚,其中最大一枚直径5.1cm,无法手术切除。
伊马替尼600mg qd治疗3年5个月后进展
2017年10月18日,口服伊马替尼600mg qd(考虑患者为KIT 9突变,指南推荐需要伊马替尼加量治疗),术后两年内每三个月规律性复查,均无进展,部分病灶有所退缩或消失,而后每半年复查一次。
2021年3月30日,常规复查提示肝脏病灶进展,主要表现为左肝叶肿瘤直径变大,直径约5.7cm。
伊马替尼800mg qd治疗维持8个月,期间缓慢进展
2021年4月,患者在服用伊马替尼期间耐受性良好,但因其肝脏功能较差,担心很难耐受舒尼替尼,综合考量后调整伊马替尼剂量至800mg qd。
2021年5月和7月两次核磁复查提示肝脏病灶逐渐增大,主要表现为左肝叶灶病直径增大为7.4cm和8.4cm,遂再次收住入院治疗。

2021年5月18日
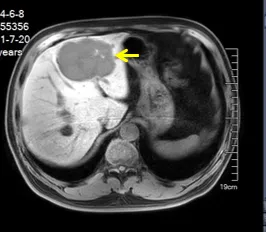
2021年7月20日
2021年8月3日再次入院肝脏穿刺活检结果提示:CD117+,DOG1+,胃肠道间质瘤;基因检测结果:KIT基因9外显子突变。
患者因肝功能异常,担心舒尼替尼和瑞戈非尼的副作用,因此又继续用伊马替尼800mg qd 4个月,期间肿瘤缓慢进展。
阿伐替尼300mg qd治疗7个月后进展
2021年10月18日,开始阿伐替尼300mg qd治疗(患者因担心无法耐受舒尼替尼和瑞戈非尼,因此综合各方面因素考量而选择阿伐替尼治疗),服药过程中每次复查均提示左肝叶病灶增大,且副作用较重,乳酸脱氢酶持续升高(2022年5月3日检查结果显示为最高值507 U/L),肌肉无力(患者依然担心换其他药的副作用无法承受,而选择继续用药)。
2022年5月11日,左肝叶肿瘤病灶最大直径约12.7cm,评估为PD。

瑞派替尼治疗前MR检查结果
开始瑞派替尼150mg qd治疗
2022年5月18日,口服瑞派替尼150mg qd,治疗期间副作用主要为I级皮炎、脱发。定期复查磁共振,提示肝脏转移病灶稳定。
2023年5月18日,复查左肝病灶直径缩小至7.1cm。

瑞派替尼治疗肿瘤达到缩小的核磁检查结果
第二次手术治疗
2023年7月20日,复查提示肝脏病灶较前稳定,部分液化,但不再缩小,最大直径约7.7cm(因此时病灶稳定,且患者状态良好,经与患者充分沟通后,决定进行减瘤手术)。

第二次手术前MR检查结果
2023年8月28日,行“腹腔镜下半肝切除术(左)+腹腔镜下肝部分切除术(V段肿瘤切除)+腹腔镜下胆囊切除术”。
术后病理:CD117+,DOG1+,胃肠道间质瘤转移;基因检测:KIT基因外显子9突变。
第二次手术后继续瑞派替尼治疗
2023年9月,口服瑞派替尼治疗100mg qd(考虑此前瑞派替尼疗效显著,综合经济因素考虑减量),每三个月规律复查,肝脏残余转移病灶稳定,部分液化。

瑞派替尼术后治疗5个月MR检查结果
(2024年2月20日)

瑞派替尼术后治疗8个月MR检查结果
(2024年5月20日)
专家点评
周晓俊教授:
GIST是非常典型的基因驱动型肿瘤,也是肿瘤精准治疗的先驱,80%以上会发生KIT基因突变,其中外显子11突变约占60%,外显子9突变约占10% [1] 。伊马替尼的问世,可给晚期GIST患者带来近两年的无进展生存期,但是对于KIT 9突变的患者来说,伊马替尼400mg qd的治疗疗效通常不显著,往往需要加量至600mg qd,在耐受性良好的情况下可增加剂量至800mg qd [2,3] 。该患者三次的基因检测结果均为KIT 9突变,伊马替尼600mg qd治疗41个月后进展,因考虑患者在治疗期间耐受性良好,遂加量至800mg qd继续治疗,但在治疗过程中肿瘤无法得到有效控制。因此,能够选择一个疗效与安全性兼顾的药物显得尤为重要。
瑞派替尼是一种新型的“开关控制”酪氨酸激酶抑制剂,能够有效且广泛抑制包括9外显子以内的KIT基因的多种原发和继发突变,在国内外各项临床研究中均显现出显著的临床活性和良好的安全性特征。瑞派替尼中国二线研究和FIH研究显示,瑞派替尼150mg qd用于二线和三线治疗的mPFS分别为13.8个月和8.3个月,且一旦有效,疗效持久 [4,5] 。INVICTUS研究显示,瑞派替尼可显著延长四线及以上患者的mPFS,达到6.3个月,且基因突变亚组分析显示无论KIT突变状态如何,接受瑞派替尼的患者在PFS方面均优于安慰剂患者(外显子11, P<0.0001;外显子9, P=0.0023;外显子13, P<0.0001;外显子17, P<0.0001) [6,7] 。该病例在肿瘤进展阶段接受瑞派替尼150mg qd的治疗,治疗期间定期复查,维持疾病稳定15个月,病灶明显缩小,且未出现严重不良反应,主要为轻度皮疹和脱发。
众所周知,晚期GIST的治疗逐渐从单独手术转变为手术联合靶向药物的综合治疗模式。在整个病程中,实现有效的减瘤手术能够很大程度上延长患者的生存,所以临床需要认真考量该如何选择合适的药物和如何把握手术时机,真正实现靶向药物和手术的“天作之合”。NCCN和CSCO指南中指出,当肿瘤达到最大缓解或者不再退缩时,可考虑手术切除 [3,8] ,且有研究报道,术前TKI治疗应答越好,手术获益越明显 [9] 。瑞派替尼中国二线研究和FIH研究显示,瑞派替尼150mg qd用于二线和三线治疗的ORR分别为37.1%和14.3% [4,5] 。即便在四线人群中,ORR也可超过10%,在中国人群中可超过20%。另外,晚期GIST患者手术治疗要以安全性为首要前提,需要谨慎对待术中和术后一系列并发症的问题。瑞派替尼以其独特的作用机制,达到较高的客观缓解率,很大程度上使肿瘤退缩,且瑞派替尼相对于其他TKI安全性良好,这无疑给再次手术创造条件和机会。该病例在瑞派替尼治疗一年多后肿瘤缩小显著,此时临床评估已经达到可手术的标准和条件,为了使患者的生存获益最大化,综合考量后决定再次手术。术后基因检测仍然为KIT 9突变。因考虑病灶已经切除,且瑞派替尼此前治疗疗效显著,遂决定术后进行减量至100mg qd,目前已经治疗8个月,疾病稳定且部分病灶液化,期待后续更好的疗效。
该病例提示我们,在晚期GIST的治疗过程中,需要根据临床实践并结合患者的自身情况和治疗意愿综合考量,制定个性化的治疗方案,才能使患者获益最大化。
参考文献:
1. Blay JY, et al. Gastrointestinal stromal tumors. Nat Rev Dis Primers. 2021 Mar 18;7(1):22.
2. Blanke CD, et al. Long-Term Results From a Randomized Phase II Trial of Standard- Versus Higher-Dose Imatinib Mesylate for Patients With Unresectable or Metastatic Gastrointestinal Stromal Tumors Expressing KIT. J Clin Oncol. 2008;26(4):620-5.
3. CSCO 胃肠间质瘤诊疗指南. 2024
4. Janku Filip, et al. Switch Control Inhibition of KIT and PDGFRA in Patients With Advanced Gastrointestinal Stromal Tumor: A Phase I Study of Ripretinib. J Clin Oncol. 2020 Oct 1;38(28):3294-3303.
5. Li, J., et al. Efficacy and safety of ripretinib vs. sunitinib in patients with advanced gastrointestinal stromal tumor previously treated with imatinib: A phase 2, multicenter, randomized, open-label study in China. Eur J Cancer. 2024 Jan:196:113439.
6. Jean-Yves Blay, et al. Ripretinib in patients with advanced gastrointestinal stromal tumours (INVICTUS): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol. 2020 Jul;21(7):923-934.
7. Sebastian Bauer, et al. Clinical Activity of Ripretinib in Patients with Advanced Gastrointestinal Stromal Tumor Harboring Heterogeneous KIT/PDGFRA Mutations in the Phase III INVICTUS Study. Clin Cancer Res. 2021 Dec 1;27(23):6333-6342.
8. NCCN clinical practice guidelines in Oncology: Gastrointestinal Stromal Tumors (GISTs)(V1.2024).
9. Qiu, H, et al. Advanced gastrointestinal stromal tumor patients benefit from palliative surgery after tyrosine kinase inhibitors therapy. Medicine (Baltimore). 2018 Jan;97(2): e9097.
*以上信息涉及尚未在中国获批的产品/适应症。此信息仅作信息分享用途,不应被理解为这些产品/适应症在中国获批或注册。
责任编辑:肿瘤资讯-Marie
排版编辑:肿瘤资讯-CYX
版权声明
本文专供医学专业人士参考,未经著作人许可,不可出版发行。同时,欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。











 苏公网安备32059002004080号
苏公网安备32059002004080号


