2024年6月13日~6月16日,第29届欧洲血液病协会(EHA)年会将于“欧洲之门”西班牙马德里盛大召开。作为最重要的血液学会议之一,本次EHA年会共有3000余项研究的最新结果公布。摘要一经公布,【肿瘤资讯】第一时间邀请到徐州医科大附属医院桑威教授,就EB病毒(EBV)相关疾病话题的重要进展进行了筛选与点评,内容如下。
徐医附院细胞研究和转化医学中心副主任
徐医附院血液科科副主任,淋巴瘤病区主任
中华医学会血液学分会淋巴细胞疾病学组委员
中国抗癌协会淋巴瘤专委会委员
中国EBV相关疾病工作组秘书长
中国抗癌协会血液肿瘤专业委员会青年委员
中国抗癌协会血液肿瘤委员会慢淋工作组委员
中国抗癌协会第一届T细胞淋巴瘤工作组委员
中国老年医学会血液学分会淋巴瘤学组委员
江苏省医学会血液学分会青年委员会副主任委员
江苏省淋巴瘤联盟副主席
江苏省医学会血液学分会淋巴瘤学组委员
江苏省“六大人才高峰”“333”人才培养对象
江苏省“科教强卫工程”青年医学人才
国家自然科学基金评审专家

Abstract S305:CAR-T细胞治疗复发/难治性T细胞急性淋巴细胞白血病/淋巴母细胞淋巴瘤中的CMV/EBV感染分析
标题:CMV/EBV INFECTIONS IN CAR-T THERAPY FOR RELAPSED/REFRACTORY T-CELL ACUTE LYMPHOBLASTIC LEUKEMIA/LYMPHOMA
作者:Jing Pan, et al.
研究背景
靶向CD7或CD5的CAR-T细胞疗法已显示出对复发/难治性(R/R)T淋巴母细胞白血病/淋巴瘤(T-ALL/LBL)患者具有疗效。然而,严重的巨细胞病毒(CMV)和EBV感染是较大的治疗风险,这可能与CAR-T细胞引起的T细胞耗竭有关。
研究目的
探索CMV和EBV感染相关的相关因素及风险应对策略。
研究方法
本研究基于三个临床研究队列数据:自体CD7 CAR-T(Ⅰ期)、供体来源的CD7 CAR-T(Ⅰ/Ⅱ期)以及供体来源的CD5 CAR-T(Ⅰ期)数据。所有患者或其监护人在筛选前均提交了书面知情同意书。感染等级按CTCAE 5.0版分级。单因素分析采用非参数检验,多因素分析采用logistic回归。
研究结果
从2020年7月到2023年9月,114例临床试验患者被纳入分析。25例患者(22%)感染CMV,17例(15%)感染EBV,其中6例患者同时感染CMV和EBV。输注后30天内,观察到2例(2%)1级CMV感染和2例(2%)1级EBV感染。
在42例接受SCT的患者中,总T细胞计数恢复到正常水平的有9例(21%),中位恢复时间为6.2个月。其中,7例(17%)患者在SCT后中位1.1个月感染CMV(1例严重),7例(17%)患者在SCT后中位2.1个月感染EBV(1例严重)。
在未接受巩固性SCT的65例患者中,总T细胞计数恢复到正常水平的有14例(22%),中位恢复时间为1.3个月。其中,16例(25%)患者在中位2个月时感染CMV(6例严重),8例(12%)患者在中位1.1个月时感染EBV(4例严重)。
几乎所有患者均出现总T细胞和CD4+ T细胞缺乏,感染患者中的总T细胞计数和CD4+ T细胞计数在输注后第30天的中位水平分别为170/μL和28/μL,低于非感染患者(P=0.036)。11例移植后可检测到CAR-T细胞的患者中,7例发生病毒感染,提示SCT后发生的感染可能与CAR-T细胞的持久性有关。通过多变量分析,发现T细胞缺乏与病毒感染独立相关(P=0.029)。
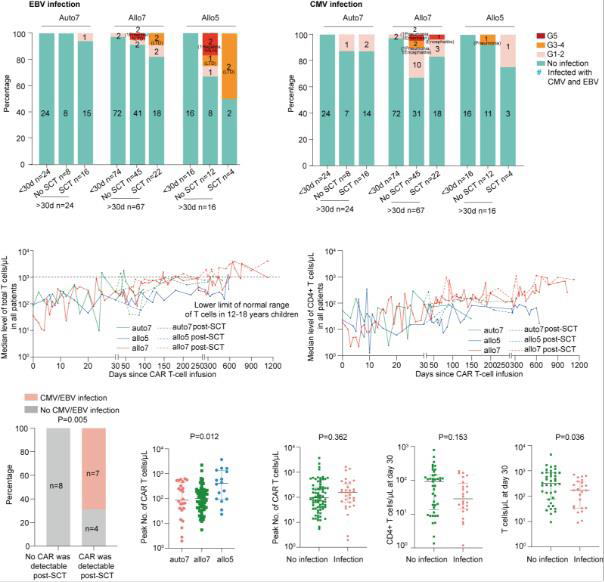
图1.
Abstract PB3200:Tabelecleucel获得上市许可后在欧洲真实世界治疗EBV阳性移植后淋巴细胞增殖性疾病(PTLD)的安全性和有效性的观察性研究
标题:TRIAL IN PROGRESS: OBSERVATIONAL, POST-AUTHORISATION SAFETY STUDY TO DESCRIBE SAFETY AND EFFECTIVENESS OF TABELECLEUCEL IN PATIENTS WITH EBV+ PTLD IN A REAL-WORLD SETTING IN EUROPE
作者:Denjean F, et al.
研究背景
PTLD发生在造血干细胞移植(HCT)或实体器官移植(SOT)后。Tabelecleucel (Tab-cel) 是第一个获准在欧洲用于治疗R/R EBV+ PTLD的现货型异体EBV特异性T细胞治疗。Tab-cel获得附条件批准上市,是基于ALLELE研究的积极结果,:一项全球、多中心、开放标签的3期试验(NCT03394365)的初步结果,显示该产品在HCT和SOT患者中的客观缓解率(ORR)分别为50.0%和51.7%,并且具有良好的安全性。基于这一关键试验的数据,欧洲启动了一项上市后安全性研究(PASS),以观察Tab-cel在真实世界中治疗EBV+ PTLD患者的安全性和有效性数据。
研究目的
在真实世界中探索Tab-cel上市后治疗EBV+ PTLD的多中心、安全性观察性研究,欧洲所有接受上市后Tab-cel治疗的患者将被纳入分析。
研究方法
本研究主要研究终点是描述在真实世界中使用Tab-cel治疗的EBV+ PTLD患者的安全性。次要研究终点包括描述Tab-cel有效性、患者人群和治疗模式(包括Tab-cel的剂量和时间表)分析。每个纳入患者从首次接受用药开始随访3年。
研究结果
德国是首个参与并启动的研究中心,研究结果预计将在年底公布。
Abstract PB3193:一项在欧洲拓展临床研究(EAP)下使用同种异体EBV特异性T细胞免疫疗法(Tabelecleucel)治疗EBV阳性PCNS PTLD患者的有效性和安全性结果
标题:PROMISING EFFECTIVENESS AND SAFETY OUTCOMES IN PATIENTS WITH EBV+ PCNS PTLD TREATED WITH ALLOGENEIC EBV-SPECIFIC T-CELL IMMUNOTHERAPY (TABELECLEUCEL) UNDER AN EXPANDED ACCESS PROGRAM (EAP) IN EUROPE.
作者:Choquet S, et al.
研究背景
R/R EBV+ PTLD预后不良,HCT或SOT后的R/R EBV+ PTLD预后较差,估计的总生存期(OS)分别仅为0.7个月和4.1个月。Tab-cel作为第一个获批的现货型同种异体EBV特异性T细胞免疫疗法,在利妥昔单抗±化疗治疗失败的EBV+ PTLD中显示出较好的临床获益和安全性。原发性中枢神经系统(PCNS)的EBV+ PTLD是一种严重且罕见的疾病,缺乏有效治疗方法,存在较大的临床需求。
研究目的
Atara Bio在欧洲拓展的EAP研究包括EBV+ PTLD,该研究目的在于评估的Tab-cel治疗R/R EBV+ PCNS PTLD患者的有效性和安全性数据,这些患者在2020年9月至2022年12月期间签署了知情同意。
研究方法
对于签署知情同意的患者,根据EAP临床实践,收集基线数据进行分析。在首次给药后进行至少两年的生存随访,截访时间2024年5月。患者接受每周3次的输注周期,目标剂量为 2×106 /kg。由主治医师根据当地医院标准进行临床疗效评估。研究主要终点是安全性、ORR和OS。
研究结果
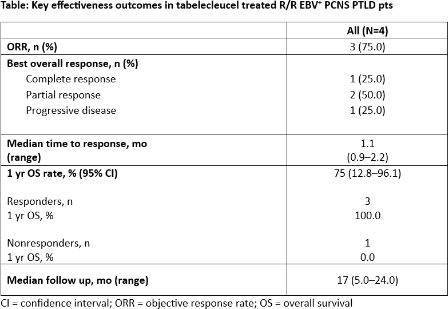
4例患有R/R EBV+ PCNS PTLD的患者(2例为HCT后;2例为SOT后)接受了Tab-cel治疗。所有患者均在利妥昔单抗+化疗失败后接受治疗,且中位既往治疗线数为2线,中位治疗周期和剂量分别是2个周期和6个剂量。ORR为75.0%,至中位缓解时间(TTR)为1.1个月,1年OS率为75%。
未报告任何与治疗相关的威胁生命的治疗相关不良事件(TEAE),也未报告任何严重的治疗相关神经毒性、器官排斥、移植物抗宿主病(GVHD)等发生。
表1. 关键疗效终点
Abstract P2114:成人系统性慢性活动性EBV感染的临床特征和预后因素:基于日本注册数据的回顾性分析
标题:CLINICAL FEATURES AND PROGNOSTIC FACTORS OF ADULT SYSTEMIC CHRONIC ACTIVE EPSTEIN-BARR VIRUS DISEASE: A RETROSPECTIVE ANALYSIS USING JAPANESE REGISTRY DATA
作者:FUSEYA A, et al.
研究背景
系统性慢性活动性EBV感染(sCAEBV)是一种难治性疾病,其中EB病毒持续感染T细胞和NK细胞,导致系统性慢性炎症和克隆性增殖。sCAEBV患者主要来自东亚。最初,sCAEBV被认为是一种儿童疾病,但日本全国调查报告显示,超过一半的sCAEBV患者是成人。根据该报告,异基因造血干细胞移植(allo-HSCT)是目前唯一可用的治愈治疗。此外,成年患者的预后比儿童患者差。
研究目的
本研究旨在阐明日本成人sCAEBV的病理生理学特征,并探讨其预后不良的因素。
研究方法
利用日本厚生劳动省的注册数据,分析了圣玛丽安娜医科大学医院和东京医科牙科大学医院的患者,这两所医院是日本sCAEBV患者数量最多的两家机构。患者在满足以下四个条件时被诊断为sCAEBV:(1)系统性炎症症状持续超过3个月,(2)外周血中EBV-DNA载量升高(> 102.5拷贝/毫克DNA),(3)T细胞或NK细胞中的EB病毒感染,以及(4)不同于其他已知疾病。诊断标准符合WHO分类中sCAEBV的定义。
研究结果
分析了58例患者。诊断时的年龄在18到64岁之间(中位年龄为34岁),男性/女性比例为30/28。EBV感染细胞在25例患者中为CD4阳性,在8例患者中为CD8阳性,在19例患者中为CD56阳性。2例患者为CD56阴性NK细胞。3例患者同时感染了T细胞和NK细胞。1例患者被确定为CD4和CD8双阳性细胞。没有患者有传染性单核细胞增多症的病史。
4例患者由水疱疫苗性淋巴增殖性疾病发展而来,患者的CD4阳性细胞均被感染。6例患者由严重的蚊虫叮咬过敏发展而来,在这6例患者中,3例患者的感染细胞为CD4阳性细胞,另外3例患者为CD56阳性细胞。3年生存率(3y-OS)为45.9%。48例患者接受了allo-HSCT,结果3年生存率为53.9%。诊断时ALT高于机构标准值两倍(P<0.001),血小板计数低于50,000 /μL(P<0.05),和sIL-2R高于2500 U/mL(P<0.005)的患者在allo-HSCT后的3年生存率显著降低。血浆中检测到EBV-DNA的患者的3年生存率趋势较低。在多变量分析中,高ALT水平与不良预后相关(P<0.005)。
Abstract P1439:针对EBV相关血液肿瘤的树突状细胞疫苗(KSD-101):一项正在进行的Ⅰ期临床研究
标题:DENDRITIC CELL-BASED VACCINES (KSD-101) AGAINST EBV- ASSOCIATED HEMATOLOGIC NEOPLASMS: RESULTS FROM AN ONGOING PHASE I CLINICAL STUDY
作者:Li C, et al.
研究背景
EBV感染了全世界超95%的人口。世卫组织确认EBV是第一个与人类肿瘤相关的致瘤病毒,EBV相关的血液肿瘤严重威胁人类健康。KSD-101是一种首创的自体树突状细胞(DC)疫苗,针对EBV相关的血液系统肿瘤。
研究目的
旨在评估KSD-101的安全性和有效性(NCT05635591)。主要终点是评估耐受性、安全性、剂量限制性毒性(DLT)和最大耐受剂量(MTD)。次要终点是探索临床疗效和免疫反应。
研究方法
将招募对常规治疗无效或复发的EBV相关血液肿瘤患者。患者将接受KSD-101单药治疗,通过皮下注射,每2周一次,共进行3~5次疫苗接种,无需预处理的淋巴细胞清除或预防性药物。研究采用3+3剂量递增设计。
研究结果
截至2023年10月30日,9例患者接受了至少3剂KSD-101。在剂量递增阶段,3例患者接受了每剂5.0×106细胞,2例患者接受了每剂7.5×106细胞。每剂5.0×106细胞应用于扩展阶段。在所有患者中,未发现DLT或MTD。疫苗接种耐受性良好。患者经历的KSD-101相关毒性包括发热(≤2级)、注射部位反应(1级)、淋巴结肿大(1级)和淋巴细胞计数增加(1级)。
在5例可评估疗效的患者中(1例因早期疾病复发被排除,2例尚未达到疗效评估时间,1例因其他原因未被纳入),ORR为100%,完全缓解(CR)率为100%,包括1例AITL(EBV感染T、B、NK细胞)、1例CAEBV(EBV感染T、NK细胞)、2例NK/T细胞淋巴瘤(1例EBV感染B、NK细胞,1例EBV感染NK细胞)和1例DLBCL(外周T细胞淋巴瘤转化,EBV感染B、NK细胞)。
接种疫苗后,研究人员发现CD3+CD8+ T细胞中的EBV特异性T细胞峰值比例(平均2.47%)显著增加(P<0.05),相比基线(平均0.30%),并且免疫细胞的峰值数量也增加,例如B细胞(P<0.05,平均增加27.51倍)、NK细胞(P<0.01,平均增加1.68倍)和CD8+ T细胞(P<0.05,平均增加2.38倍)。此外,还发现Tregs的谷值数量显著减少(P<0.001,平均减少至53.05%)。
Abstract P1376:EB病毒相关PTLD继发性噬血细胞性淋巴组织细胞增多症(HLH)的临床表现、风险因素及临床结局
标题:CLINICAL MANIFESTATIONS, RISK FACTORS, CLINICAL OUTCOMES OF SECONDARY HEMOPHAGOCYTIC LYMPHOHISTIOCYTOSIS AFTER EBV- RELATED POST-TRANSPLANT LYMPHOPROLIFERATIVE DISORDERS.
作者:Liu D, et al.
研究背景
EBV-PTLD是allo-HSCT后的一种并发症。淋巴瘤和EBV感染都是继发性HLH(sHLH)的常见原因,sHLH也是allo-HSCT后的一种罕见但严重的并发症。然而,目前仅有个案报告描述了allo-HSCT受者中EBV-PTLD后继发的sHLH,且其临床表现、风险因素及患者结局尚不明确。
研究目的
旨在确定接受allo-HSCT患者中EBV-PTLD后继发sHLH的临床表现,并比较有无sHLH的EBV-PTLD患者的特征和临床结局。
研究方法
本研究基于北京大学血液研究所(PUIH)的移植数据库进行,纳入了2023年1月1日至2023年12月31日期间诊断为EBV-PTLD并继发sHLH的11例患者。同期未发生sHLH的EBV-PTLD患者作为对照。主要研究终点为PTLD相关死亡率,次要终点为OS率。
研究结果
11例患者在EBV-PTLD后发生了sHLH。allo-HSCT至PTLD诊断的中位时间为69天(范围:39~98天),PTLD至HLH发生的中位时间为5天(范围:2~101天)。HLH最常见的表现是铁蛋白升高(100%)和可溶性CD25抗原升高(100%),其次是全血细胞减少症(91%)、发热(82%)、高甘油三酯血症(82%)和乳酸脱氢酶升高(82%)。
sHLH最常见的治疗方法是皮质类固醇治疗(100%),其次是依托泊苷(63.6%)、静脉注射免疫球蛋白(IVIG, 45.5%)和鲁索替尼(27.3%)。在诊断为sHLH后,9例患者(81.8%)死亡,从sHLH发生到死亡的中位时间为10天(范围:3~21天)。
体温≥39.6℃、高水平EBV DNA血症(>105 拷贝/ml)和T/NK细胞中高水平EBV增加了EBV-PLTD后发生sHLH的风险。在具有上述三种风险因素的患者中,sHLH的发生率可高达77.8%。EBV-PTLD患者中有无sHLH的100天PTLD相关死亡率分别为84.1%和8.3%,OS率分别为15.9%和91.7%。
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


