1.BRCA突变乳腺癌是一种特殊类型的疾病,尽早识别有助于进行遗传咨询与风险评估、判断预后以及指导临床手术、治疗决策。
2.所有新诊断的三阴型乳腺癌、确诊年龄小于50岁的乳腺癌以及有家族史的患者都尽早接受胚系BRCA检测。
3.OlympiA是目前唯一针对gBRCAm乳腺癌辅助治疗,且取得明确生存获益的三期临床研究,结果表明,奥拉帕利辅助治疗1年可以显著减少gBRCAm早期乳腺癌患者疾病复发与死亡的风险。
2013年,37岁的美国著名影星安吉丽娜·朱莉通过基因测序发现自己携带BRCA1基因突变,由于有患癌的家族史,她决定进行预防性乳腺切除。2年后,她再次接受手术摘除了卵巢和输卵管。这一新闻让BRCA基因走入大众视野,不少乳腺癌医生在临床工作中都会被患者问到BRCA检测相关的问题。本报特邀大连医科大学附属第二医院的肿瘤学科主任李曼教授为您解析乳腺癌胚系BRCA检测的临床应用。
乳腺癌易感基因(breast cancer susceptibility gene,BRCA)包括BRCA1和BRCA2,是目前最被熟知的抑癌基因之一,其编码产物参与DNA损伤同源性重组修复,维持细胞的正常功能[1]。BRCA1/2基因突变会导致同源重组缺陷,使得基因组不稳定性显著增加,与包括乳腺癌、卵巢癌、前列腺癌、胰腺癌等多种肿瘤的发生发展密切相关[2]。
BRCA基因突变分为两种类型:一种为胚系突变,是指来源于精子或卵母细胞的生殖细胞突变,导致机体所有细胞都带有突变,可以遗传给后代,胚系检测一般使用血液、唾液、口腔拭子等样本,目前以血液(白细胞)样本为主,检测到的BRCA1/2变异为胚系变异;另一种为体细胞突变,是指发生于肿瘤细胞中的BRCA基因突变,为非遗传性突变。在乳腺癌中以胚系BRCA突变为主,占所有BRCA突变的70%以上[3]。
与其他为了指导治疗的基因检测不同,胚系BRCA检测除了能够指导以奥拉帕利为代表的PARP抑制剂治疗之外,还可以发挥“预防性管理”的作用,有助于降低此类特殊遗传性疾病的死亡率和社会影响。
1. 胚系BRCA检测的临床意义
遗传咨询与风险评估:
携带BRCA1/2基因突变的女性不仅乳腺癌发病风险增加,其他如卵巢癌、输卵管癌、胰腺癌、胃肠癌及黑素瘤等发病风险也增加,男性罹患乳腺癌、前列腺癌风险增加。因此对于乳腺癌患者以及具有肿瘤家族史的高危人群进行胚系BRCA检测有助于提早评估患者的患病风险,进行预防性干预措施。
根据一项纳入了63 828例肿瘤患者和37 086名对照者的大型病例对照研究统计,BRCA胚系突变携带者罹患乳腺癌、卵巢癌的风险相比于普通人群分别提高16.1倍(BRCA1) /10.9倍(BRCA2)、75.6倍(BRCA1)/11.3倍(BRCA2)。此外,突变携带者罹患胰腺癌、前列腺癌的风险也对应升高12.6倍(BRCA1) /10.7倍 ( BRCA 2 ) 、 1.1 倍 ( BRCA 1 ) /4.0 倍(BRCA2)。男性BRCA1基因突变携带者乳腺癌发病风险增加10~50倍,BRCA2基因突变携带者乳腺癌发病风险增加50~100倍[4]。
中国人群数据显示,BRCA1基因突变携带者乳腺癌发生风险在79岁前为37.9%,BRCA2基因突变携带者为36.5%[5]。
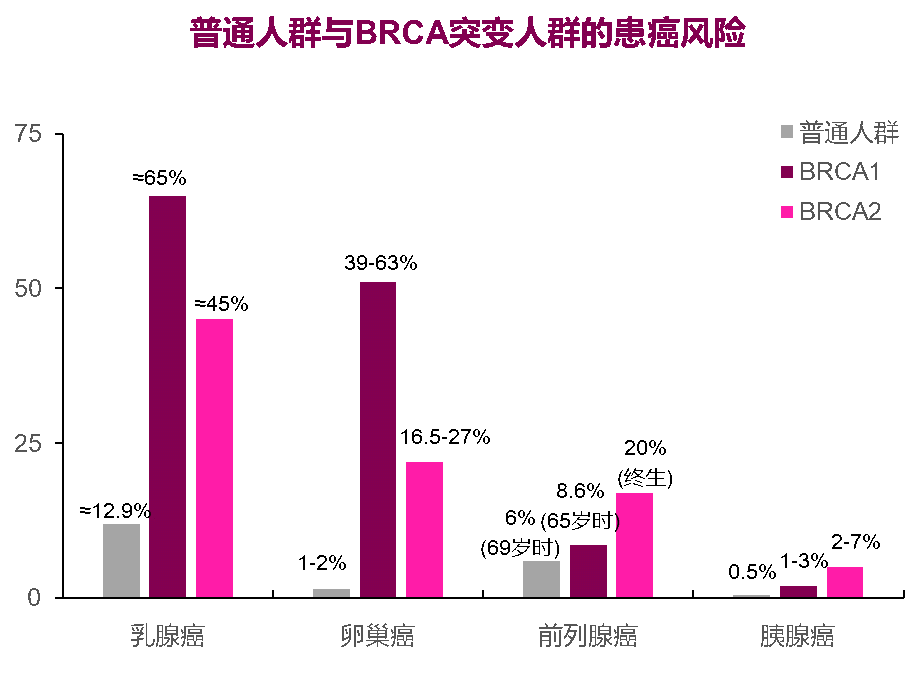
判断疾病风险与预后;
研究表明,与非突变患者相比,携带BRCA突变的乳腺癌其肿瘤组织病理分级更高、中枢神经系统转移更多[6]。此外,多项研究均显示携带BRCA1/2基因突变的乳腺癌有预后更差的趋势。一项纳入60项研究共105 220例乳腺癌患者的Meta分析显示,BRCA1基因突变患者OS和乳腺癌特异性生存期(breast cancerspecific survival,BCSS)短于未突变者(OS:HR=1.30,95%CI:1.11~1.52,P=0.001;BCSS:HR=1.45,95%CI:1.01~2.07,P=0.045),BRCA2突变患者BCSS短于未突变者(HR=1.29,95%CI:1.03~1.62,P=0.03)[7]。
指导手术决策;
随着保乳手术在临床中的广泛开展,胚系BRCA突变患者行保乳手术是否增加同侧乳腺癌的局部复发率,是影响患者选择保乳或全切手术的重要因素。针对中国人群的研究显示,与全切手术相比,在随访7年时,BRCA突变患者接受保乳术后未显著增加局部复发率(3.9% vs 2%,p=0.16),但患者同侧新发乳腺癌比例显著增加(3.9% vs 0.6%,p=0.01)[8]。目前2024版CSCB仍将携带BRCA突变作为需要谨慎考虑保乳手术的考量因素。
此外,是否需要进行对侧预防性切除也是BRCA突变患者面临的决策。2024版NCCN指南提出,应充分考虑患者年龄、家族史、预期寿命等情况,与之充分沟通患病风险、重建手术选择、手术并发症等,共同制订决策。同时也应当邀请妇科肿瘤的医生共同参与,制订针对卵巢癌的风险管理。
指导药物治疗选择;
PARP抑制剂的问世为携带胚系BRCA突变的乳腺癌带来了全新的靶向治疗选择。
在早期阶段,OlympiA研究证实,对于携带gBRCA突变的高危HER2-性乳腺癌,接受奥拉帕利辅助治疗1年能够显著改善4年无浸润性疾病生存率(iDFS)和4年远端无病生存率(DDFS)较安慰剂组有明显改善(iDFS: 82.7% vs75.4%,HR 0.63 [99.5%CI, 0.50-0.78]; DDFS:86.5% vs 79.1%, HR 0.61 [95%CI ,0.48‒0.77],与安慰剂相比,奥拉帕利也显示出显著的OS获益,死亡风险降低32% (4年OS率:89.8% vs 86.4%,HR 0.68,p=0.009)[9]。
在晚期阶段,奥拉帕利的OlympiAD研究,他拉唑帕利的EMBRACA研究均证实PARP抑制剂可以改善gBRCA突变晚期HER2-性患者的PFS[10]。
2. 胚系BRCA检测的人群
在临床实践中,基于NCCN、CBCS指南,应对以下人群推荐进行胚系BRCA检测:
诊断年龄≤50岁:
BRCA1/2 突变乳腺癌患者普遍呈现发病年龄更早的特点,平均发病年龄较散发性乳腺癌患者早 5~8 年[11]。
疾病特征:
三阴型乳腺癌;
三阴性乳腺癌的BRCA1/2基因突变率约为12%,高于其他分型。
多个原发乳腺癌病灶;
男性乳腺癌;
具有肿瘤家族史的患者:
有已知的家族型致病性BRCA1/2基因突变
任何年龄发病,同时满足≥1项以下家族史标准:
① ≥1 直系亲属有≤50岁发病的乳腺癌史;
② ≥1 直系亲属确诊男性乳腺癌/卵巢癌/转移性或中高危前列腺癌/胰腺癌;
③ ≥2 旁系亲属确诊乳腺癌/卵巢癌/转移性或中高危前列腺癌/胰腺癌;
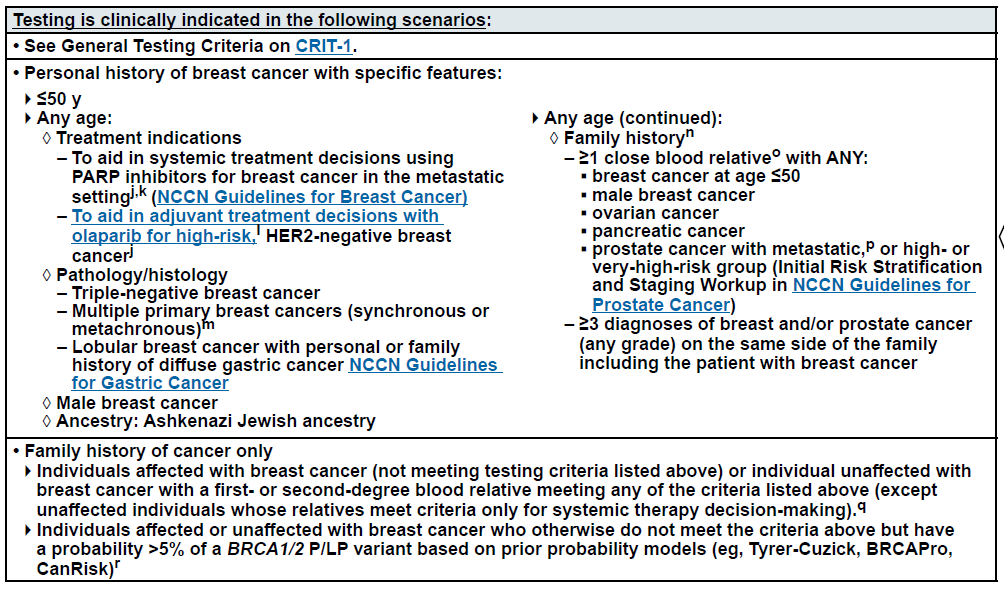
3. 胚系BRCA检测的时机
考虑到明确胚系BRCA突变对于遗传咨询和指导手术决策的价值,对于符合以上标准的患者,应在确诊乳腺癌时尽早接受BRCA检测。
此外,以指导临床治疗决策为目的的BRCA检测,可选择以下时机进行BRCA检测:
(1)早期辅助阶段:①TNBC:术后病理分期≥pN1或≥pT2,或新辅助后未达到pCR;②HR+ HER2-乳腺癌:术后病理≥4枚淋巴结阳性,或新辅助后未达到pCR且CPS+EG评分≥3;
(2)转移性阶段:①TNBC:初次确诊时,或预期更换治疗方案;②HR+ HER2-乳腺癌:既往经CDK4/6i治疗后进展。
总结
伴随着人群BRCA基因突变筛查理念的不断普及和检测成本的进一步下降。对于乳腺癌患者胚系BRCA突变检测可有效地提高疾病早期诊断率及干预有效性,指导临床决策,为BRCA突变患者带来更好的获益。
本期特邀专家—李曼教授
大连医科大学附属二院肿瘤学科主任、教研室主任
辽宁省特聘教授
辽宁省百千万人才百人层次
中国临床肿瘤学会(CSCO )理事
中国临床肿瘤学会乳腺癌专家委员会常委
中国抗癌协会化疗专业委员会常委
辽宁省医学会肿瘤分会副主任委员
辽宁省抗癌协会乳腺癌专业委员会副主任委员
大连市医学会肿瘤分会主任委员
1. Roy R, Chun J, Powell SN. BRCA1 and BRCA2: different roles in a common pathway of genome protection. Nat Rev Cancer. 2011;12(1):68-78. Published 2011 Dec 23. doi:10.1038/nrc3181
2. NAROD S A, FOULKES W D. BRCA1 and BRCA2: 1994 and beyond[J]. Nat Rev Cancer, 2004, 4(9): 665-676.
3. Winter C, Nilsson MP, Olsson E, et al. Targeted sequencing of BRCA1 and BRCA2 across a large unselected breast cancer cohort suggests that one-third of mutations are somatic. Ann Oncol. 2016;27(8):1532-1538. doi:10.1093/annonc/mdw209
4. MORAN A, O’HARA C, KHAN S, et al. Risk of cancer other than breast or ovarian in individuals with BRCA1 and BRCA2 mutations[J]. Fam Cancer, 2012, 11(2): 235-242.
5. YAO L, SUN J, ZHANG J, et al. Breast cancer risk in Chinese women with BRCA1 or BRCA2 mutations[J]. Breast Cancer Res Treat, 2016, 156(3): 441-445.
6. Aleskandarany M, Caracappa D, Nolan CC, et al. DNA damage response markers are differentially expressed in BRCA-mutated breast cancers. Breast Cancer Res Treat. 2015;150(1):81-90. doi:10.1007/s10549-015-3306-6
7. ZHONG Q, PENG H L, ZHAO X, et al. Effects of BRCA1-and BRCA2-related mutations on ovarian and breast cancer survival: a meta-analysis[J]. Clin Cancer Res, 2015, 21(1):211-220.
8. Cao W, Xie Y, He Y, et al. Risk of ipsilateral breast tumor recurrence in primary invasive breast cancer following breast-conserving surgery with BRCA1 and BRCA2 mutation in China. Breast Cancer Res Treat. 2019;175(3):749-754. doi:10.1007/s10549-019-05199-8
9. Tutt A,Garber JE,Kaufman B,et al. Adjuvant olaparib for patients with BRCA1- or BRCA2-mutated breast cancer [J]. N Engl J Med,2021,384(25):2394-2405.
10. Robson ME,Tung N,Conte P,et al. OlympiAD final overall survival and tolerability results:olaparib versus chemotherapy treatment of physician’s choice in patients with a germline BRCA mutation and HER2-negative metastatic breast cancer[J]. Ann Oncol,2019,30(4):558-566.
11. 中国抗癌协会家族遗传性肿瘤专业委员会. 中国家族遗传性肿瘤临床诊疗专家共识(2021年版)(1)—家族遗传性乳腺癌[J]. 中国肿瘤临床, 2021, 48(23): 1189-1195
12. NCCN,Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic,2024;
13. CACA-CBCS,2024.
排版编辑:肿瘤资讯-Rex











 苏公网安备32059002004080号
苏公网安备32059002004080号


