本期精选6篇在2024年4月份发表的结直肠癌领域文献,部分研究邀请到华中科技大学附属同济医院肿瘤中心邱红教授进行深入解读。
专家介绍
华中科技大学附属同济医院肿瘤中心教研室副主任/消化系统肿瘤科常务副主任
武汉市青年医生骨干人才/湖北省医学青年拔尖人才
中国抗癌协会靶向治疗专业青年委员会 副主任委员
中国抗癌协会肿瘤支持治疗青年委员会 副主任委员
北京癌症防治学会胃癌专业委员会 副主任委员
中国女医师协会临床肿瘤专业委员会 常委
CSCO胃癌/肝癌/胰腺癌/药物安全委员会 委员
湖北省抗癌协会肿瘤内科治疗专业委员会 副主任委员
湖北省抗癌协会胃癌专业委员会 常委
CSCO胃癌指南执笔成员
奥沙利铂联合氟尿嘧啶新辅助化疗对比直接手术治疗局部进展期结肠癌的随机对照III期临床试验(OPTICAL) 1
新辅助化疗(NAC)在结肠癌中的地位尚不明确。该研究对比了使用mFOLFOX6或卡培他滨联合奥沙利铂(CAPOX)新辅助化疗3个月与直接手术,探索是否能够改善局部晚期结肠癌患者的预后。OPTICAL是一项在局部晚期结肠癌(T3伴肿瘤侵犯肠系膜脂肪≥5 mm或T4)患者中进行的随机III期临床试验。患者按照1:1被随机分为两组,一组患者接受6个周期的mFOLFOX6或4个周期的CAPOX新辅助治疗后进行手术及辅助化疗(NAC组),另一组患者立即进行手术并由医生选择是否接受辅助化疗(直接手术组)。该研究的主要终点是改良意向治疗(mITT)人群的3年无病生存期(DFS)。
该研究于2016年1月至2021年4月期间共计招募752名患者,其中744名患者被纳入mITT分析(NAC组371名;直接手术组373名)。中位随访48.0个月(IQR,46.0-50.1)后, NAC组患者3年DFS率为82.1%,而直接手术组的患者为77.5%(分层HR为0.74 [95% CI,0.54-1.03])(图1)。两组接受手术患者的R0切除率均为98%。NAC组与直接手术组相比,病理完全缓解率(pCR)提高了7%,同时病理分期T3/4的患者比例显著更低(pT3/4:77% vs 94%)、伴淋巴结转移的患者比例显著更低(pN1-2:31% vs 46%),潜在改善了患者总生存(分层HR为0.44 [95% CI,0.25-0.77])。
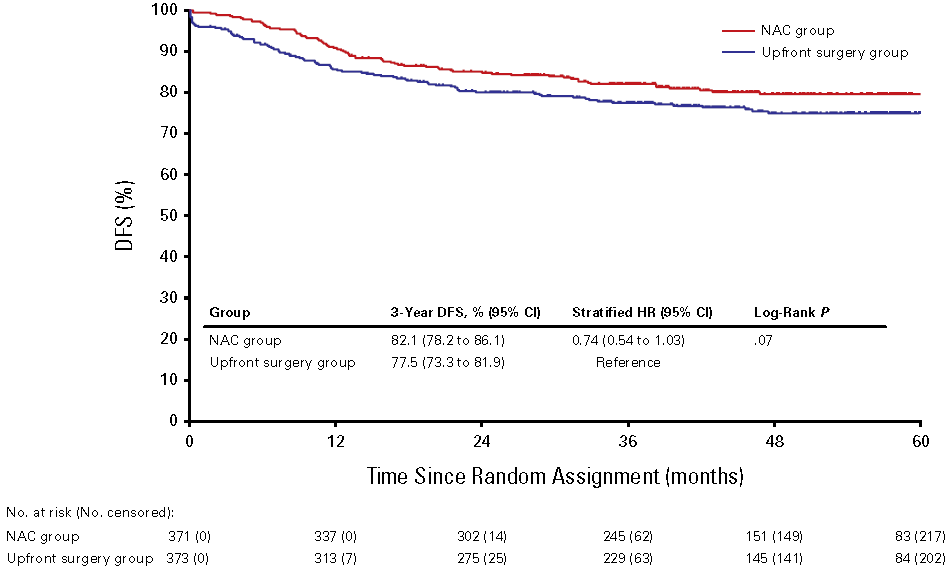
图1:Kaplan-Meier法估计mITT患者接受不同治疗后的DFS
采用mFOLFOX6或CAPOX作为NAC并未显示出显著的DFS获益,但这种术前治疗方式是安全的并可显著降低病理分期,可能成为治疗局部晚期结肠癌的一种可行的治疗选择。(ClinicalTrials.gov注册号:NCT02572141)
邱红教授:OPTICAL是一项多中心、随机对照、Ⅲ期临床研究,是继FOxTROT研究后第二项探索结肠癌围手术期治疗的研究,本研究探索了新辅助治疗在可手术的局部晚期结肠癌中的价值。与FOxTROT研究不同,首先,OPTICAL研究在设计之初就没有考虑靶向药物,单纯针对顺序进行优化,这种设计安全且节约成本和医疗资源。其次,OPTICAL研究的新辅助时长是3个月,而FOxTROT是1.5个月。因此,OPTICAL研究有其独特之处及创新性的发现。在2022年ASCO大会上已报告了其结果,本月研究全文发表于JCO。
本研究共入组752例局部晚期结肠癌患者,1:1随机分配至新辅助治疗(NAC)组或直接手术组,研究主要终点为3年的DFS率,次要终点包括R0切除率、pCR率、OS等。入组患者整体肿瘤负荷较重,75%的患者为cT4,77%的患者为cN1-2。主要终点来看,新辅助治疗组的3年DFS率与直接手术组相比数值上更高,但无统计学差异(P=0.07)。进一步亚组分析显示,女性患者接受NAC相比直接手术显著获益(HR=0.54,95%CI 0.30-0.95);此外,更高的肿瘤负荷(cT4、cN1-2)似乎是新辅助治疗DFS获益的有利预后因素。次要终点而言,NAC组显著降低术后的肿瘤分期(pT3-4:77% vs. 94%,P<0.001)和淋巴结分期(pN1-2:31% vs. 46%,P<.001),且有7%的患者实现了pCR(7% vs. 0%,P<0.001)。此外,NAC组的总生存率(HR=0.44,95% CI 0.25-0.77,P=0.01)和癌症特异性生存率(HR=0. 42,95% CI 0.24-0.76,P=0.005)与直接手术组相比均显著获益。以上结果也提示了术前新辅助对于局部晚期结肠癌患者的价值。
整体而言,尽管mFOLFOX6/CAPOX的新辅助治疗方案没有显示出显著的DFS获益,但这种方案安全性良好,且具有显著的病理学降期和生存获益,是局部晚期结肠癌患者一种可行的治疗选择,为这类患者的临床实践提供了坚实的循证医学证据。
Adagrasib联合西妥昔单抗治疗KRASG12C突变型转移性结直肠癌的疗效和安全性2
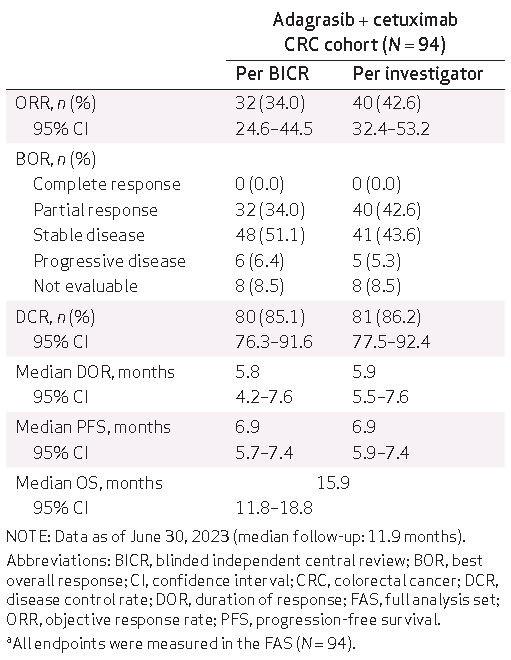
Adagrasib是一种不可逆的选择性KRASG12C抑制剂,特别是与抗EGFR单抗联合使用时对KRASG12C突变的结直肠癌可能是一个有效的治疗手段。KRYSTAL-1研究纳入了94例既往接受过治疗的KRASG12C突变不可切除或转移性结直肠癌患者,接受Adagrasib(600mg,每日两次)联合西妥昔单抗治疗。该研究的主要终点是独立中心审查的客观缓解率(ORR)。中位随访时间为11.9个月,ORR为34.0%,DCR为85.1%,mDOR为5.8个月(95%置信区间[CI],4.2-7.6),mPFS为6.9个月(95% CI,5.7-7.4),mOS为15.9个月(95% CI,11.8-18.8)。所有患者均发生治疗相关不良事件(TRAEs),其中3级或4级TRAEs的发生率为27.7%,未出现5级事件。未出现TRAEs导致的Adagrasib停用。探索性分析显示,通过循环肿瘤DNA可能识别出治疗敏感和获得性耐药的特征。
表1:Adagrasib联合西妥昔单抗治疗KRASG12C突变的既往治疗过的不可切除或转移性结直肠癌患者的总体疗效情况汇总
对于经过多次治疗的不可切除或转移性KRASG12C突变型结直肠癌患者而言,Adagrasib联合西妥昔单抗显示出有前景的临床活性和可接受的安全性。该研究为新的潜在标准疗法提供了支持,并凸显出在结直肠癌患者中检测并确认KRASG12C突变状态的重要性。
邱红教授:结直肠癌患者中携带KRAS突变比例约为40%,其中KRASG12C突变频率为3%~7%。G12C突变指KRAS第12位的甘氨酸突变为半胱氨酸,这种变化会使KRAS蛋白质结构一直处于激活状态,持续刺激细胞生长,促进肿瘤发生发展。统计数据显示KRASG12C突变结肠癌患者生存率明显低于携带KRAS其他突变患者。KRAS基因编码的蛋白是一种无特征、近乎球形的结构,无明显结合位点,也使得KRAS一度成为肿瘤药研发领域“不可成药”靶标的代名词。2013年有研究者发现KRASG12C突变蛋白表面与GTP结合的时候出现一个新的switch Ⅱ结合口袋,针对这个位点出现突变的蛋白存在着半胱氨酸易形成共价键的情况,因此设计出了不可逆的共价小分子抑制剂。
本文报告了KRYSTAL-1研究中KRASG12C抑制剂Adagrasib联合西妥昔单抗治疗KRASG12C突变型mCRC的I期和II期队列的汇总数据。研究共纳入94例既往接受过≥1线治疗的KRASG12C突变mCRC患者,主要终点为ORR。结果显示,BICR评估的ORR为34.0%,DCR为85.1%,中位DOR为5.8个月。中位PFS为6.9个月,中位OS为15.9个月,在重度预治疗的mCRC患者中(中位既往治疗线数为3线)显示出令人鼓舞的临床活性。安全性方面,3-4级TRAE发生率为27.7%,未出现5级TRAE,整体耐受性良好。
目前KRASG12C突变已成为临床关注的热点,已有多项KRASG12C抑制剂相关的研究公布了结果。KRASG12C抑制剂单药的疗效已在多项研究中进行了探索(包括KRYSTAL-1单药队列、CodeBreaK 100、Divarasib的I期研究等),整体而言,KRASG12C抑制剂单药治疗在CRC中的疗效明显低于NSCLC,RTK-RAS-MAPK通路的获得性旁路激活突变是KRAS抑制剂耐药的原因之一,研究显示同时抑制EGFR和KRASG12C显示出协同抗肿瘤活性,联合抗EGFR单抗可能是更优的选择。
Garsorasib联合西妥昔单抗治疗既往经治的KRASG12C突变结直肠癌患者的II期研究结果显示,ORR达45%,mPFS为7.6个月,展现出有潜力的疗效数据。另一项III期Codebreak300研究同样探索KRASG12C抑制剂联合抗EGFR单抗在KRASG12C突变型mCRC中的疗效,结果显示,在≥2线的人群中,与研究者选择的方案相比,两种剂量的Sotorasib(960mg和240mg)联合帕尼单抗均显著延长了mPFS。960mg Sotorasib–帕尼单抗组和240mg Sotorasib–帕尼单抗组的mPFS分别为5.6个月和3.9个月,相比之下,研究者选择组为2.2个月;960mg组、240mg组和研究者选择组的ORR分别为26%、6%和0%,DCR分别为72%、68%和46%,进一步证实了抗EGFR单抗联合KRASG12C抑制剂治疗晚期肠癌患者的临床获益。
基于这些研究证据,抗EGFR单抗+KRASG12C抑制剂目前已被NCCN指南推荐用于治疗KRASG12C突变型mCRC;此外,在今年的CSCO指南更新中也新增了注释:基于药物可及性的考虑,鼓励KRASG12C突变型晚期结直肠癌患者参加KRASG12C抑制剂+/-抗EGFR治疗相关临床研究。随着Sotorasib和Adagrasib的成功,KRASG12C抑制剂研发的热潮上涨,目前已有多个在研KRASG12C抑制剂进入临床研究阶段,包括LY3537982、GFH925、Divarasib(GDC-6036)、Garsorasib(D-1553)等,也期待更多药物的上市惠及更多患者。
在G12C靶点药物的成功突破后,研究者将目光转向其他KRAS突变体。针对G12D、G12V、G13C等其他KRAS突变亚型的药物也已陆续开展,大部分药物尚在临床前阶段,期待其进一步临床数据。对于整体KRAS突变肠癌患者的靶向治疗而言,也许KRASG12C抑制剂的突破仅仅是个开端。
WRN抑制剂HRO761 在MSI肿瘤中具有合成致死性3
多项基因学筛查认定Werner综合征RecQ螺旋酶(WRN)是一个在微卫星不稳定(MSI)型肿瘤细胞中的合成致死性靶点。尽管当前免疫检查点抑制剂的治疗研究取得了进展,但对于MSI型肿瘤的治疗仍有未满足的需求。
该文章报告了处于临床研究阶段的WRN抑制剂HRO761的结构、生化学、细胞学和药理学特性。HRO761是一种强效的特异性变构WRN抑制剂,它通过与D1和D2螺旋酶的结构域结合将WRN锁定在无活性状态(图2)。HRO761的药理学抑制作用与对WRN进行基因敲除后所观察到的表型相似,在MSI型细胞以不依赖p53的方式选择性地引发的DNA损伤和肿瘤细胞生长抑制。此外HRO761虽可诱导MSI型细胞的WRN失活,但在微卫星稳定型细胞中不会发挥此作用。在MSI细胞模型和患者来源的异种移植瘤动物模型中观察到,口服HRO761可诱导剂量依赖性的体内DNA损伤并抑制肿瘤生长。这些发现是对WRN作为MSI型肿瘤治疗靶点的临床前药理学验证。一项评估HRO761(NCT0583868)在MSI型结直肠癌和其他MSI型实体瘤患者中的安全性、耐受性和初步抗肿瘤活性的临床试验正在进行中。
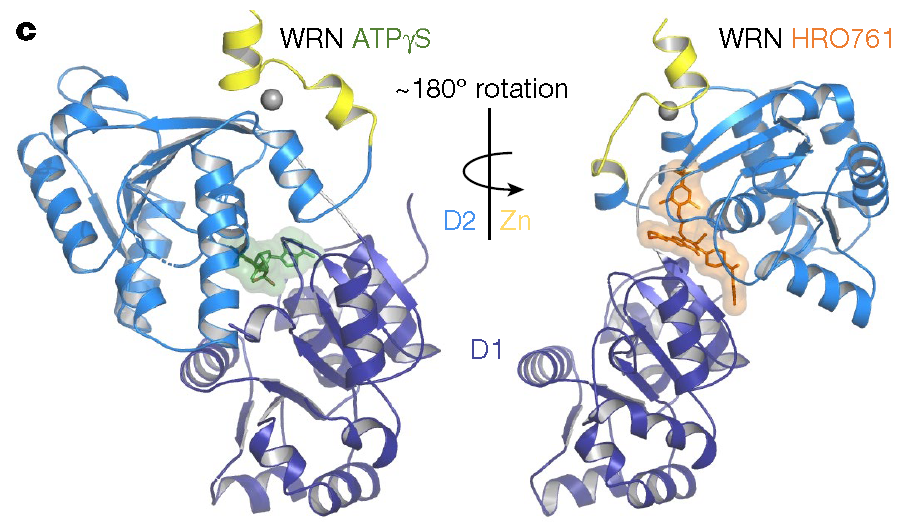
图2:HRO761与WRN螺旋酶结合的示意图
化学蛋白质组学发现WRN螺旋酶的共价变构抑制剂4
WRN解旋酶是治疗具有MSI型肿瘤的一个有前景的靶点,因为它在修复因错配修复机制障碍而累积的有害不规则DNA结构方面发挥着关键作用。目前还没有直接靶向人类DNA或RNA螺旋酶的药物获批,部分原因是研发出针对这类蛋白质的高效且特异性强的化合物具有挑战性。该文章描述了通过化学蛋白质组学驱动探索的一款处于临床阶段的WRN共价变构抑制剂VVD-133214。
这种化合物可选择性地与位于螺旋酶结构域的一个半胱氨酸(C727)结合,该结构域与DNA解旋期间螺旋酶在DNA上的跨域运动相关(图3)。VVD-133214可使WRN蛋白与核苷酸结合并形成稳定紧凑的构象,同时使螺旋酶的移动灵活性丧失,进而导致MSI-H细胞中出现广泛的双链DNA断裂、细胞核膨胀和细胞死亡。在微卫星稳定型细胞中则不会发挥此作用。该化合物在小鼠中具有良好的耐受性,并在多种MSI-H型结直肠癌细胞系和患者来源的异种移植模型中诱导了肿瘤消退。
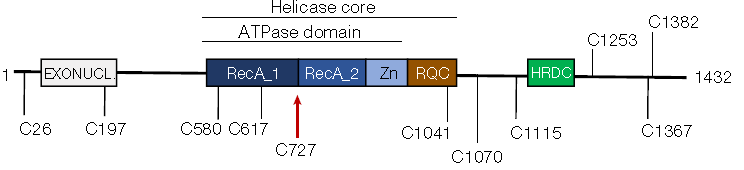
图3:利用化学蛋白质组学筛选共价WRN抑制剂VVD-133214结合的半胱氨酸
该研究展示了一种抑制WRN功能的变构方法,可以避开癌细胞中内源性ATP辅助因子的竞争。VVD-133214有望成为MSI-H型肿瘤患者有前景的备选药物之一。
邱红教授:抗癌药物开发的目标是发现能够消除癌细胞而不伤害患者正常细胞的化学物质。为此,可利用合成致死机制:当两个基因同时失活导致细胞死亡,但任一基因的单独失活都无明显毒性。在发生突变失活的肿瘤中,通过抑制其合成致死配对基因,可选择性杀死肿瘤细胞。
种系或体细胞突变和表观遗传学改变导致的DNA错配修复缺陷(dMMR/MSI-H)在结直肠癌中的发生率约为20%,目前这类患者的标准治疗包括手术、化疗和免疫治疗。以免疫检查点抑制剂PD-(L)1为代表的免疫疗法在MSI-H肠癌患者的治疗中取得了成功,但固有或获得性耐药会降低临床疗效,因此这类疾病仍存在临床未满足的需求。
WRN是DNA解旋酶RecQ家族的五个成员之一,因为它在解决错配修复机制损伤的细胞中积累的有害非经典 DNA 结构方面发挥着重要作用,被认为是MSI肿瘤的一个有前途的靶点。本月Nature在同一天上线了两篇WRN抑制剂相关文章,分别介绍了合成致死性WRN抑制剂(HRO761)、以及WRN共价变构抑制剂(VVD-133214)的临床前开发过程。
体外细胞实验提示HRO761在 MSI细胞系中具有合成致死性,而在MSS细胞系中未观察到该特性。研究人员表征了HRO761处理对MSI细胞系的影响,结果发现,WRN抑制以时间和剂量依赖性方式导致细胞周期阻滞和DNA损伤,此过程不依赖p53状态。后续研究人员也在异种移植物模型(包括细胞来源的CDX模型和患者来源的PDX模型)中探索了HRO761的疗效潜力,结果显示,疾病控制率约为70%,疾病稳定率为35%,部分缓解率为30%,完全缓解率为9%。研究者还额外探索了HRO761联合伊立替康的疗效,结果提示了HRO761和伊立替康联合使用可使肿瘤完全消退,且与伊立替康和HRO761的剂量无关。在另一款WRN抑制剂VVD-133214中观察到了相似的结果,细胞实验提示,VVD-133214可降低了MSI-H 细胞系的生长,但不降低MSS细胞系的生长。异种移植物模型同样如此,研究者在七种不同MSI-H结直肠癌PDX模型中测试了VVD-133214,发现每日口服VVD-133214 20mg kg−1在其中六个模型中成功地降低了肿瘤负担,有趣的是,仅在具有p53突变的模型中观察到了CR。此外,研究者还探索了VVD-133214在手术和FOLFOX治疗后或免疫耐药后患者的PDX模型,同样显示出了对肿瘤生长的抑制,可能提示了WRN抑制剂对标准化疗和免疫检查点抑制剂耐药的患者的治疗潜力。
目前该靶点仍处于早期研发阶段,HRO761率先进入临床研究,一项评估HRO761在MSI型结直肠癌和其他MSI型实体瘤患者中的安全性、耐受性和初步抗肿瘤活性的临床试验正在进行中(NCT0583868),也期待后续其数据的公布,为临床患者提供更多的治疗选择。
ctDNA RAS/BRAF野生型难治性转移性结直肠癌患者的抗EGFR再挑战:一项非随机对照试验5
现有的关于抗EGFR单抗再挑战治疗ctDNA RAS/BRAF wt 难治性mCRC患者有效性的证据主要来自于小型的回顾性和前瞻性研究。该研究是一个非随机对照试验,纳入了4项意大利临床试验(CAVE、VELO、CRICKET和CHRONOS)的患者数据进行汇总分析,这些患者均为ctDNA RAS/BRAF wt mCRC并于2015年至2022年间接受了抗EGFR再挑战治疗(中位随访时间28.1个月),再挑战方案包括西妥昔单抗联合avelumab、TAS-102联合帕尼单抗、伊立替康联合西妥昔单抗或帕尼单抗单药治疗。该研究对总生存期(OS)、无进展生存期(PFS)、总缓解率(ORR)和疾病控制率(DCR)进行了分析并对若干临床变量展开了探索性亚组分析,同时报道了安全性数据。
总体来看,共计114例ctDNA RAS/BRAF野生型mCRC患者(中位年龄61岁,其中57.9%为男性)接受了抗EGFR再挑战(其中48例接受了西妥昔单抗联合avelumab方案,26例接受了TAS-102联合帕尼单抗方案,13例接受了伊立替康联合西妥昔单抗方案,27例接受了帕尼单抗单药治疗方案)。83例患者(72.8%)既往接受过二线治疗,31例患者(27.2%)既往接受过三线及以上治疗。ORR为17.5%(20例),DCR为72.3%(82例)。中位PFS为4个月(95%置信区间[CI],3.2-4.7个月),中位OS为13.1个月(95% CI,9.5-16.7个月)。无肝转移的亚组患者临床预后更优,无肝转移患者的中位PFS为5.7个月,而伴肝转移患者的中位PFS为3.6个月(HR,0.56;95% CI,0.37-0.83;P=0.004)。无肝转移患者的中位OS为17.7个月,而伴肝转移患者的中位OS为11.5个月(HR,0.63;95% CI,0.41-0.97;P=0.04)(图4)。抗EGFR再挑战治疗毒副作用可耐受。
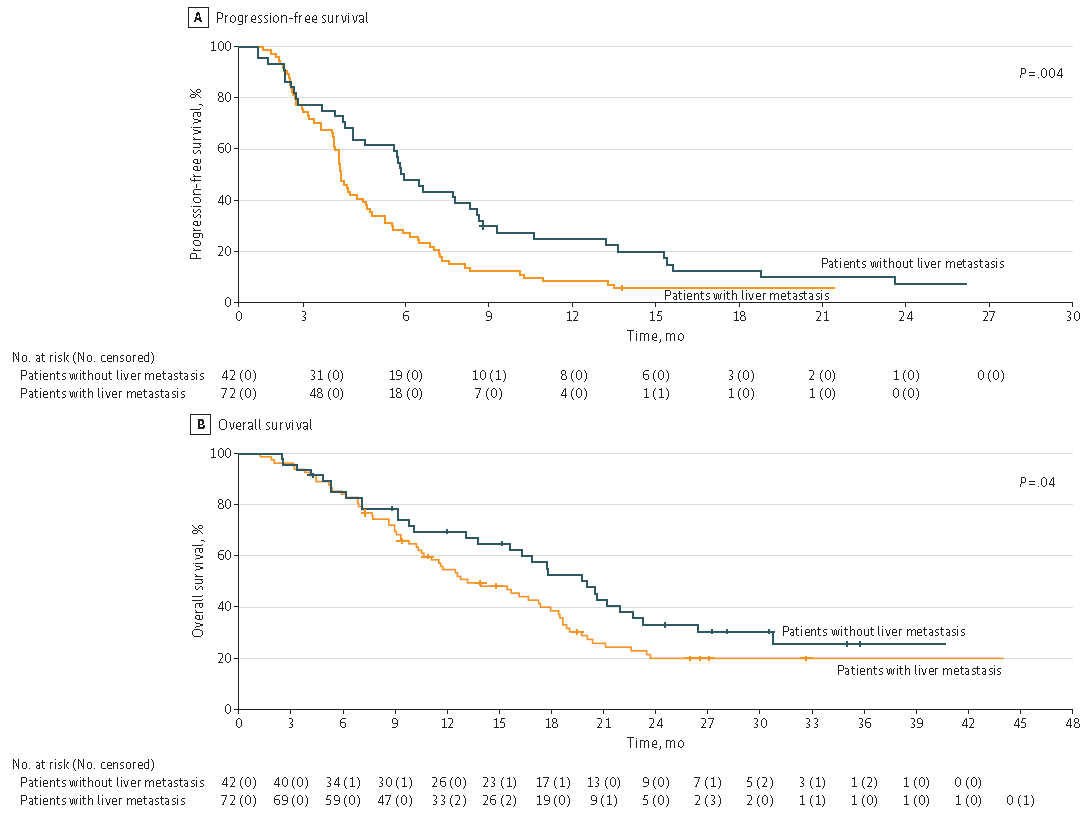
图4:依据肝转移存在情况的KM生存曲线,PFS(A)和OS(B)
该研究的结果表明,抗EGFR再挑战疗法对ctDNA RAS/BRAF野生型难治性mCRC患者而言是有前景的。从有限的亚组分析角度看,无肝转移与生存的改善显著相关。(ClinicalTrials.gov注册号:NCT02296203; NCT04561336; NCT03227926; NCT05468892)
基于奥沙利铂的一线化疗联合纳武利尤单抗治疗微卫星稳定型转移性结直肠癌-随机METIMMOX 试验6
该试验的研究人员对转移性微卫星稳定的结直肠癌患者治疗方案进行了评估,采用以奥沙利铂为基础的短疗程化疗与免疫检查点抑制剂交替使用的一线治疗方案。 患者被随机分配至化疗组(FLOX方案;对照组)或每两周期交替给予FLOX和纳武利尤单抗组(试验组)。每八周进行影像学评估,主要终点为PFS。使用Cox比例风险回归模型估计PFS与相关变量之间的关联。事后分析中探讨了C-反应蛋白作为一种响应信号与免疫检查点抑制剂治疗反应间的关联。
80名患者参与随机分配,最终每组各有38名患者接受了治疗。结果发现两组PFS相当,对照组的中位PFS为9.2个月;试验组的中位PFS为9.2个月(图5)。调整后的Cox模型显示,试验组年龄≥60岁的患者疾病进展风险显著降低(p=0.021),HR为0.17(95% CI,0.04-0.76)。在开始使用纳武利尤单抗治疗时,C-反应蛋白<5.0 mg/L的试验组患者(n=17)的中位PFS为15.8个月(95% CI,7.8-23.7)。试验组病例中有1/6(均为KRAS/BRAF突变型)达到了完全缓解。
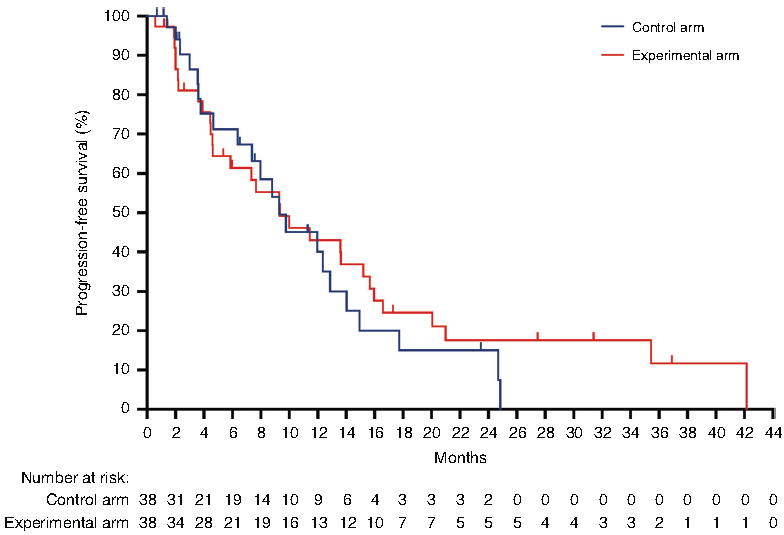
图5:Kaplan-Meier生存曲线显示意向治疗人群的无进展生存情况(76例患者按照治疗方案分组)
该试验方案并未改善意向治疗人群的主要终点,但可能对一小部分既往未接受治疗的转移性微卫星稳定的结直肠癌患者有益。(ClinicalTrials.gov注册号:NCT03388190)
本期看点:
1、随机对照III期研究OPTICAL在局部晚期结肠癌患者中探索了新辅助化疗与直接手术相比对预后的影响,结果显示采用mFOLFOX6或CAPOX作为新辅助化疗并未显示出显著的DFS获益。但这种术前治疗方式是安全的,在提高病理完全缓解率、降低肿瘤分期、改善总生存等方面均有获益,可能是该类患者的潜在治疗选择之一。
2、来自一项大型研究(KRYSTAL-1)的I期和II期队列数据的分析,显示出Adagrasib联合西妥昔单抗在经治的不可切除或转移性KRASG12C突变型mCRC中有前景的临床活性和可接受的安全性,探索性分析提示通过ctDNA可能识别出治疗敏感和获得性耐药的特征。
3、一项新药研究,探索了WRN螺旋酶抑制剂HRO761的结构、生化学、细胞学和药理学特性,该药物通过与D1和D2螺旋酶的结构域结合将WRN锁定在无活性状态,在不依赖p53的情况下选择性地引发MSI型细胞的DNA损伤和肿瘤细胞生长抑制,具备临床开发潜力。
4、一项新药研究,展示了WRN共价变构抑制剂VVD-133214可选择性地与半胱氨酸C727结合,从而使WRN螺旋酶在DNA上无法灵活移动,进而导致MSI-H细胞中出现广泛的双链DNA断裂、细胞核膨胀和细胞死亡。该药物可避开癌细胞中内源性ATP辅助因子的竞争,有望成为MSI-H型肿瘤患者有前景的药物选择之一。
5、一项非随机对照试验,探索了抗EGFR单抗再挑战对ctDNA RAS/BRAF野生型难治性mCRC的有效性,结果显示不同联合方案的抗EGFR 单抗再挑战均显示出良好的抗肿瘤活性,且亚组分析提示无肝转移与生存的改善显著相关。
6、一项随机II期临床研究(METIMMOX),在转移性微卫星稳定的结直肠癌患者中探索了交替使用化疗联合免疫治疗作为一线治疗的疗效,发现在FLOX 基础上联合纳武利尤单抗并未改善ITT 人群的PFS结果,事后分析提示C-反应蛋白作为一种响应信号可能与ICI治疗反应间存在关联。
1、Hu H, Zhang J, Li Y, et al. Neoadjuvant Chemotherapy With Oxaliplatin and Fluoropyrimidine Versus Upfront Surgery for Locally Advanced Colon Cancer: The Randomized, Phase III OPTICAL Trial. J Clin Oncol. Published online April 2, 2024
2、Yaeger R, Uboha NV, Pelster MS, et al. Efficacy and Safety of Adagrasib plus Cetuximab in Patients with KRASG12C-Mutated Metastatic Colorectal Cancer. Cancer Discov. Published online April 8, 2024.
3、Ferretti S, Hamon J, de Kanter R, et al. Discovery of WRN inhibitor HRO761 with synthetic lethality in MSI cancers. Nature. 2024;629(8011):443-449.
4、Baltgalvis KA, Lamb KN, Symons KT, et al. Chemoproteomic discovery of a covalent allosteric inhibitor of WRN helicase. Nature. 2024;629(8011):435-442.
5、Ciardiello D, Martinelli E, Troiani T, et al. Anti-EGFR Rechallenge in Patients With Refractory ctDNA RAS/BRAF wt Metastatic Colorectal Cancer: A Nonrandomized Controlled Trial. JAMA Netw Open. 2024;7(4):e245635. Published 2024 Apr 1.
6、Ree AH, Šaltytė Benth J, Hamre HM, et al. First-line oxaliplatin-based chemotherapy and nivolumab for metastatic microsatellite-stable colorectal cancer-the randomised METIMMOX trial. Br J Cancer. Published online April 25, 2024..
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


