肺癌在全球恶性肿瘤中的发病率和死亡率均居首位,其中非小细胞肺癌(NSCLC)约占全部肺癌的85%[1]。手术是可切除NSCLC患者的主要治疗方式,多项研究证实术前新辅助化疗、术后辅助化疗均较单纯手术可提高患者的总生存期(OS),但化疗有较明显的毒副作用,且疗效或获益提升有限,5年生存率仅提升约5%[2,3]。因此,探寻耐受性良好、可进一步延长患者生存的新辅助治疗和辅助治疗方案是可切除NSCLC患者治疗领域重要研究方向之一。近年来,多项III期临床研究证明,新辅助/辅助免疫治疗相较新辅助化疗在有效性、耐受性和安全性等诸多方面均显示出优势[4]。近日,发表于《JAMA Oncology》杂志(IF: 28.4)的一篇系统综述和荟萃分析证明,新辅助免疫联合化疗相较新辅助化疗可显著改善可切除NSCLC患者的生存期[5]。【肿瘤资讯】现邀天津医科大学总医院徐嵩教授特此点评,梳理目前可切除NSCLC免疫治疗的关键研究以及面临的挑战。
研究介绍
该研究检索了2013年1月1日至2023年10月25日期间,在MEDLINE和Embase数据库中发表的针对可切除肺癌患者新辅助免疫联合化疗、新辅助化疗或这两种治疗方案的单臂研究和随机对照试验(RCT),排除新辅助放化疗、分子靶向治疗和免疫单药的临床研究。未纳入摘要、大会摘要集、回顾性研究、社论、评论、灰色文献和其他不具有研究水平证据的文章。此外,对2023年ASCO、ESMO、ELCC、WCLC和AACR会议的摘要进行了筛选,以了解已发表RCT的最新数据和新RCT的研究结果。提取的数据包括手术、病理和疗效结果以及不良事件。从纳入的RCT研究中提取无事件生存期(EFS)和OS风险比(HRs)及其95% CIs。若可用,再收集按性别、年龄、组织学类型、PD-L1水平、分期和铂类药物类型(卡铂 vs 顺铂)分层的亚组HRs。提取符合纳入标准研究的所有单臂治疗组数据,仅纳入已报告相关结果的研究。该研究关注的结果包括手术(手术切除率和R0切除)、病理(主要病理缓解[MPR]和完全病理缓解[pCR])和疗效(EFS和OS),以及不良事件(手术相关AEs[SRAEs]和治疗相关AEs[TRAEs])。
研究结果
共纳入43项临床研究(N=5431),其中74%的患者为男性,中位年龄范围为55~70岁。有8项RCTs比较了新辅助免疫联合化疗对比化疗的疗效(CheckMate 816、KEYNOTE-671、NADIM II、AEGEAN、Neotorch、CheckMate 77T、TD-FOREKNOW和RATIONALE-315)(表1)。在这8项RCTs中(N=3387),男性占比76.2%,中位年龄范围为61~66岁;有49.8%的患者接受了化疗,50.2%的患者接受了免疫联合化疗;鳞癌占比55.6%;III期患者占比72.1%。
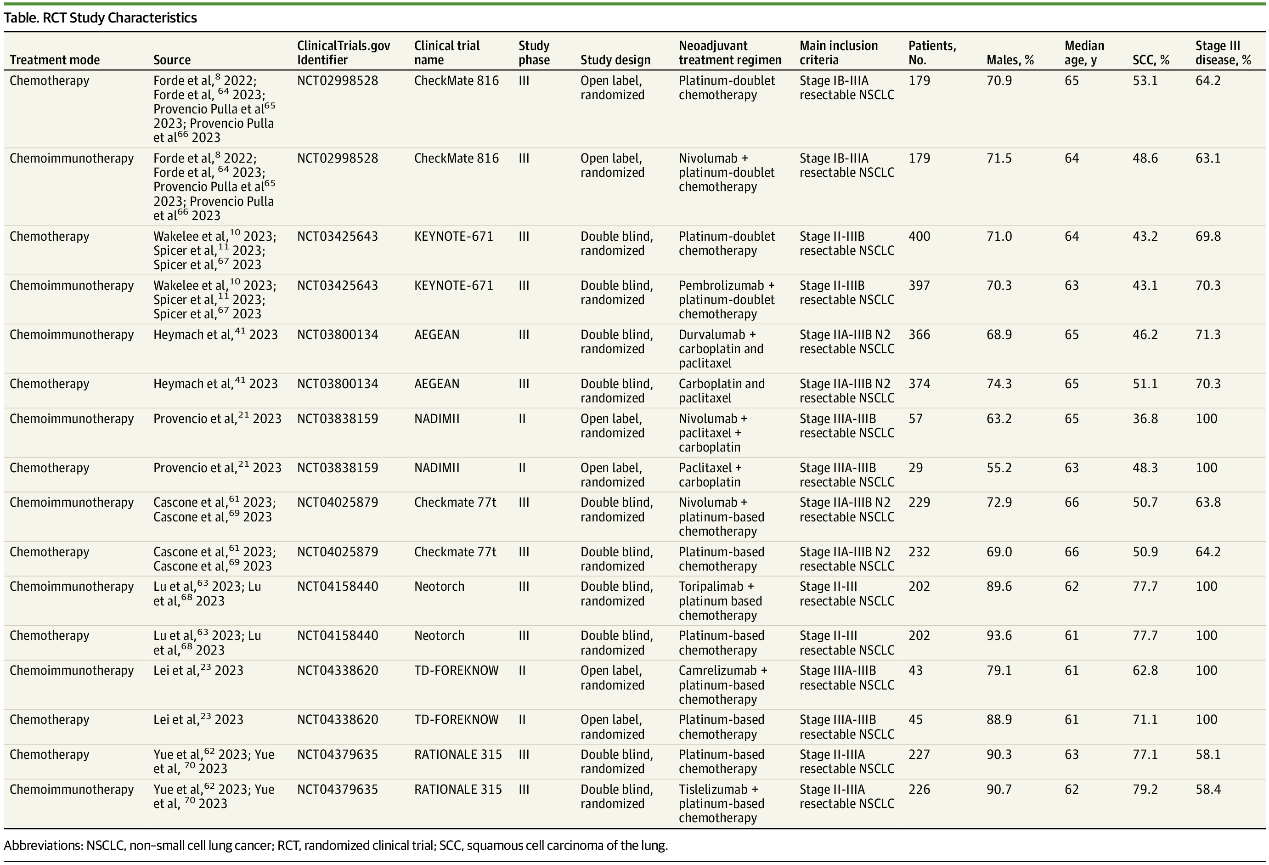
表1 RCT研究的特征
在RCTs中,相较新辅助化疗,新辅助免疫联合化疗的合并OS更优(HR=0.65,I2 = 0%)。在肿瘤PD-L1表达水平≥1%(HR=0.49,I2 = 48.5%)和III期NSCLC(HR=0.67,I2 = 0%)患者中,与接受新辅助化疗相比,接受新辅助免疫联合化疗患者的OS有所改善,但在肿瘤PD-L1表达水平<1%的患者(HR=0.89,I2 = 0%)中,未观察到OS获益(图1)。
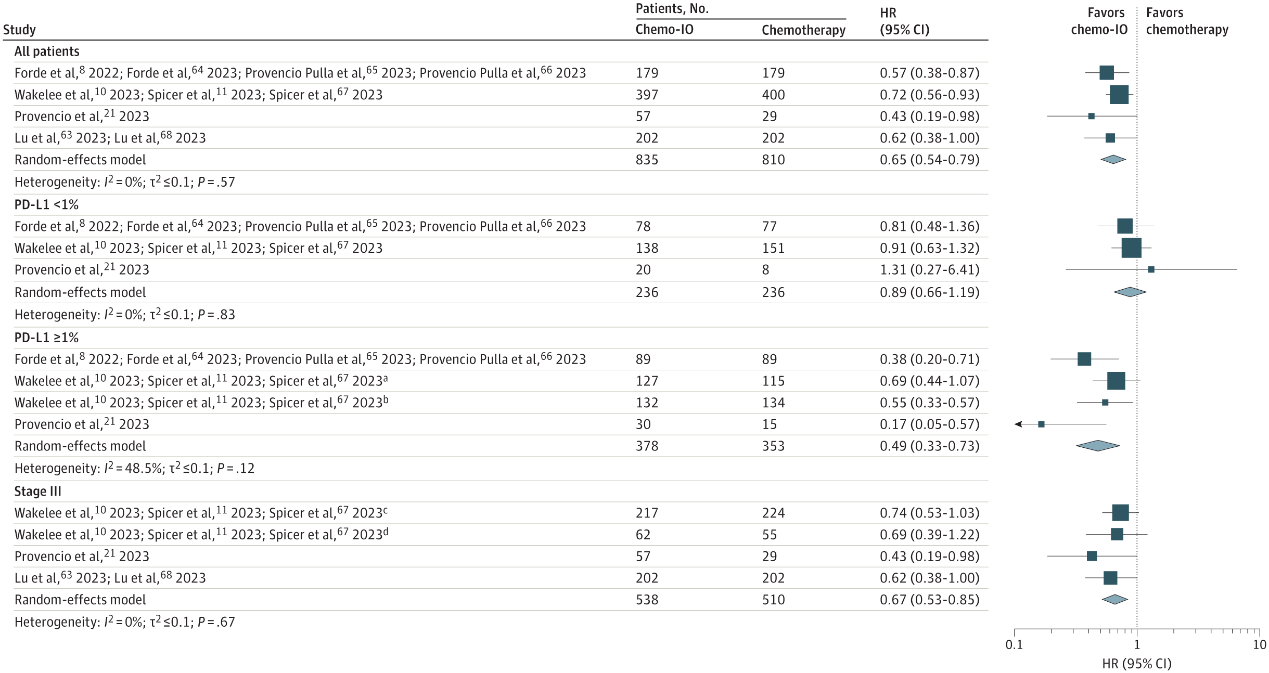 图1 RCTs OS结果的合并HRs
图1 RCTs OS结果的合并HRs
在RCTs所有患者中,接受新辅助免疫联合化疗患者的合并EFS相较新辅助化疗更优(HR=0.59,I2 = 14.9%)。无论是II期还是III期患者,相比新辅助化疗,新辅助免疫联合化疗的EFS均有显著改善。此外,在基线肿瘤PD-L1表达水平<1%的患者中,新辅助免疫联合化疗的EFS较新辅助化疗的EFS同样具有获益;在肿瘤PD-L1表达水平1%-49%和≥50%的患者中,接受新辅助免疫联合化疗较新辅助化疗的EFS均有显著改善(图2)。
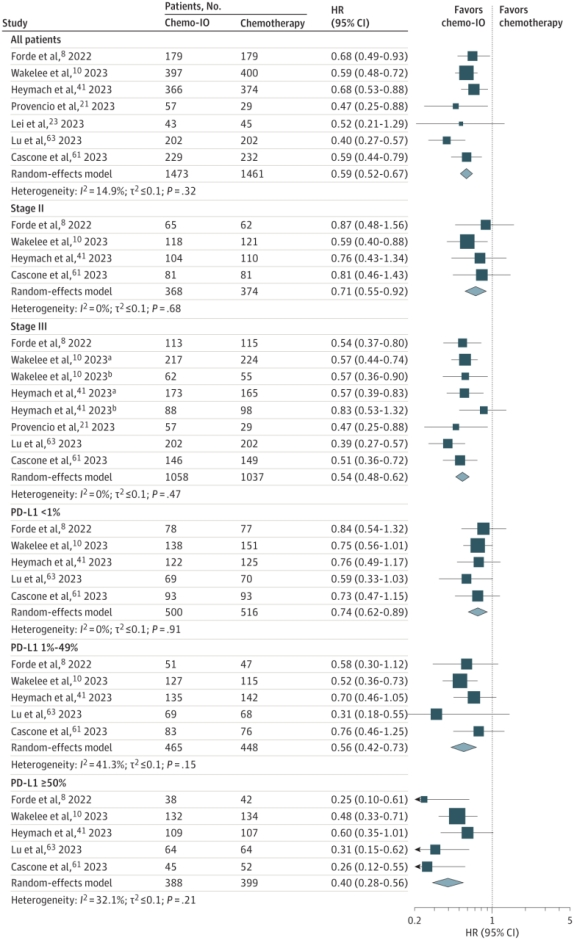 图2 RCTs EFS结果的合并HRs
图2 RCTs EFS结果的合并HRs
亚组分析显示,无论患者年龄、性别、组织学类型和铂类药物类型,相比新辅助化疗,接受新辅助免疫联合化疗患者的EFS结果更优(图3)。
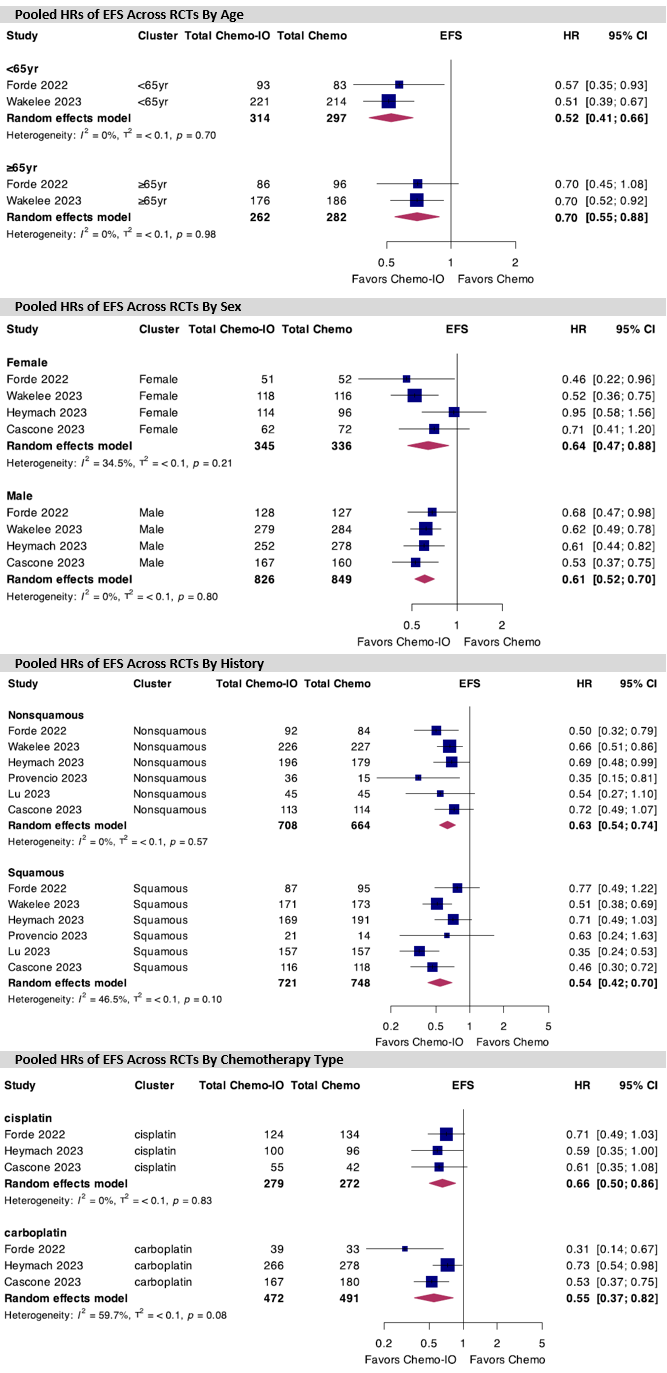 图3 不同年龄、性别、组织学类型和接受的铂类药物类型亚组的EFS合并HRs
图3 不同年龄、性别、组织学类型和接受的铂类药物类型亚组的EFS合并HRs
此外,接受新辅助免疫联合化疗(相比新辅助化疗)欧洲和亚洲患者的EFS结果有所改善,但在北美患者中未观察到EFS改善。
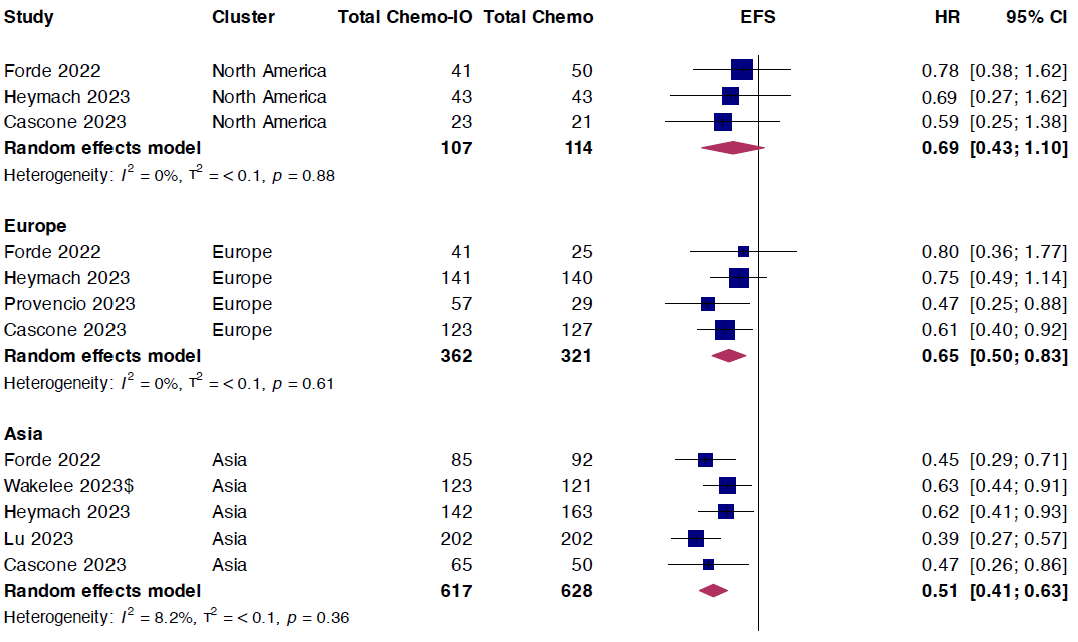 图4 不同地区亚组患者EFS结果的合并HRs
图4 不同地区亚组患者EFS结果的合并HRs
在病理缓解方面,接受新辅助免疫联合化疗患者的MPR率是接受新辅助化疗患者MPR率的3.42倍(RR=3.42,I2 = 31.2%),接受新辅助免疫联合化疗患者的pCR率是接受新辅助化疗患者pCR率的5.52倍(RR=5.52,I2 = 27.4%)(图5)。
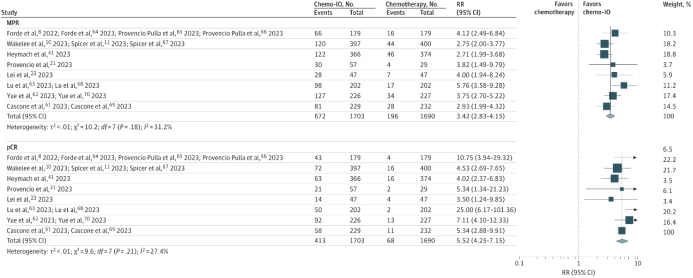 图5 RCTs病理缓解的合并RRs
图5 RCTs病理缓解的合并RRs
此外,相较新辅助化疗,新辅助免疫联合化疗中接受手术切除(RR=1.05,I2 = 31.8%)和R0切除(RR=1.05,I2 = 0%)的概率更高(图6)。同时,在单臂研究中,与新辅助化疗相比,新辅助免疫联合化疗患者的MPR率(43.67% vs16.8%)和pCR率(26.31% vs 6.71%)更高。
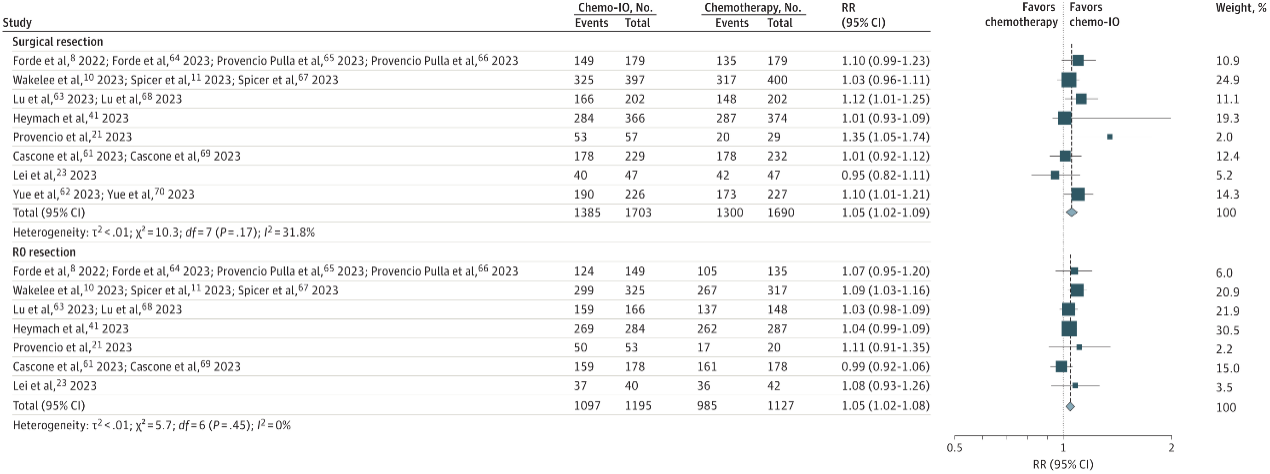 图6 RCTs手术相关的合并RR
图6 RCTs手术相关的合并RR
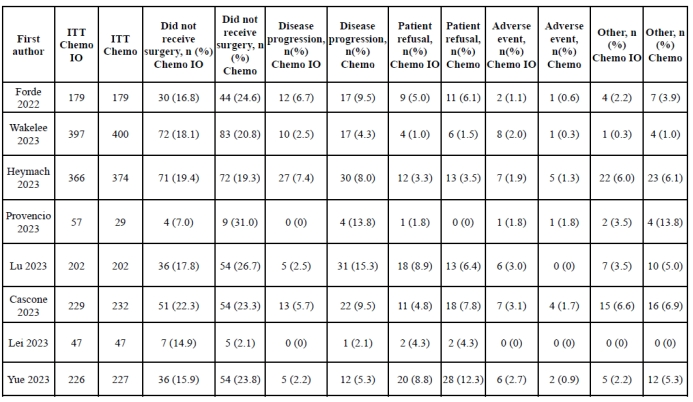
新辅助免疫联合化疗和新辅助化疗在新辅助治疗周期、全肺切除术或双叶切除或手术延迟或开胸手术方面无显著差异。在接受新辅助免疫联合化疗的患者中,未进行手术切除的患者比例为7%~22.3%。在这些患者中,取消手术的原因包括患者拒绝(1%~8.9%)、疾病进展(0%~7.4%)和其他原因(表2)。
表2 拒绝手术的原因
 安全性方面,新辅助免疫联合化疗和新辅助化疗的任意级别TRAEs(RR=1.01,I2 = 30.3%)、3-4级TRAEs(RR=1.08,I2 = 0%)和5级TRAEs(RR=1.66,I2 = 0%)均无显著差异。此外,所有级别SRAEs(RR=1.01,I2 = 0%)、3-4级SRAEs(RR=1.08,I2 = 0%)和5级SRAEs(RR=1.72,I2 = 0%)在两组中也均无显著差异。
安全性方面,新辅助免疫联合化疗和新辅助化疗的任意级别TRAEs(RR=1.01,I2 = 30.3%)、3-4级TRAEs(RR=1.08,I2 = 0%)和5级TRAEs(RR=1.66,I2 = 0%)均无显著差异。此外,所有级别SRAEs(RR=1.01,I2 = 0%)、3-4级SRAEs(RR=1.08,I2 = 0%)和5级SRAEs(RR=1.72,I2 = 0%)在两组中也均无显著差异。
小结
这项荟萃分析发现,与新辅助化疗相比,新辅助免疫联合化疗在疗效(EFS和OS)、病理(MPR和pCR)和手术相关结局方面(手术切除率和R0切除率)均具有显著优势,且新辅助免疫联合化疗未增加治疗相关和手术相关AEs的发生率。此外,无论性别、年龄、组织学类型和PD-L1表达水平,新辅助免疫联合化疗相较新辅助化疗的EFS均更优。未来应进一步评估新辅助免疫联合化疗各亚组的OS获益。此外,未来的研究还可以评估化疗药物或免疫治疗药物类型是否与患者预后相关。
肺部肿瘤外科 教授、硕士研究生导师
比利时布鲁塞尔自由大学,医学博士
Mayo Clinic, MGH, UCM和TGH 临床访问学者
AATS Thoracic Surgery Training Fellowship 获得者
ASCO Virtual Mentoring Program获得者
天津市科学技术进步奖一等奖 、华夏医学科技奖科技技术奖二等奖、中华医学科技奖医学科学技术奖三等奖、中国抗癌协会科技奖三等奖
中国抗癌协会(CACA)青年理事会 理事
中国初级卫生保健基金会肿瘤临床转化研究公益基金管理委员会 副主任委员
中国抗癌协会(CACA)肺癌专业委员会 委员
中国临床肿瘤协会(CSCO)青年委员会 委员
中国老年保健协会肺癌专业委员会 常委、副秘书长
第六届国之名医·青年新锐
美中抗癌协会-亚洲癌症研究基金(USCACA-AFCR)2023学者奖
天津特聘教授 青年学者
天津市高校“中青年骨干创新人才”
天津市卫生计生行业高层次人才“青年医学新锐”
天津市创新人才推进计划 “青年科技优秀人才”
首届CSCO“35位35岁以下最具潜力肿瘤医生”
近年来,围手术期免疫治疗相关临床研究在可切除NSCLC人群中如火如荼的开展中。目前有多项新辅助免疫联合化疗模式、辅助免疫单药模式和新辅助免疫联合化疗及术后辅助免疫治疗模式的III期临床研究陆续取得阳性结果。研究证实,相较新辅助化疗,新辅助免疫联合化疗不仅提高了病理缓解率,还显著延长了患者生存,此项荟萃分析再次验证了这一结果。在8项RCTs汇总分析中,无论年龄、性别、分期、组织学类型和铂类药物类型,接受新辅助联合化疗相较仅新辅助化疗的患者具有显著的EFS获益,与总人群一致;且值得注意的是,在PD-L1阴性人群中也观察到EFS获益。在总人群中,接受新辅助免疫联合化疗相较新辅助化疗患者的OS同样具有显著优势。此外,新辅助免疫联合化疗较新辅助化疗可显著提高患者MPR和pCR,且两种治疗模式在手术延长、TRAEs和SRAEs等方面均无显著差异,结果提示新辅助免疫联合化疗可作为可切除NSCLC患者的标准治疗。
尽管新辅助免疫联合化疗显示出良好的治疗前景,但面对多种治疗模式和多样化治疗方案,基于患者疾病特征制定最优治疗策略是临床实践中亟待解决的难题。首先,对于接受新辅助免疫联合化疗的NSCLC患者,术后是否需要继续免疫辅助治疗是目前最有争议的问题。一项荟萃分析间接对比了新辅助+辅助免疫和仅新辅助免疫在可切除NSCLC中的有效性和安全性。结果显示,在新辅助免疫基础上增加辅助免疫并未带来EFS(HR=0.90,P=0.59)和OS(HR=1.18,P=0.51)改善;且相较新辅助免疫,新辅助+辅助免疫的TRAEs明显升高(RR=1.08,P=0.04)[6]。然而,未来仍需前瞻性、头对头研究进一步对比新辅助免疫+辅助免疫和单纯新辅助免疫在可切除NSCLC的疗效和安全性。
其次,从目前几项RCTs公布的数据来看,PD-L1表达水平指导可切除NSCLC患者的免疫治疗仍存在争议。在本项荟萃分析中,PD-L1阴性患者接受新辅助免疫联合化疗相较新辅助化疗具有显著的EFS获益,但OS获益不显著。另一项荟萃分析探索了不同PD-L1表达水平接受新辅助免疫联合化疗和新辅助化疗的疗效。结果同样提示,新辅助免疫联合化疗相较新辅助化疗可明显提高PD-L1阴性NSCLC患者的病理缓解率和EFS,但未观察到OS获益[7]。因此,未来一方面有待更长随访时间的OS数据分析;另一方面,仍需进一步探索PD-L1表达水平在可切除NSCLC免疫治疗中的预测价值。除此之外,新辅助免疫治疗后的手术时机、治疗期间不良事件的管理,及预测指标、免疫疗效生物标志物、病理评估指标MPR/pCR与生存指标EFS/DFS/OS的相关性等方面都有待探索。
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020;70(1):7-30. doi: 10.3322/caac.21590. Epub 2020 Jan 8. PMID: 31912902.
[2] Pignon JP, Tribodet H, Scagliotti GV, et al. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol. 2008;26(21):3552-3559. doi: 10.1200/JCO.2007.13.9030. Epub 2008 May 27. PMID: 18506026.
[3] NSCLC Meta-analysis Collaborative Group. Preoperative chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual participant data. Lancet. 2014;383(9928):1561-1571. doi: 10.1016/S0140-6736(13)62159-5. Epub 2014 Feb 25. PMID: 24576776.
[4] Houda I, Dickhoff C, Uyl-de Groot CA, et al. Challenges and controversies in resectable non-small cell lung cancer: a clinician's perspective. Lancet Reg Health Eur. 2024 Mar 1;38:100841. doi: 10.1016/j.lanepe.2024.100841. PMID: 38476749.
[5] Sorin M, Prosty C, Ghaleb L, et al. Neoadjuvant Chemoimmunotherapy for NSCLC: A Systematic Review and Meta-Analysis. JAMA Oncol. 2024 Mar 21:e240057. doi: 10.1001/jamaoncol.2024.0057. Epub ahead of print. PMID: 38512301.
[6] Zhou Y, Li A, Yu H, et al. Neoadjuvant-Adjuvant vs Neoadjuvant-Only PD-1 and PD-L1 Inhibitors for Patients With Resectable NSCLC: An Indirect Meta-Analysis. JAMA Netw Open. 2024;7(3):e241285. Published 2024 Mar 4. doi: 10.1001/jamanetworkopen.2024.1285. PMID: 38451524.
[7] Zhang SL, Tian Y, Yu J, et al. Is neoadjuvant immunotherapy necessary in patients with programmed death ligand 1 expression-negative resectable non-small cell lung cancer? A systematic review and meta-analysis. Lung Cancer. Published online April 23, 2024. doi: 10.1016/j.lungcan.2024.107799. Epub ahead of print. PMID: 38669725.
排版编辑:肿瘤资讯-张钰晴











 苏公网安备32059002004080号
苏公网安备32059002004080号


