世界肺癌大会(WCLC)是全球的肿瘤学盛会,亦是每年肺癌诊疗和研究的风向标。随着肿瘤治疗进入免疫治疗时代以来,免疫治疗相关研究就呈现井喷式增长,重磅研究结果亦不断在改变着肺癌的临床诊疗格局。在2022年8月25日所举行的“精彩生存,肺癌双周谈“会议中,河南省肿瘤医院王慧娟教授就分享了“2022WCLC免疫治疗新进展”,【肿瘤资讯】特对分享内容进行整理,以飨读者。
早期可手术NSCLC围手术期治疗:免疫联合治疗已奠定基本格局
王慧娟教授:当前,对于非小细胞肺癌(NSCLC)治疗而言,免疫治疗已经贯穿了整个治疗的全程,从晚期开始逐步进入早期的围手术期治疗。对于早期可手术的NSCLC,首先需要提及的是NADIM II研究结果,该研究是对于ⅢA~B期可手术的NSCLC使用纳武利尤单抗联合化疗进行新辅助治疗的单臂研究,既往的研究结果显示,与单独化疗相比,纳武利尤单抗联合化疗可以显著改善此类患者的病理完全缓解率(pCR)(6.8%vs36.2%),而pCR是NADIM II研究的主要研究终点,这是一个非常令人兴奋的数据。
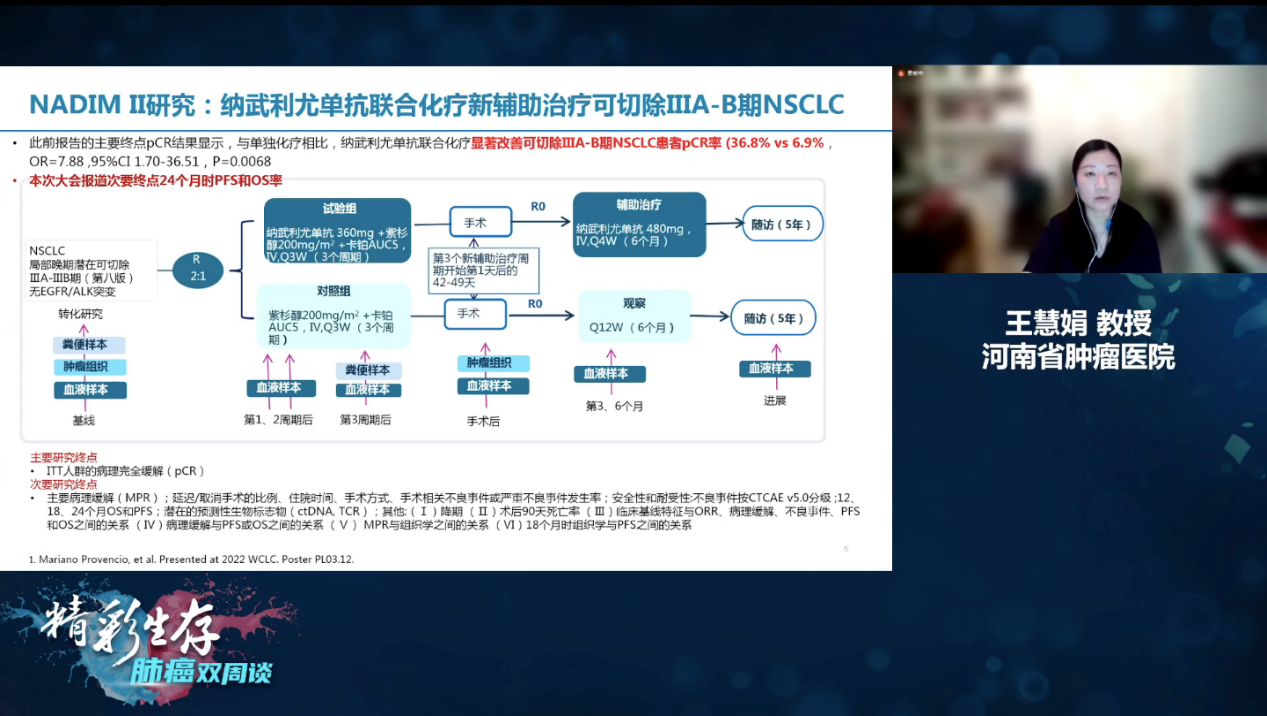 NADIM II研究设计[1]
NADIM II研究设计[1]
在2022年WCLC大会上,报道了该研究的次要研究终点,即是在随访了24个月之后,这些患者的无疾病进展生存(PFS)和总生存(OS)率的情况,结果显示,在次要研究终点中,纳武利尤单抗联合化疗相比单纯化疗亦更具优势,24个月的PFS率达到了67.3%,24个月的OS率达到了85.3%,这些研究数据表明,纳武利尤单抗联合化疗不仅提高了此类患者的pCR,亦可以转化为患者的长期生存获益。为了探寻患者的pCR状态是否能影响治疗获益,研究者进行了进一步的研究发现,达到了pCR的患者,不论是接受了哪种治疗模式,在PFS和OS上的获益都更大,该结果提示我们在进行新辅助治疗临床研究设计时,pCR是一个非常重要的指标。总之,NADIM II研究证实了纳武利尤单抗联合化疗在ⅢA/B期可手术的NSCLC新辅助治疗中的优越性,而且,安全性可耐受,3~4级的毒性亦只是中度增加,NADIM II研究是首个可以改善可切除Ⅲ期NSCLC患者OS的以新辅助免疫治疗为基础的联合治疗临床研究[1]
 NADIM II研究次要终点PFS和OS[1]
NADIM II研究次要终点PFS和OS[1]
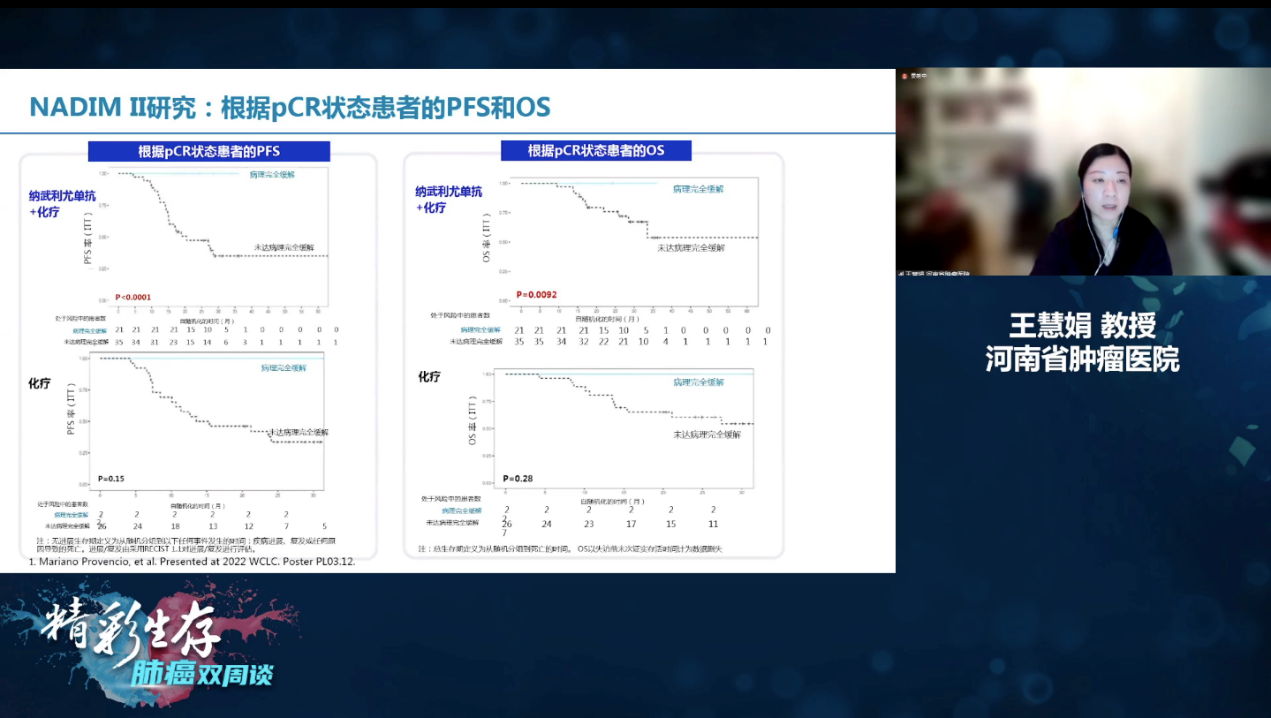 NADIM II研究根据pCR状态患者的PFS和OS[1]
NADIM II研究根据pCR状态患者的PFS和OS[1]
在围手术期治疗阶段,除了新辅助治疗,那就是术后辅助治疗。IMpower010研究是对于接受过含铂治疗方案的可切除的ⅠB~Ⅲ期的NSCLC患者予阿替利珠单抗术后辅助治疗1年对比最佳支持治疗的临床研究。在进行研究终点计算时是以PD-L1≥1%的Ⅱ~ⅢA期患者的无疾病生存(DFS)作为首个统计的终点,如果呈现阳性结果,则去计算所有随机化的DFS,若再为阳性,则去计算人群的DFS,最后再观察患者的OS。当前,该研究已经报道了前期的研究数据,结果显示在随访了32个月时,在PD-L1≥1%的人群中,DFS呈现明显的获益,而在所有随机的Ⅱ~ⅢA期患者人群中,DFS亦观察到了获益,与此同时,在当时的随访时间之下,阿替利珠单抗的术后辅助治疗也能够给整个治疗意向人群(ITT)带来明显获益,只是彼时的OS尚不成熟[2]。
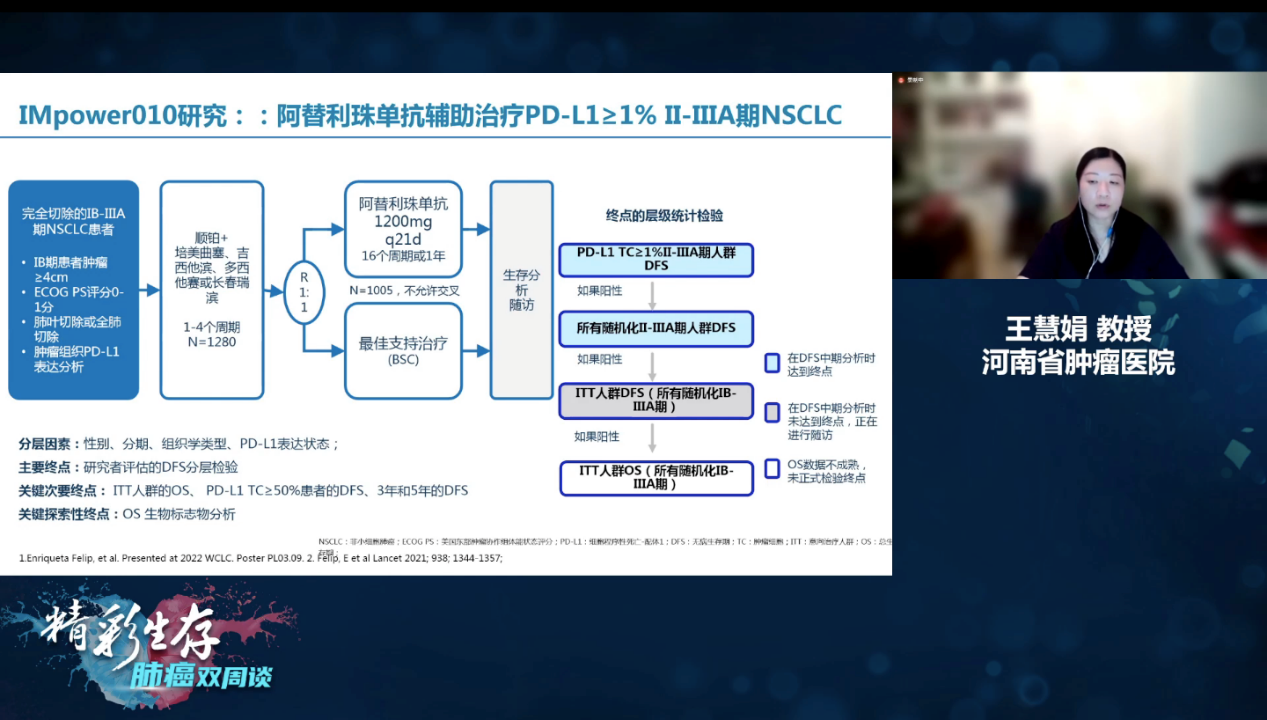
IMpower010研究设计[2]
在2022年WCLC大会上,报道了预定的中期OS分析,研究结果显示在随访了46个月之后,阿替利珠单抗治疗组和单纯对照组患者的5年OS率分别是76.8%和67.5%,观察到了生存获益的趋势,只是由于随访时间尚不够,该数据也不是特别成熟,此外,总体的安全性和既往研究结果一致,未观察到新的安全性信号[2]。
研究者对于IMpower010研究中,PD-L1表达状态以及EGFR状态对于疗效影响的分析发现,对于PD-L1≥50%的患者,从术后免疫辅助治疗中获益最大,也就是说此类患者是术后免疫辅助治疗的优势人群。未来IMpower010研究将继续进行最终的DFS和进一步的OS随访和分析[2]。
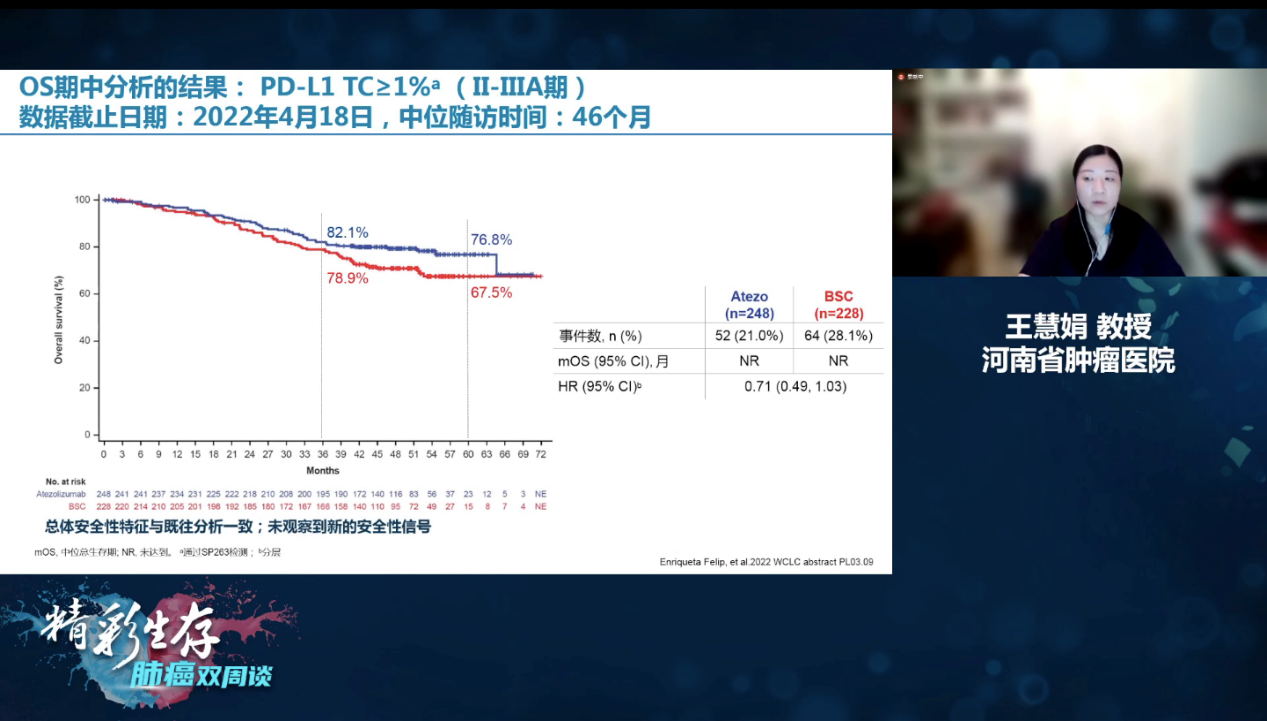 IMpower010研究OS中期分析结果[2]
IMpower010研究OS中期分析结果[2]
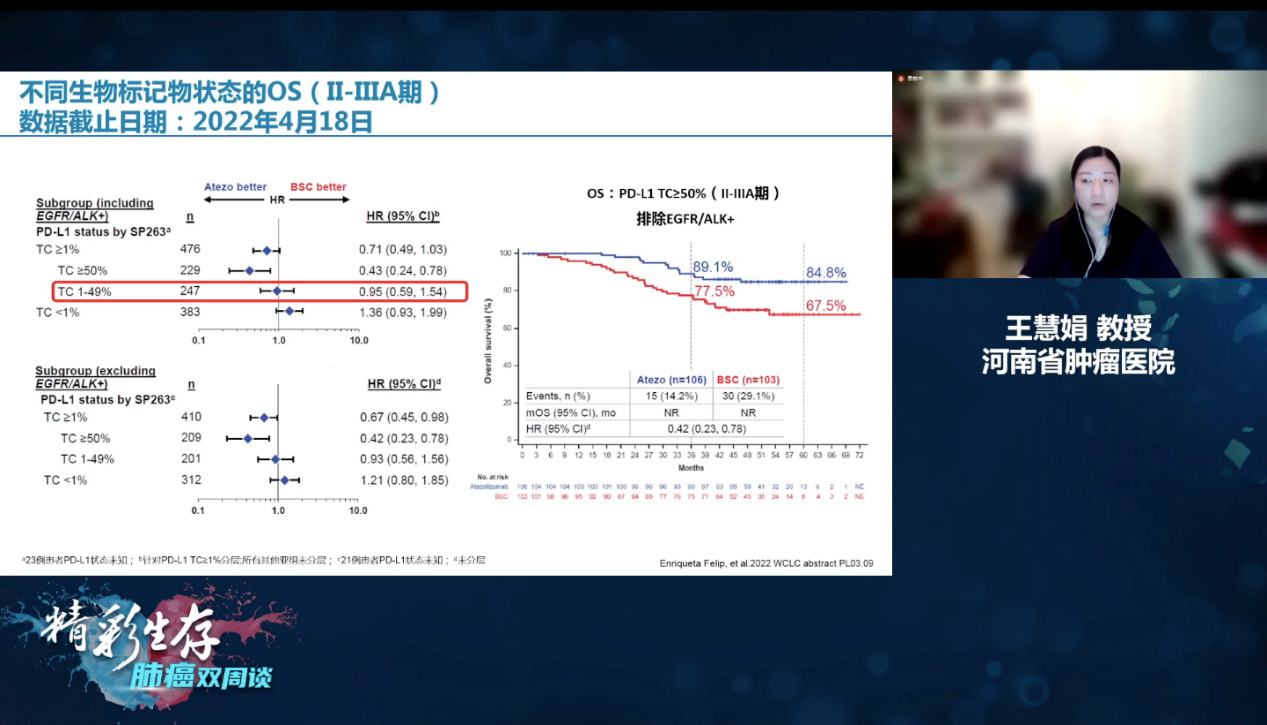 IMpower010研究不同生物标志物状态的OS[2]
IMpower010研究不同生物标志物状态的OS[2]
局部晚期不可切除NSCLC:免疫治疗奠定放化疗后巩固治疗地位,免疫治疗模式得以扩展
王慧娟教授:众所周知,PACIFIC研究是首个同步放化疗后患者进行巩固治疗的Ⅲ期研究,改变了Ⅲ期NSCLC患者的诊疗模式,研究结果两次登上了《新英格兰》杂志,凸显了该研究的影响力。GEMSTONE-301研究是唯一一个纳入100%中国Ⅲ期不可切除NSCLC的研究,所有入组患者按照2:1进行随机分组接受PD-L1单抗或安慰剂进行巩固治疗,主要研究终点是盲态独立评审委员会(BICR)评估的PFS[3]。
 GEMSTONE-301研究设计[3]
GEMSTONE-301研究设计[3]
研究结果显示BICR评估的PD-L1单抗的中位PFS为10.5个月,而安慰剂组仅为6.2个月,两者俱有显著的统计学差异,在中位随访时间超过2年之后,PD-L1单抗组患者2年和3年PFS率都更具优势。在不同的放化疗模式之下,序贯放化疗组和同步放化疗组患者使用PD-L1单抗巩固治疗之后,PFS都更高(序贯+PD-L1单抗vs序贯+安慰剂的PFS: 8.1个月vs4.1个月,同步+PD-L1单抗vs同步+安慰剂的PFS:15.7个月vs8.3个月),从数据而言,不论哪种放化疗模式,PD-L1单抗都能带来额外的PFS获益,不过接受同步放化疗的患者获益更大,这提醒我们对于不可手术Ⅲ期患者在身体条件合适的情况下,尽可能的接受同步放化疗[3]。
目前,GEMSTONE-301研究中PD-L1单抗组的中位OS尚未达到,而安慰剂组为25.9个月。在安全性评估中,随着随访时间的延长,亦没有看到额外不良反应的报道,提示PD-L1单抗巩固治疗具有非常可靠的安全性[3]。
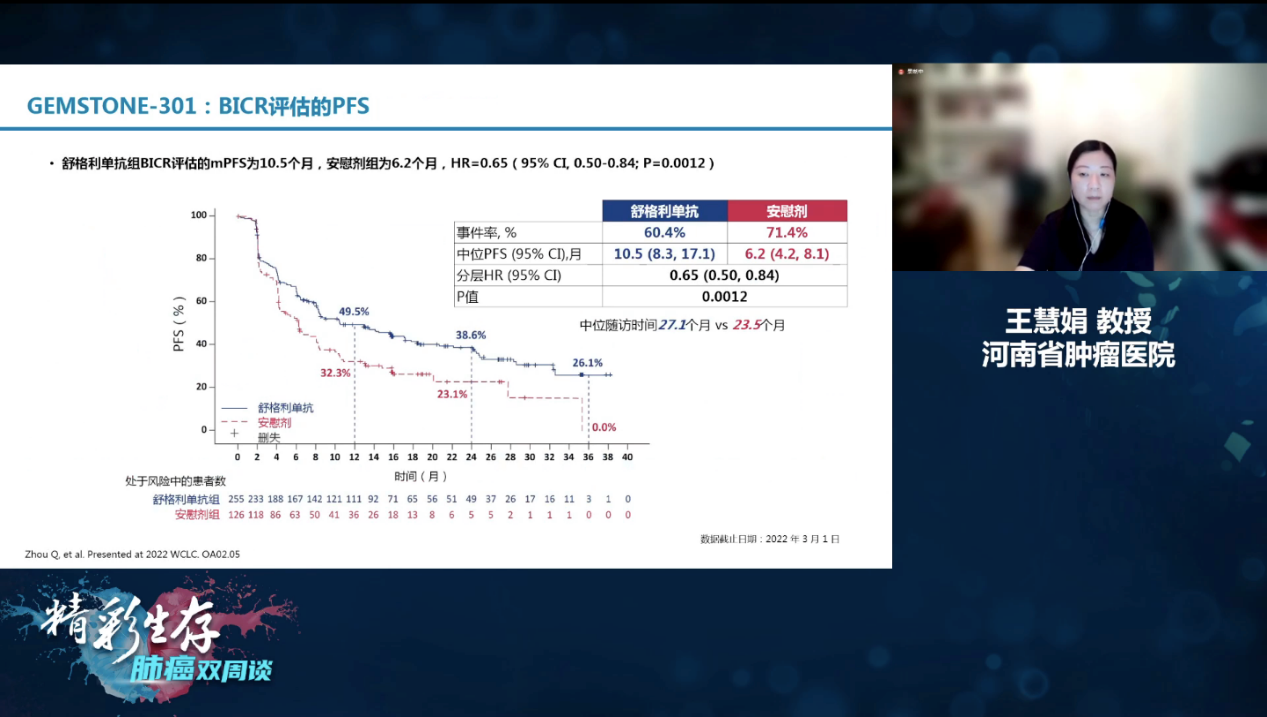 GEMSTONE-301研究BICR评估的PFS[3]
GEMSTONE-301研究BICR评估的PFS[3]
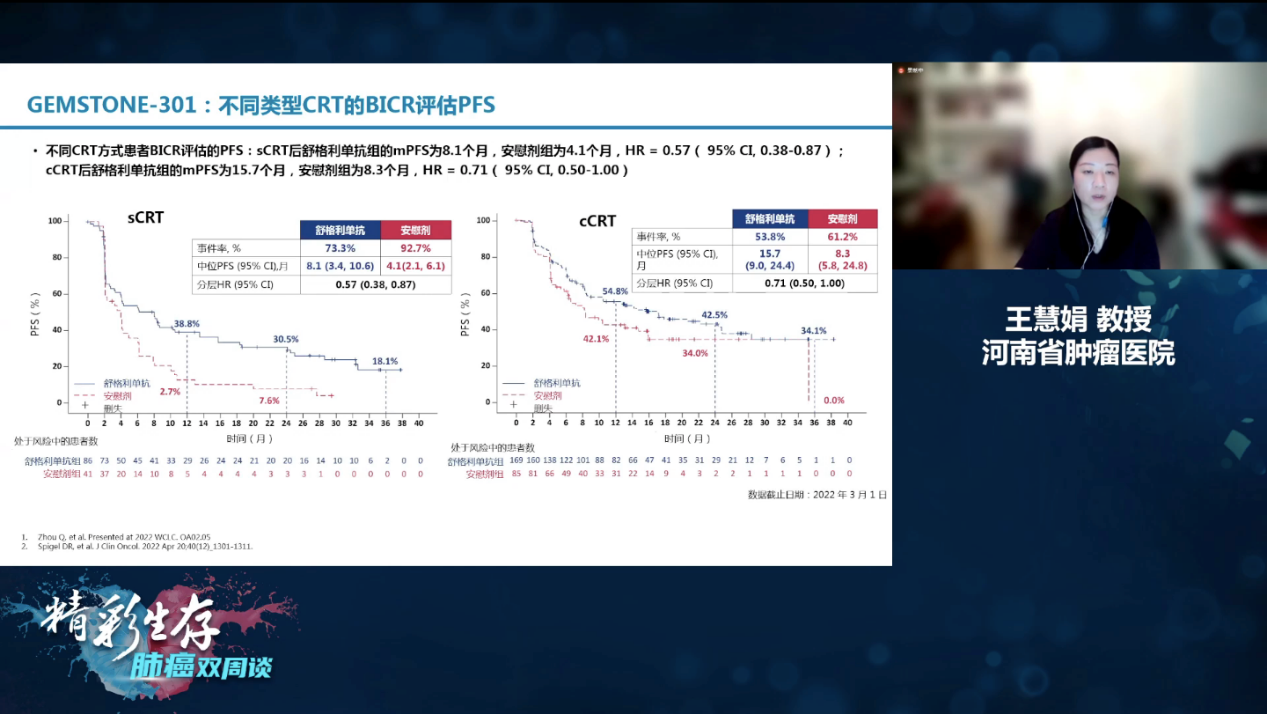 GEMSTONE-301研究不同类型BICR评估的PFS[3]
GEMSTONE-301研究不同类型BICR评估的PFS[3]
总之,GEMSTONE-301研究结果不仅证实了PD-1单抗作为放化疗后巩固治疗的有效性,而且,研究同时纳入了接受同步放化疗和序贯放化疗的患者,最终结果提示序贯放化疗的患者也能够从免疫巩固治疗中得到非常好的获益,这些研究结果使得该研究亦被发表于2022年的《柳叶刀-肿瘤》上,供全球研究者借鉴[3]。
在2022年美国临床肿瘤学会(ASCO)大会上所报道的一个多中心的单臂研究-DOLPHINE研究,亦是一个非常有意思的研究。DOLPHINE研究采取了放疗和度伐利尤单抗同步治疗的方式进行研究,既往诸多研究所纳入的患者都是要求在前期接受过同步/序贯放化疗之后,未出现进展的患者,但是,在临床上约有25%的患者亦会因为进展或其他的原因,导致其不能接受该种免疫治疗。为了探寻免疫联合放疗的安全性,研究者开展了DOLPHINE研究,该研究纳入的患者是不可切除的Ⅲ期或者术后复发的NSCLC患者,体力状态(PS)评分为0或1分。随后,根据此类患者能否进行根治治疗,将患者纳入第二次筛选,即要求患者的PD-L1≥1%,随后再进入放疗+纳武利尤单抗的治疗阶段。主要研究终点是12个月的PFS率[4]。
 DOLPHINE研究设计[4]
DOLPHINE研究设计[4]
研究数据显示,在中位随访时间达到18.7个月之后,BICR评估的12个月的PFS率已经超过了我们的预期,达到了72.1%,客观缓解率(ORR)达到了90.9%,疾病控制率(DCR)达到了100%,数据令人惊艳。安全性分析数据显示,3~4级不良反应的发生率为47.1%,但是,因不良反应导致度伐利尤单抗停药的比例达到了17.6%,不过,停止放疗的比例为0%,此外,任何级别的治疗相关不良反应的发生率为88.2%。该研究结果提示,未来在放疗的同时或许可以选择PS评分较高、一般情况较好的患者,同步给予免疫治疗[4]。
 DOLPHINE研究结果[4]
DOLPHINE研究结果[4]
晚期NSCLC:在优势人群中选择合适的联合治疗手段
王慧娟教授:在晚期NSCLC之中,免疫治疗研究亦颇具亮点。第一个是POSEIDON研究,该研究显示,四药联合相比单纯化疗可以给晚期NSCLC带来OS和PFS获益,但是,度伐利尤单抗联合化疗,在PFS和OS都未观察到显著的获益趋势。POSEIDON研究再一次证实了不同PD-L1表达状态之下,四药和三药组合整体的PFS获益相当,而且,相比化疗可以带来显著获益,但是,在PD-L1<1%的人群中,四药相比度伐利尤单抗联合化疗更具优势。在OS获益上,亦显示对于PD-L1≥1%的人群中,不论是四药联合抑或是度伐利尤单抗联合化疗,都能观察到OS获益,但是,在PD-L1<1%的人群中,只有度伐利尤单抗联合化疗显示出能给患者带来获益[5]。
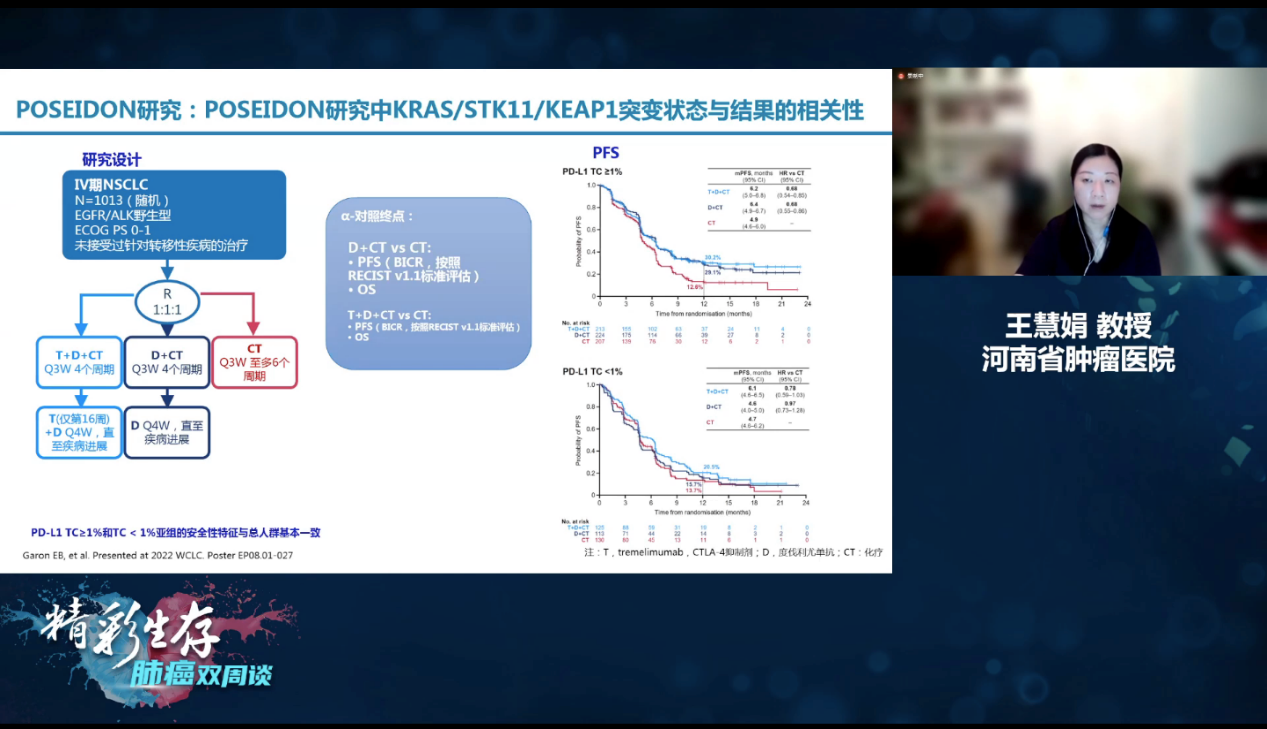 POSEIDON研究设计[5]
POSEIDON研究设计[5]
在2022年WCLC大会上,研究者对于KRAS/STK11/KEAP1突变状态与非鳞状NSCLC患者OS的关系进行报告,在总体人群中,STK11、KEAP1的突变概率分别为30%和60%,但是,不论哪一种突变,使用四药联合都更具优势,这提示我们具有这些突变的患者,可能并不适合免疫联合治疗[6]
 POSEIDON研究KRAS/STK11/KEAP1突变状态与非鳞状NSCLC患者OS的关系[6]
POSEIDON研究KRAS/STK11/KEAP1突变状态与非鳞状NSCLC患者OS的关系[6]
SAFFRON-103研究是在PD-L1阳性、局部晚期或转移性鳞状NSCLC之中,使用替雷利珠单抗联合Sitravatinib一线治疗的开放标签、非随机Ⅰb期研究,Sitravatinib是一种选择性的酪氨酸激酶抑制剂,可能有助于减少髓源性抑制细胞和调节性T细胞的数量,促进抗肿瘤细胞毒性T细胞的扩增,增加M1/M2极化巨噬细胞的比例。在SAFFRON-103研究的鳞癌亚组中,纳入的患者都是PD-L1≥1%,驱动基因为阴性的患者,PS评分<1。研究结果显示在纳入的24例患者中,使用替雷利珠单抗联合Sitravatinib治疗的有效率达到了30.4%,疾病控制率达到了78.3%,而在安全性评估之中,≥3级的不良反应主要是高血压,比例达到了16.7%,其他不良反应发生率较低。整体的PFS达到了5.4个月,中位OS尚未达到。该研究结果显示在PD-L1≥1%的晚期或转移性鳞癌患者中,替雷利珠单抗联合Sitravatinib治疗,不仅具有较好的抗肿瘤活性,而且,治疗安全,患者可耐受。目前正在继续招募患者,以进一步评估该方案有效性[7]。
 SAFFRON-103研究设计和鳞癌亚组结果[7]
SAFFRON-103研究设计和鳞癌亚组结果[7]
此外,在该研究的非鳞癌亚组中,患者所取得的疗效优于鳞癌亚组的患者,在PD-L1≥1%,同时驱动基因阴性的非鳞癌亚组患者中,替雷利珠单抗联合Sitravatinib治疗的有效率达到了57.1%,中位PFS时间达到了11.1个月,因此,该联合治疗模式对于非鳞癌患者可能具有更好的疗效。当前该研究的Ⅲ期研究患者正在招募中,希望早日看到最终研究结果[8]
 SAFFRON-103研究设计和非鳞癌亚组结果[8]
SAFFRON-103研究设计和非鳞癌亚组结果[8]
此外,RATIONALE 303研究在2022年WCLC大会上汇报了最终的OS结果。RATIONALE 303研究是一个国际多中心、随机、开放的Ⅲ期临床研究。在该研究中,最终分析结果显示在ITT人群中,替雷利珠单抗治疗组和多西他赛治疗组的中位OS分别达到了16.9个月和11.9个月。在此类患者的二线治疗中从未有如此优异的OS数据,这提示我们NOTCH1-4突变对于替雷利珠单抗治疗后的OS和PSF获益具有较高的相关性,未来或许可以依据该突变寻找到更好的优势人群[9]
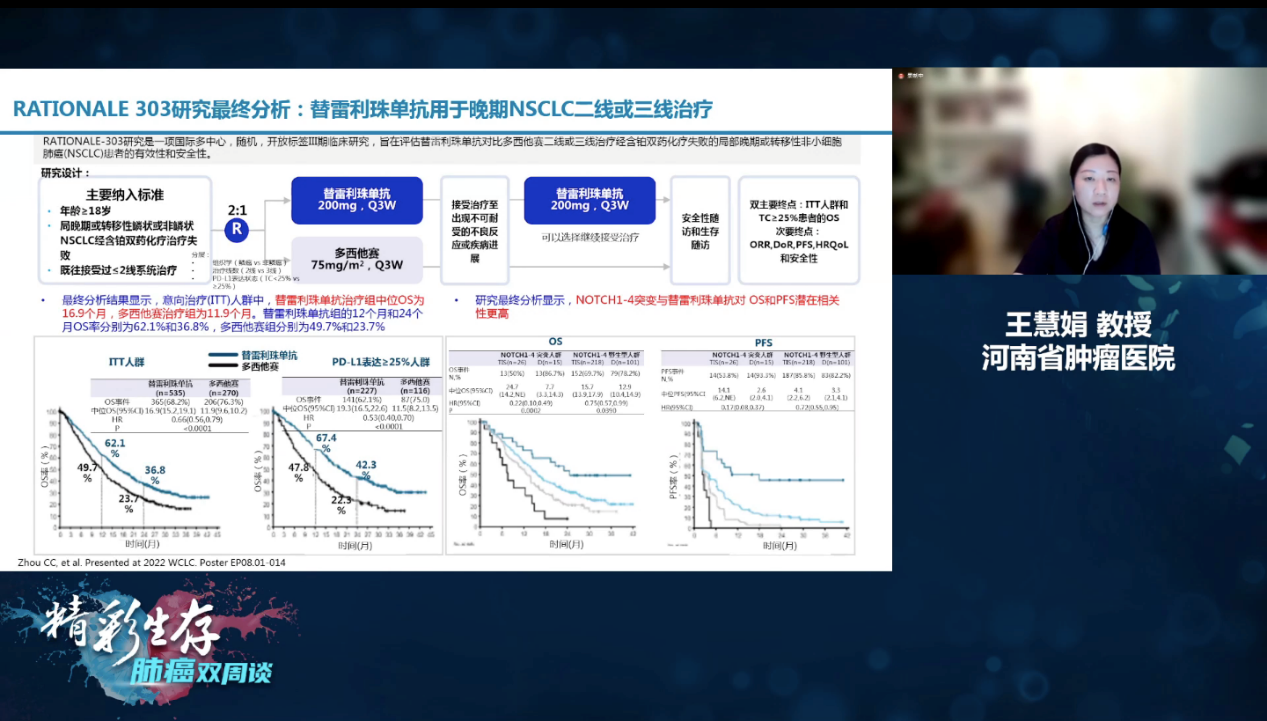 RATIONALE 303研究设计和结果[9]
RATIONALE 303研究设计和结果[9]
最后一项研究是帕博利珠单抗联合或不联合化疗一线治疗35个周期后疾病进展的晚期或转移性NSCLC患者,再次应用帕博利珠单抗治疗的汇总分析。该研究将既往接受帕博利珠单抗和帕博利珠单抗+化疗的患者分为两个队列,在这些患者接受35个周期治疗达到了停药标准之后纳入研究分析。队列1(一线帕博利珠单抗单药组)为57例患者,这些患者的ORR达到19.0%,DCR为72.4%,中位OS达到了27.5个月,6个月的OS高达85.4%,中位PFS达到了8.2个月,疗效令人满意。队列2(帕博利珠单抗联合化疗组)为14例患者,这些患者在二线接受帕博利珠单抗单药治疗的ORR仅为6.3,但是,DCR达到了50%,而且,这些患者的中位OS尚未达到,中位PFS为7.7个月。这些数据结果提示在一线治疗使用帕博利珠单抗联合化疗达到35个周期且疾病进展之后,再次使用帕博利珠单抗亦是一个可选择的治疗方案。当然,未来,仍然需要在临床上对于这些数据进行统计。至于未来这些患者在二线使用帕博利珠单抗达到2年之后,应该选择何种治疗策略,仍然需要进一步研究[10]。
 帕博利珠单抗汇总分析研究[10]
帕博利珠单抗汇总分析研究[10]

1. Mariano Provencio, et al. Presented at 2022 WCLC. Poster PL03.12.
2. Enriqueta Felip, et al. Presented at 2022 WCLC. Poster PL03.09.
3. Zhou Q, et al. Presented at 2022 WCLC. OA02.05.
4. Matoko Tachihara, et al. Presented at 2022 WCLC. Poster MA06.04.
5. Garon EB, et al. Presented at 2022 WCLC. Poster EP08.01-027.
6. Peters S, et al. Presented at 2022 WCLC. OA15.04.
7. Zhao J, et al. Presented at 2022 WCLC. EP08.01-070.
8. Zhao J, et al. Presented at 2022 WCLC EP08.01-071.
9. Zhou CC, et al. Presented at 2022 WCLC. Poster EP08.01-014.
10. Rodriguez-Abreu D, et al. Presented at 2022 WCLC. OA15.06.

择捷美说明书
仅供医疗卫生专业人士阅读/参考
审批号:PP-CEJ-CHN-0769











 苏公网安备32059002004080号
苏公网安备32059002004080号


