随着分子诊断技术的进步,可测残留病变(MRD)检测已成为肿瘤治疗后评估疾病状态的重要工具。然而,对于利用MRD检测来预测肿瘤复发风险及指导后续治疗方案的准确性和有效性,仍需进行深入的评估。
中国医学科学院血液病医院(中国医学科学院血液学研究所)陈俊仁教授团队近日于Leukemia杂志发表了一篇观点性文章,旨在回顾MRD检测的基本原理,并分析MRD检测在血液系统肿瘤及实体肿瘤中的研究进展。

MRD检测预测肿瘤复发的准确性
MRD检测阳性与肿瘤复发累积发生率(CIR)之间往往存在相关性。然而,既往报告的数值并不高。例如,在慢性髓性白血病(CML)中,MRD检测阳性可预测42%~74%的细胞遗传学或血液学复发CIR,而在急性淋巴细胞白血病(ALL)和急性髓性白血病(AML)中,阳性预测值(PPV)<60%。因此,为了评估当前MRD检测的PPV和阴性预测值(NPV),研究人员通过特定搜索词在高影响因子医学期刊上检索了2013年至2023年期间发表的1510篇MRD相关论文。在这些文献中,共筛选出95篇研究,包括82篇血液肿瘤和13篇实体肿瘤研究。值得注意的是,MRD阳性往往与复发有绝对相关性。
在79项研究中,研究人员计算了MRD检测阳性与阴性患者在接受相同治疗后的肿瘤复发/再发累积CIR比值(OR)。研究队列的中位样本量为血液肿瘤147例,实体瘤77例。AML和ALL是血液肿瘤中研究最多的类型,分别有38例和23例研究;而结直肠癌和乳腺癌是实体肿瘤中最常见的,分别有5例和4例研究。在血液肿瘤研究中,最常见的MRD检测时间点是诱导治疗后(33例)和移植前(24例)。相比之下,实体瘤的MRD检测通常在切除术后进行(8例)。血液肿瘤的MRD检测主要采用多参数流式细胞术(MPFC)和聚合酶链反应(PCR),分别有31例和24例研究使用;而实体肿瘤中,新一代测序(NGS)是最常用的MRD检测方法,共10例研究采用。
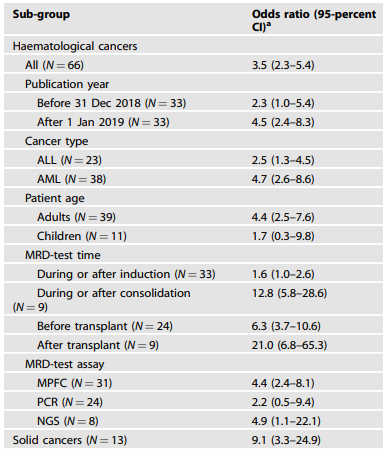
并非所有研究都报告了CIR、PPV或NPV的估计标准误差。基于队列规模N与OR的对数标准误差成反比的假设,研究人员采用Egger回归方法校正了队列规模差异,发现血液肿瘤MRD阳性受试者的复发/再发平均OR值为3.5,实体癌为9.1(表1),表明MRD检测在预测实体瘤复发方面可能更为准确,这可能与血液中MRD阳性意味着潜在转移有关。
随后,研究人员进一步对血液肿瘤进行了分组分析,考虑了不同的发表时间、白血病类型、MRD检测时间点和方法(表1)。分析显示,AML患者的MRD检测OR值(4.7)高于ALL患者(2.5)。在巩固化疗期间/之后进行的MRD检测OR值(12.8)高于在诱导缓解期间/之后(1.6)。移植后MRD检测的OR值(21.0)也显著高于移植前(6.3)。这表明,在某些选择性时间点进行的MRD检测在预测血液肿瘤复发方面可能更为准确。然而,检测时间点越晚,MRD阳性结果后采取的干预措施越难改变临床结果,如移植后MRD阳性不太可能改变治疗决策。此外,MRD阳性与临床复发之间的时间间隔也是一个重要考量,因为这一时间间隔可能并不具有预测意义。
表1.对MRD检测结果呈阳性和阴性的受试者进行复发风险分组分析
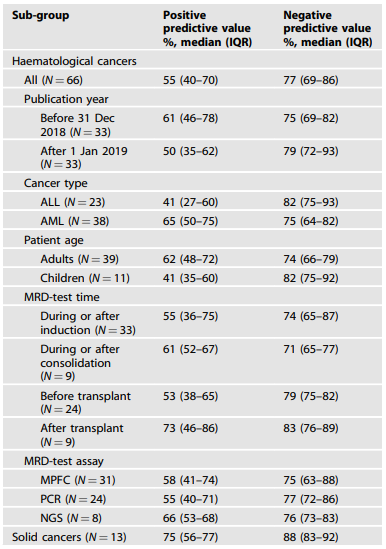
尽管MRD检测阳性结果预测CIR的OR值很高,但PPV值差异很大(表2)。MRD检测有助于确定具有不同CIR的患者亚组(即风险分层)。但是,如果想确定队列中哪些人会复发,MRD检测的准确性就会降低。血液肿瘤的中位PPV仅为55%,实体瘤的中位PPV为75%。血液肿瘤的中位NPV为 77%,实体癌的中 NPV为 88%。对于血液肿瘤,儿童或ALL患者的PPV为41%,移植后检测的PPV为 73%,而NPV为71%,移植后检测的NPV为83%。即使在最佳情况下(即移植后进行MRD检测),中位PPV和NPV也不能令人满意。
表2. MRD检测阳性预测值和阴性预测值的分组分析
MRD检测的局限性
MRD检测结果虽然是定量的,但临床上通常将其简化为二元(阴性/阳性)或三元(阴性/弱阳性/强阳性)的分类。然而,统一的阈值无法适应不同白血病亚型的生物学多样性。例如,在儿童ALL中,高风险遗传学特征的患者与超二倍体的患者可能具有相同的复发风险,即使他们的MRD结果差异很大。因此,MRD的临界值应个体化,反映特定肿瘤的生物学特性,但在实际应用中往往未能实现。此外,MRD检测的灵敏度和特异性随时间变化,不同检测方法之间也存在差异。
在儿童ALL中,连续MRD检测用于评估复发风险并调整治疗方案,但这种方法在其他肿瘤中尚未标准化。不同类型的白血病具有不同的生物学特性,包括增殖率、对化疗的敏感性,以及复发的可能性,这些都需要在MRD检测中考虑。例如,对于携带PML::RARA融合基因的急性髓细胞白血病患者,建议每两个月进行一次MRD检测,以便及时发现复发迹象。
此外,并非所有检测到的白血病细胞都有复发的可能,且目前缺乏区分这些细胞的方法。而且,MRD检测的准确性评估受到患者可能因其他原因死亡的复杂性影响。MRD检测的假阴性可能由于样本无法全面代表患者体内的癌细胞分布,尤其是在血液和骨髓样本中。例如,CLL患者的MRD检测可能无法检测到脾脏和淋巴结中的残留肿瘤细胞,而cfDNA检测可能更有优势。此外,肿瘤细胞的表型和基因型异质性也可能导致MRD检测的假阴性。
ctDNA的定量可能无法准确反映活癌细胞的数量,也无法区分对治疗敏感和耐受的细胞。MRD检测的阳性结果通常基于分析一定数量的细胞和阳性细胞数,这有助于减少假阳性但可能增加假阴性。此外,基于融合基因转录本浓度的MRD检测假设了所有癌细胞具有相同的转录活性,这可能并不总是正确的。新一代流式细胞术(NGF)提高了MRD检测的灵敏度,在预测某些肿瘤的移植后生存期和生存率方面可能比基于NGS的MRD检测更准确。
综上所述,尽管MRD检测在预测复发风险方面具有潜在价值,但其应用复杂,存在多种局限性,包括高假阳性和假阴性率。一些限制因素可以通过调整检测频率等方法来克服,而其他如泊松噪声(Poisson noise)等则更难以解决。
我们是否应该使用MRD检测结果来指导后续治疗?
鉴于MRD检测的固有局限性,研究人员通过文献回顾,评估了MRD检测结果对指导后续治疗决策(如加强治疗或暂停治疗)的影响。在95篇相关文章中,仅18篇提供了MRD指导治疗对复发风险影响的数据,且这些研究均局限于急性白血病。研究发现对于MRD阴性患者,部分研究支持可以在不增加复发风险的情况下暂停治疗,而其他研究则持相反观点。对于MRD阳性患者,一些研究认为加强治疗可降低复发风险,而另一些研究则未见显著效果。
理想的MRD疗效研究应为随机对照试验(RCT),对所有受试者在MRD检测前进行统一治疗,然后根据MRD结果随机分配至不同治疗组。然而,这类研究并不常见。在本次文献调查中,仅有7篇RCT,且均针对儿童和/或年轻成人的ALL患者。在这些研究中,MRD检测结果通常用于早期治疗反应评估,以指导后续治疗强度,而非直接用于治疗决策。
目前,MRD阳性患者是否应通过加强治疗来降低复发风险,以及MRD阴性患者是否可以安全地减少治疗强度,尚无明确共识。对于儿童和年轻成人的ALL患者,减少治疗强度的策略得到了一定支持,而其他肿瘤类型如AML和CLL则缺乏相应数据。此外,对于MRD阳性患者,尽管加强治疗可能暂时使MRD结果转阴,但并不一定与降低复发风险或提高生存率相关。
MRD指导疗法的RCT进行联合分析,有助于确定MRD状态是否可以作为CIR的替代指标。MRD状态与CIR存在正相关,但这种相关性并不强。如果MRD状态是CIR的完美替代物,那么不论采用何种治疗方案,MRD阳性都应预示相同的CIR(图1)。然而,目前MRD状态尚未满足作为替代终点的严格标准,因此,不能简单地将MRD阴性视为治疗成功,MRD阳性视为失败。在某些情况下,CIR仍可能通过调整后续治疗而改变,且MRD阳性对于接受不同治疗方案的患者具有不同的含义。
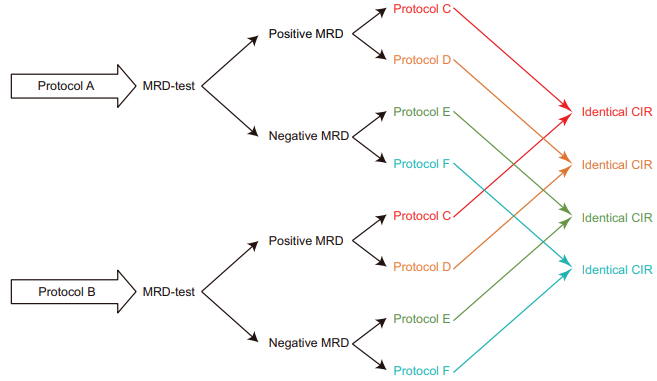
图1. 在进行临床试验以比较方案疗效时,需要满足哪些条件才能使MRD状态成为复发风险的完美替代预测指标
结论
将MRD检测结果简化为二元或三元分类,虽然有助于快速做出临床决策,但这种分类方法可能导致误解,使人错误地认为MRD指导的干预在多数肿瘤中都有充分的科学依据,而实际情况并非如此。
本研究的分析指出,当前对于MRD检测结果的治疗意义缺乏足够的关注和研究。只有通过研究性试验,特别是RCT,才能验证对MRD阳性患者加强治疗是否能够实际改善治疗结果,以及对MRD阴性患者暂缓治疗是否真正没有风险。此外,需要明确的是,MRD检测阳性的患者可能本身就患有更具生物侵袭性的肿瘤,MRD检测所发现的肿瘤细胞可能并非肿瘤复发风险增加的直接原因,而可能仅仅是与复发风险增加有关的相关因素。因此,在MRD检测结果解读及其对治疗决策的影响上需要更加谨慎和细致的考量。
Chen J, Gale R P, Hu Y, et al. Measurable residual disease (MRD)-testing in haematological and solid cancers[J]. Leukemia, 2024: 1-11.
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


