肝癌作为中国常见的恶性肿瘤之一,其发病率和死亡率均居高位。为进一步规范原发性肝癌诊疗行为、提高患者生存率,并响应《“健康中国 2030”规划纲要》中提出的提高癌症五年生存率的目标,国家卫生健康委员会医政司委托相关医学组织,集合多学科专家的智慧,不断更新和完善《原发性肝癌诊疗指南》。
2024年4月15日,《原发性肝癌诊疗指南(2024年版)》正式发布,指南融合了国内外最新的研究成果,特别是那些符合中国国情的研究,以确保指南内容的时效性和实用性。在制定和更新指南的过程中,采用了广泛认可的证据评价与推荐意见分级、制定和评价方法学(GRADE)系统来评价证据质量和制定推荐意见,将证据质量分为高、中、低和极低四个等级,并根据医学干预的利弊平衡、证据质量、价值观念与偏好以及成本与资源耗费等因素,将推荐意见分为强推荐、中等程度推荐和弱推荐三个等级。【肿瘤资讯】特对指南的要点概述和重要图片进行阐述,以飨读者,感兴趣读者可点击【阅读原文】深度阅读。
二、筛查和诊断
肝癌的穿刺活检
- 要点论述:
- (1)借助肝脏超声显像联合血清AFP进行肝癌的早期筛查,建议高危人群至少每隔6个月进行1次筛查。
- (2)动态增强CT、MRI 扫描、Gd-EOB-DTPA动态增强MRI检查以及超声造影是肝脏超声显像和/或血清AFP筛查异常者明确诊断的首选影像学检查方法。
- (3)肝癌影像学诊断依据主要根据“快进快出”的强化方式。
- (4)肝脏动态增强MRI检查是肝癌临床诊断、分期和疗效评价的优选影像手段。
- (5)PET/CT 扫描有助于对肝癌进行分期及疗效评价。
- (6)血清AFP是诊断肝癌和疗效监测常用且重要的指标。对血清AFP阴性人群,可以借助DCP、基于7个microRNA组合的检测试剂盒、AFP-L3进行早期诊断。
- (7)具有典型肝癌影像学特征的肝占位性病变,符合肝癌临床诊断标准的患者,通常不需要以诊断为目的的肝病灶穿刺活检。
7.肝癌病理诊断报告
- 要点概述:
- (1)肝癌切除标本的规范化处理和及时送检对保持肿瘤组织和细胞的完整及正确病理诊断十分重要。
- (2)肝癌标本取材应遵循“7点”基线取材的规范,有利于获得肝癌代表性的病理生物学特征信息。
- (3)肝癌病理诊断报告内容应规范全面,应特别重视描述影响肝癌预后的重要因素,如肝癌的组织学类型、分化程度、浸润性生长方式、MVI病理分级以及具有靶向治疗指导意义的靶点的分子病理检测等。
- (4)关注转化/新辅助治疗后肝癌切除标本的病理学评估。
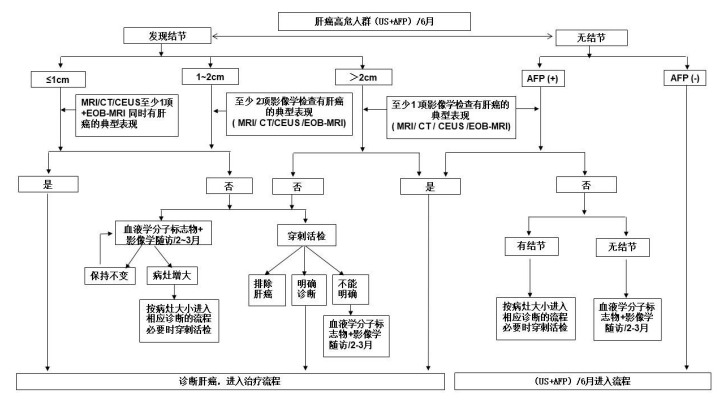
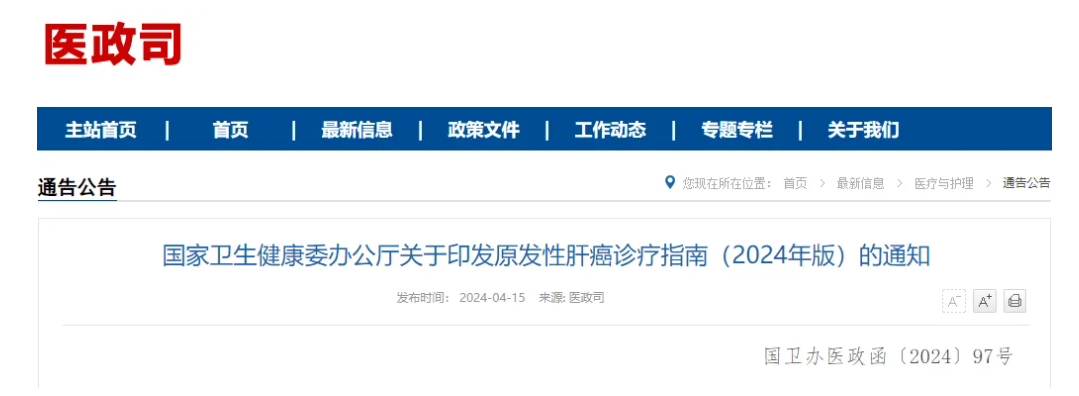
图1. 肝癌诊断路线图
注:典型表现为动脉期(主要动脉晚期)病灶明显强化,门静脉期、延迟期或移行期强 化下降,呈“快进快出”的强化方式。不典型表现为缺乏动脉期病灶强化,门静脉期、 延迟期或移行期无廓清,甚至持续强化等。MRI:磁共振成像。CT:计算机断层扫描。 CEUS:超声造影。EOB-MRI:肝细胞特异性对比剂(钆塞酸二钠,Gd-EOB-DTPA)增强 磁共振扫描。血液学分子标志物包括血清 AFP、DCP、7 个 microRNA 组合。AFP(+)为 超过血清 AFP 检测正常值。
三、分期
肝癌的分期对于治疗方案的选择、预后评估至关重要。国外有多种分期方案,如:巴塞罗那肝癌临床分期(Barcelona Clinic Liver Cancer,BCLC)、TNM 分期、日本肝病学会(Japanese Society of Hepatology,JSH)分期和亚太肝病研究学会(Asian Pacific Association for the Study of the Liver,APASL)分期等。结合中国的具体情况及实践积累,依据患者体能状态(performance status,PS)、肝肿瘤及肝功能情况,建立中国肝癌的分期方案(China Liver Cancer Staging,CNLC),包括:CNLC Ⅰa 期、Ⅰb 期、Ⅱa 期、Ⅱb 期、Ⅲa 期、Ⅲb 期、Ⅳ期,具体分期方案描述见图2。
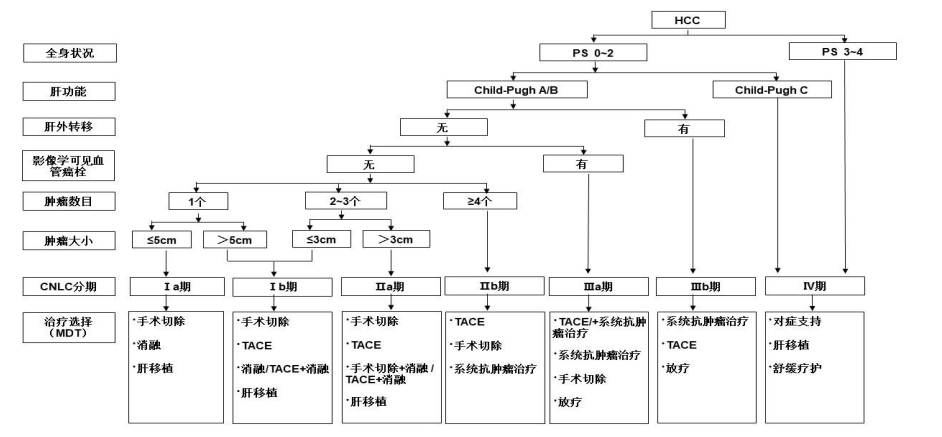
图2.中国肝癌临床分期与治疗路线图
注:PS 为患者体能状态;CNLC 为中国肝癌分期;MDT 为多学科诊疗团队;TACE 为经导管动脉化疗栓塞术。系统抗肿瘤治疗包括一线治疗:阿替利珠单克隆抗体+贝伐珠单克隆抗体、信迪利单克隆抗体+贝伐珠单克隆抗体类似物、甲磺酸阿帕替尼+卡瑞利珠单克隆抗体、多纳非尼、仑伐替尼、替雷利珠单克隆抗体、索拉非尼、FOLFOX4。二线治疗:瑞戈非尼、阿帕替尼、雷莫西尤单克隆抗体(血清甲胎蛋白水平≥400μg/L)、帕博利珠单克隆抗体、卡瑞利珠单克隆抗体、替雷利珠单克隆抗体。
四、治疗
(一)外科治疗
(3)肝癌术后辅助治疗
- 要点论述:
- (1)肝切除术是肝癌患者获得长期生存的重要手段。
- (2)完善的术前肝脏储备功能评估与肿瘤学评估非常重要。一般认为肝功能Child-Pugh A 级、ICG-R15<30%是实施手术切除的必要条件;FLR 须占SLV 的40%以上(伴有慢性肝病、肝实质损伤或肝硬化者)或30%以上(无肝纤维化或肝硬化者),也是实施手术切除的必要条件。有肝功能损害者,则需保留更多FLR。术前评估,还包括肝脏硬度、门静脉高压程度的测定等。
- (3)肝脏储备功能良好的CNLC Ⅰa、Ⅰb 和Ⅱa 期肝癌的首选治疗是手术切除。在CNLC Ⅱb 期和Ⅲa 期肝癌患者中,经MDT 评估,部分患者仍有机会从手术切除中获益。
- (4)肝切除时经常采用入肝(肝动脉和门静脉)和出肝(肝静脉)血流控制技术;术前三维可视化技术有助于提高肝切除的准确性;腹腔镜技术具有创伤小和术后恢复快等优点,但对于巨大肝癌、多发肝癌、位于困难部位及中央区紧邻重要管道肝癌和肝癌合并重度肝硬化者,建议经严格选择后由经验丰富的医师实施。
- (5)肝癌术后患者需每隔3 个月密切监测影像学(超声显像,必要时选择动态增强CT、动态增强MRI 扫描以及Gd-EOB-DTPA 增强MRI 扫描)及AFP、DCP 和7 个microRNA 组合等肿瘤学标志物的改变,2 年之后可适当延长至3~6个月,建议终身随访。
- (6)转化治疗指不适合手术切除的肝癌患者,经过干预后获得手术切除的机会,干预手段包括有功能的FLR转化、肿瘤学转化等。对于FLR 不足的肝癌患者,在合适人群中采用ALPPS 或PVE 以短期内增加有功能的FLR;ALPPS 较PVE 具有更高的转化效率。系统抗肿瘤治疗和/或联合局部治疗已成为不可切除或中晚期肝癌的重要治疗方式,也是肝癌转化治疗的重要手段。
- (7)新辅助治疗是指对于适合手术切除但具有术后高危复发转移风险的肝癌患者,在术前先进行局部治疗或系统抗肿瘤治疗,以期消灭微小病灶,降低术后复发率、延长生存期;但新辅助治疗也存在风险,应严格选择适宜人群,同时根据新辅助治疗的目标选择适宜的治疗方案。
- (8)对于适合手术切除同时具有术后高危复发转移风险的肝癌患者,术后可采取抗病毒、TACE、HAIC、放射治疗、系统抗肿瘤治疗等辅助治疗以降低术后复发转移率,延长生存时间。
7.肝移植术
(2)肝癌肝移植术后复发转移的预防和治疗
- 要点论述:
- (1)肝移植是肝癌根治性治疗手段之一,尤其适用于肝功能失代偿、不适合手术切除及消融治疗的小肝癌患者。
- (2)推荐UCSF 标准作为中国肝癌肝移植适应证标准。
- (3)肝癌肝移植术后早期撤除/无激素方案、减少肝移植后早期钙调磷酸酶抑制剂的用量、采用以哺乳动物雷帕霉素靶蛋白抑制剂(如雷帕霉素、依维莫司)为主的免疫抑制方案等有助于减少肿瘤复发转移。
- (4)局部治疗在肝癌肝移植的降期治疗或桥接治疗中具有重要作用。
- (5)肝癌肝移植术后一旦肿瘤复发转移,病情进展迅速,在多学科诊疗基础上的综合治疗,可以延长患者生存时间。
(二)消融治疗
5.肝癌消融术后预防复发转移的辅助治疗
- 要点概述:
- (1)消融治疗适用于CNLC Ⅰa 期及部分Ⅰb 期肝癌(即单个肿瘤、直径≤5 cm;或2~3 个肿瘤、最大直径≤3 cm),可以获得根治性的治疗效果。对于不能单纯手术切除的直径3~7 cm 的单发肿瘤或多发肿瘤,可以消融治疗联合TACE 或手术切除。
- (2)对于直径≤3 cm 的肝癌患者,消融治疗的总体生存时间类似或稍低于手术切除,但并发症发生率、住院时间低于手术切除。对于单个直径≤2cm 肝癌,消融治疗的疗效类似于手术切除,特别是中央型肝癌。
- (3)RFA 与MWA 在局部疗效、并发症发生率以及远期生存方面,两者无显著差异,可以根据肿瘤的大小、位置来选择。
- (4)PEI 对直径≤2cm 的肝癌远期疗效与RFA 类似。PEI 的优点是安全,特别适用于病灶贴近肝门、胆囊及胃肠道组织等高危部位,但需要多次、多点穿刺以实现药物在瘤内弥漫作用。
- (5)CRA 治疗可借助B 超、CT 等引导,在腹腔镜或直视下进行,对于≤2 cm 肝癌消融效果与微波、射频相似。
- (6)消融治疗后定期复查动态增强CT、动态增强MRI 扫描、超声造影和血清学肿瘤标志物,以评价消融效果。
10. HAIC
- 要点论述:
- (1)TACE 是肝癌最常用的经血管内介入治疗方法,主要适用于 CNLC Ⅱb、Ⅲa 和部分Ⅲb 期肝癌患者。
- (2)TACE 必须遵循规范化和个体化的方案,提倡精细 TACE 治疗,以减少肿瘤异质性导致 TACE 疗效的差异。
- (3)对肝癌伴门静脉主干或一级分支癌栓可以在 TACE 基础上联合使用门静脉内支架联合碘-125 粒子条或碘-125 粒子门静脉支架治疗或直接穿刺植入碘-125 粒子治疗。
- (4)提倡 TACE 联合消融治疗、放射治疗、外科手术、HAIC、分子靶向药物、免疫治疗和抗病毒治疗等综合治疗,以进一步提高 TACE 疗效。
- (5)mFOLFOX-HAIC 治疗对于多次 TACE 治疗产生抵抗、肝癌伴门静脉癌栓、肝外寡转移的肝癌患者,疗效优于索拉非尼治疗。
(四)放射治疗
- 要点论述:
- (1)CNLC Ⅲa 期肝癌患者,合并可切除门脉癌栓的肝癌患者可以行术前新辅助放射治疗或术后辅助放射治疗,延长生存;对于不能手术切除者,可以行姑息性放射治疗,或放射治疗与TACE 等联合治疗,延长患者生存。
- (2)CNLC Ⅲb 期肝癌患者,淋巴结、肺、骨、脑或肾上腺转移可采用外放射治疗减轻疼痛、梗阻或出血等症状。
- (3)肝肿瘤照射剂量:SBRT 一般推荐≥45~60 Gy/3~10 Fx,常规分割放射治疗一般为50~75 Gy,照射剂量与患者生存密切相关。部分肝内病灶或肝外转移灶可以行低分割放射治疗,以提高单次剂量、缩短放射治疗时间。
- (4)正常组织的耐受剂量必须考虑:放射治疗分割方式、肝功能Child-Pugh 分级、正常肝(肝脏-肿瘤)体积、胃肠道淤血和凝血功能状况等。
- (5)IGRT 优于三维适形放射治疗或调强放射治疗,SBRT 必须在IGRT 下进行。
- (6)内放射治疗是肝癌局部治疗的一种方法。
7.对症支持治疗
- 要点论述:
- (1)系统抗肿瘤治疗在不可手术切除的中晚期肝癌中的适应证主要为:CNLC Ⅲa、Ⅲb 期肝癌患者,不适合手术切除或TACE 治疗的CNLC Ⅱb 期肝癌患者,TACE 治疗抵抗或TACE 治疗失败的肝癌患者。
- (2)一线系统抗肿瘤治疗方案可以优先选择阿替利珠单克隆抗体联合贝伐珠单克隆抗体、信迪利单克隆抗体联合贝伐珠单克隆抗体类似物或甲磺酸阿帕替尼联合卡瑞利珠单克隆抗体。多纳非尼、仑伐替尼、替雷利珠单克隆抗体、索拉非尼或者FOLFOX4 方案的系统化疗仍然用于肝癌的一线治疗。
- (3)二线系统抗肿瘤治疗方案,在我国可以选择瑞戈非尼、阿帕替尼、帕博利珠单克隆抗体、雷莫西尤单克隆抗体(血清AFP 水平≥400 μg/L)、卡瑞利珠单克隆抗体和替雷利珠单克隆抗体。对于一线接受免疫联合方案、免疫单药或酪氨酸激酶抑制剂单药治疗的患者,二线治疗方案选择可根据疾病进展方式和具体一线方案不同,选择批准的二线治疗药物,也可选择未曾使用过的一线治疗的药物。
- (4)可根据病情选择中医传统方药治疗。除阿可拉定软胶囊外,我国已经批准了若干种现代中药制剂用于治疗晚期肝癌。另外,槐耳颗粒可以用于肝癌手术切除后的辅助治疗。
- (5)在抗肿瘤治疗的同时,抗病毒治疗应始终贯穿治疗全过程。
(六)肝癌自发破裂的治疗
- 要点论述:
- 肝癌自发破裂是肝癌潜在的致死性并发症,应充分评估患者血流动力学、肝功能、全身情况以及肿瘤是否可切除,制订个体化的治疗方案。
排版编辑:肿瘤资讯-Astrid











 苏公网安备32059002004080号
苏公网安备32059002004080号


