相比传统化疗,靶向治疗可以精准打击肿瘤细胞的致癌位点,高选择性杀伤肿瘤细胞,改善驱动基因突变非小细胞肺癌(NSCLC)患者的预后。间变性淋巴瘤激酶(ALK)是继表皮生长因子受体(EGFR)后的又一重要治疗靶点,在我国NSCLC中的发生率约为5.6%,其中腺癌的发生率为6.6%~9.6%[1]。目前已有多种ALK酪氨酸酶抑制剂(ALK-TKIs)可供选择,临床治疗过程中应该如何决策?
【肿瘤资讯】特邀山东省肿瘤医院管燕教授和李艳教授分享临床决策和临床经验。李艳教授分享一例ALK融合晚期肺腺癌伴脑转移病例。本例患者确诊为ⅣB期右肺腺癌伴脑转移,基因检测显示存在EML4-ALK融合。基于不同ALK-TKIs的临床研究设计及结果,综合患者情况,临床给予布格替尼口服治疗,并定期复查。至今,患者治疗近11个月,肺部病灶自治疗一个月疗效评估为部分缓解(PR),后续随访在PR基础上持续缓解,脑部病灶自治疗一个月疗效评估为完全缓解(CR),后续随访均为CR,治疗过程中耐受性良好。治疗期间出现一过性转氨酶轻度升高,经治后恢复。其后,特别邀请管燕教授进行病例点评,以深入探讨ALK融合晚期肺腺癌的治疗现状及用药选择。
病例介绍
病例分享
山东省肿瘤医院 呼吸内科二病区
山东省抗癌协会靶向治疗分会委员
山东中医药学会肿瘤精准医学专业 委员会委员
中国老年保健协会老年健康标准分会委员委员
山东省医师协会肿瘤科医师分会委员
山东省医师协会肿瘤科医师分会临床试验学组委员
山东省临床肿瘤学会非小细胞肺癌专家委员会青委会委员
基本信息
患者:男性,34岁。
主诉:咳嗽3月余、痰中带血1月余。
既往史、个人史:无基础疾病史,无吸烟饮酒史。
家族史:无特殊。
就诊经历
2023年1月,患者无明显诱因出现咳嗽、咳少量白痰。2023年3月出现咳嗽加重、咳痰带血,量少,无成口咯血,伴胸闷、憋气,无发热、胸背疼痛。就诊当地医院。查CT示:右肺门多发淋巴结肿大,不除外右肺门淋巴结结核可能;心包膜明显增厚;右侧胸腔积液。
2023年4月6日,患者来我院就诊,美国东部肿瘤协作组(ECOG)评分:1分。
全身PET/CT(2023-04-07)示:1.考虑右肺癌伴双肺门淋巴结转移、纵隔淋巴结转移、双锁上淋巴结转移、多发肝转移、多发骨转移,建议结合病理;2.心包局部及邻近胸壁增厚伴高代谢,结合病史(心包穿刺),首先考虑炎性及反应性改变;3.肝胃韧带区发现稍大淋巴结伴略高代谢,考虑炎性淋巴结可能大,建议观察;4.双肺炎症,双肺多发小结节,双侧胸腔积液。
纤维支气管镜检查(2023-04-12)示:右肺中叶新生物,待病理和细胞学;右肺下叶基底段外压性狭窄伴充血。
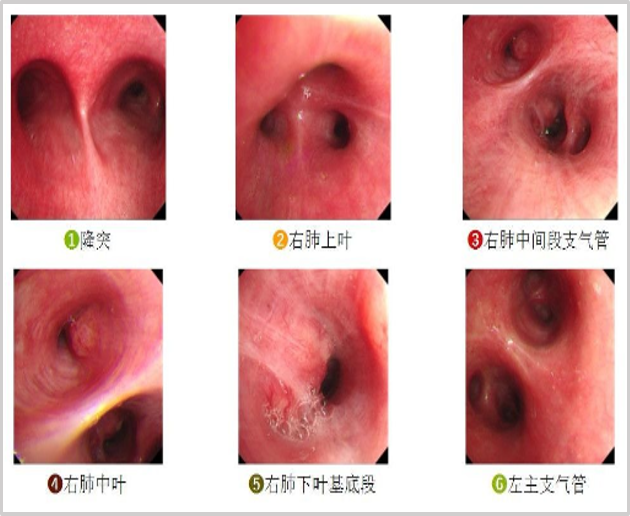
纤维支气管镜(2023-04-12)
活检病理(2023-04-17)示:(右肺气管镜活检)结合免疫组化,倾向低分化腺癌。免疫组化示:CK7(+)、TTF-1(+)、CK5(+)、P40(-)。
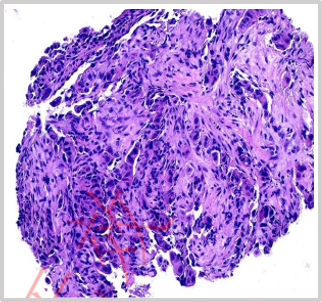
病理免疫组化结果(2023-04-17)
泛癌种425基因检测(NGS)示:ALK:EML4-ALK融合。
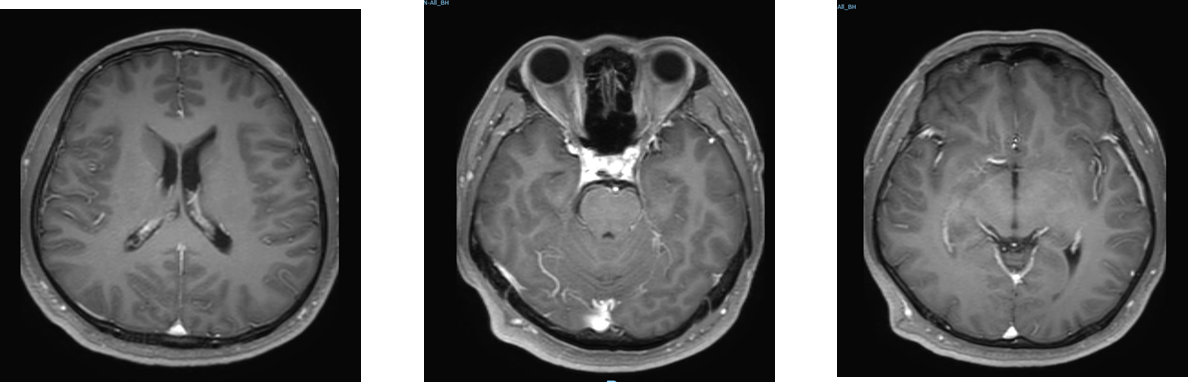
MRI(2023-04-24)示:双侧大脑、小脑蚓部多发结节状强化灶,大者长径约1.4cm,边界较清,部分周围大片状水肿带。
诊断结果
右肺腺癌(cT1cN3M1c,ⅣB期;EML4-ALK 融合)
双肺门、纵隔、双锁上淋巴结转移
肝、骨、脑转移
心包积液
双侧胸腔积液
治疗经过及疗效评估
2023年4月25日,开始给予布格替尼 90mg po qd导入治疗7天,后继续布格替尼180mg po qd治疗至今,定期复查。
2023年5月30日、2023年8月7日、2023年11月28日、2024年3月15日复查胸腹部增强 CT示:右肺癌伴双肺门、纵隔及双锁上多发淋巴结转移,多发肝转移,治疗后均较前缩小;多发骨转移,变化不著;心包不均匀增厚,心包积液较前减少。
肺部疗效评估:PR。
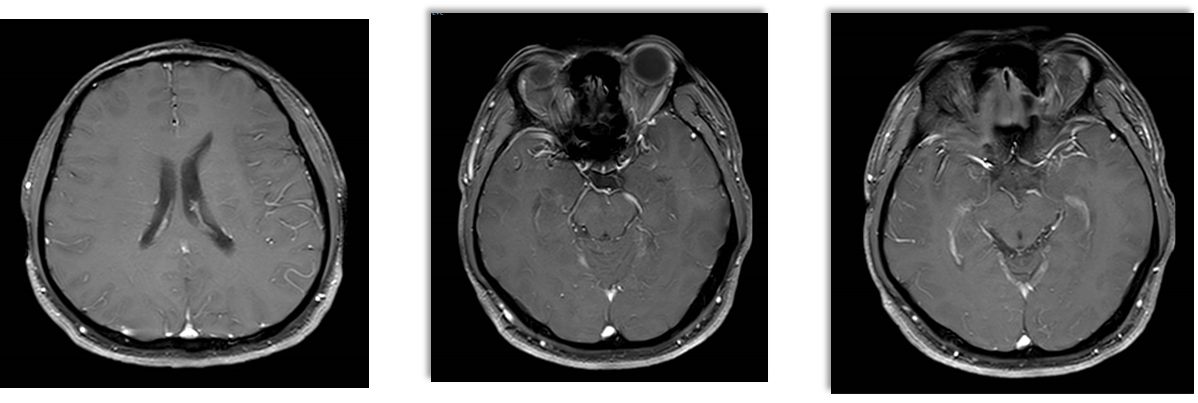
2023年5月31日、2023年11月29日、2024年3月15日,复查头颅增强MRI示:原脑内强化结节本次扫描未见确切显示,脑多发缺血灶。
颅内疗效评估:CR。
不良反应及处理:治疗期间出现一过性转氨酶轻度升高,经双环醇口服保肝药物治疗后恢复;动态监测肌酸激酶持续升高,但同时监测肌酸激酶同工酶、肌钙蛋白、BNP均在正常范围。未见其他治疗相关不良反应。
影像资料
胸腹部增强CT:
2023-04-07治疗前
CT示:右肺下叶内基底段示不规则团片状软组织密度影,截面大小约2.9cmx2.6cm;双肺门及纵隔见多发增大淋巴结,大者短径约1.8cm;肝内见多个大小不等混杂低密度影,边界不清。
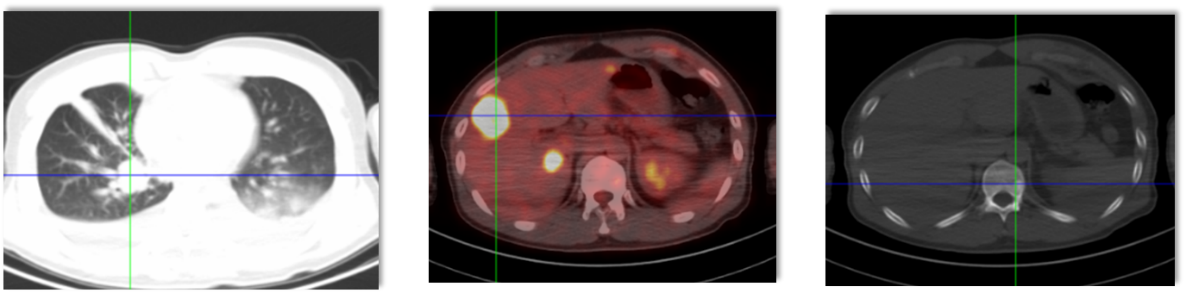
2023-05-30 治疗1个月后复查,疗效评估:PR
CT示:右肺下叶内基底段示不规则团片状软组织密度影,截面大小约1.2cmx1.3cm;双肺门、纵隔内、双锁上示多发肿大淋巴结,部分融合,大者短径约1.2cm;肝脏实质内可见散在多发低密度灶,大者直径约2.1cm。
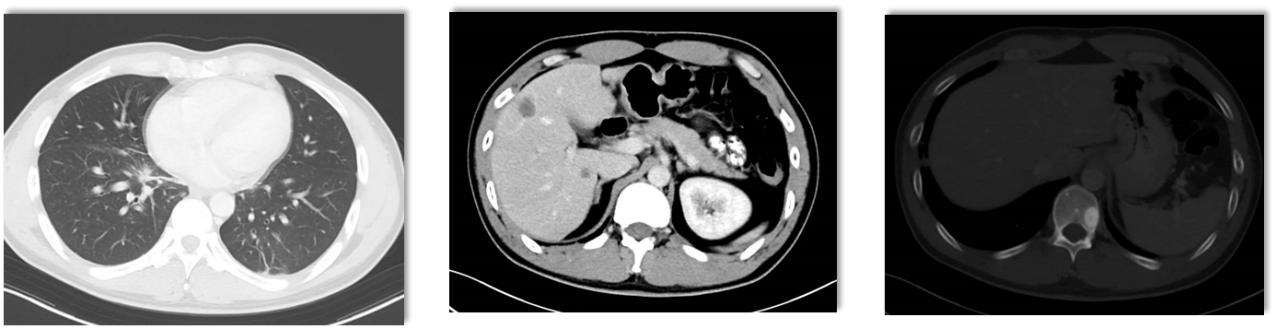
2023-08-07治疗3个月后复查,疗效评估:持续PR
CT示:右肺下叶内基底段示不规则软组织密度影,截面大小约1.1cmx0.9cm;双肺门、纵隔内、双锁上示多发肿大淋巴结,部分融合,大者短径约1.0cm;肝脏实质内可见散在多发低密度灶,大者直径约1.6cm。

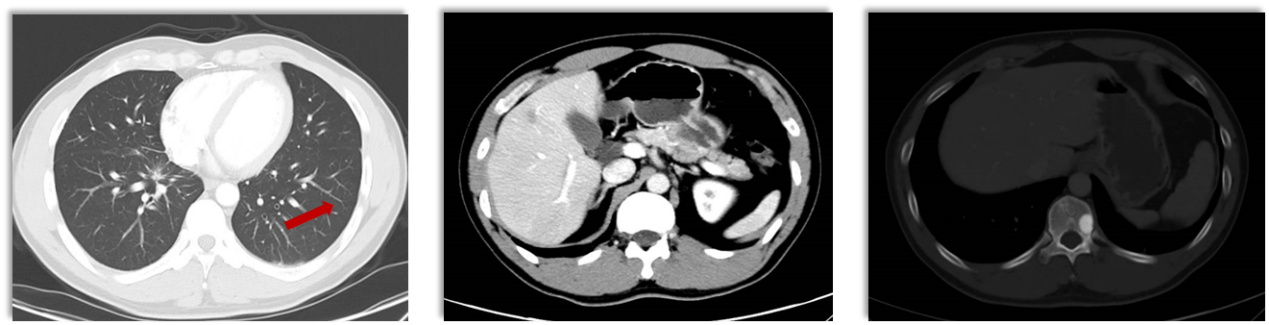
2023-11-28治疗7个月后复查,疗效评估:持续PR
CT示:右肺下叶内基底段示不规则软组织密度影,长径约0.9cm;纵隔4R示肿大淋巴结,短径约0.8cm;肝脏实质内可见散在多发低密度灶,大者直径约1.3cm。
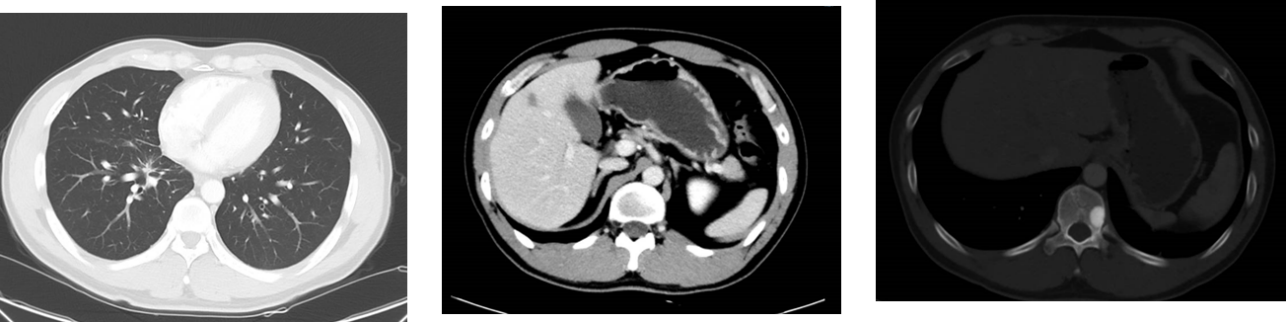
2024-03-15治疗 11个月后复查,疗效评估:PR
CT示:右肺下叶内基底段示不规则软组织密度影,截面大小约1.1cmx0.9cm;双肺门、纵隔内、双锁上示多发肿大淋巴结,部分融合,大者短径约1.0cm;肝脏实质内可见散在多发低密度灶,大者直径约1.3cm。
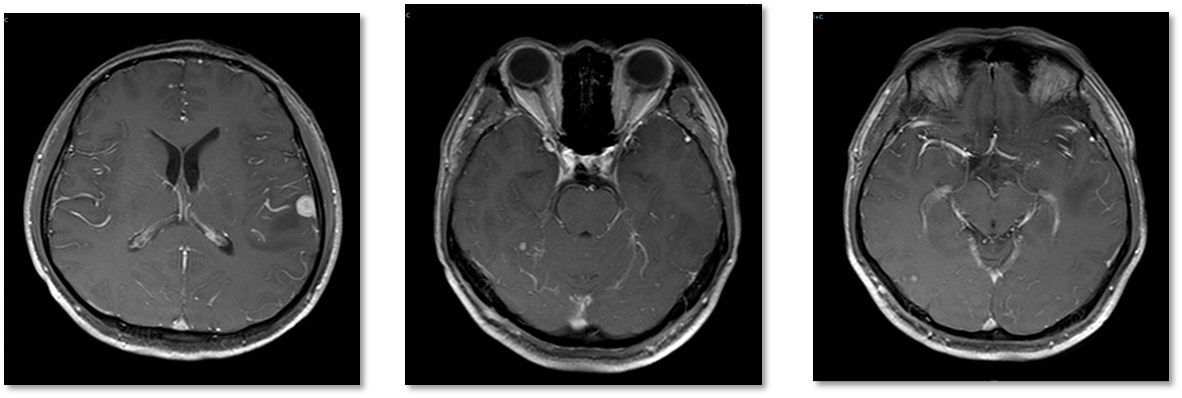
头颅增强MRI:
2023-04-07治疗前 双侧大脑、小脑蚓部多发结节状强化灶,大者长径约1.4cm,边界较清,部分周围大片状水肿带
2023-05-31 治疗1个月后复查,颅内未见确切显示病灶,颅内病灶疗效评估:CR
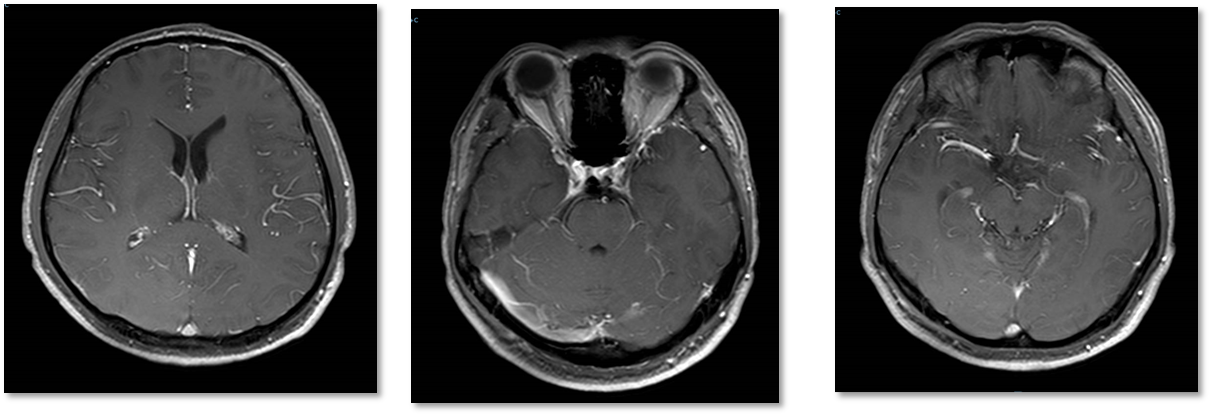
2023-11-29治疗7个月后复查,颅内未见确切显示病灶,颅内病灶疗效评估:持续CR
2024-03-15治疗 11个月后复查,颅内未见确切显示病灶,颅内病灶疗效评估:持续CR
病例小结
患者初治为右肺腺癌(cT1cN3M1c,ⅣB期),EML4-ALK融合。基于循证医学证据,结合患者的具体情况,给予布格替尼靶向治疗。患者治疗近11个月,肺部病灶自治疗一个月疗效评估为PR,后续随访仍持续PR。颅内病灶自治疗一个月疗效评估为完全CR,后续随访均为CR,且整体耐受性良好。至今,患者病情控制良好,身体状况佳。
专家点评
山东省肿瘤医院 呼吸内科二病区
山东省抗癌协会化疗分会常委、秘书
山东省抗癌协会中西医结合分会副主委
山东省临床肿瘤学会非小细胞肺癌专委会常委
中国老年康复协会肿瘤康复分会委员
山东预防医学会肿瘤风险评估与控制分会委员
山东医师协会肿瘤医师分会临床试验学组委员
山东省抗癌协会肺癌分会青委会常委
ALK融合是NSCLC关键驱动基因变异之一,多发于不吸烟或吸烟较少的年轻肺腺癌患者,其融合形式以EML4-ALK融合居多[2]。目前已有超过15种EML4-ALK融合突变体被识别出来,其中最常见的为种类1(V1)、2(V2)和3a/b(V3)[3]。ALK-TKIs可有效阻断ALK基因融合恶性肿瘤,有望延长ALK阳性NSCLC患者生存,有望使其逐渐向“慢性病”转化。临床医生在治疗决策时会进行多方面考量:第一,无进展生存期(PFS)获益是否能转化为总生存期(OS)获益?OS结果是临床医生关心的重点,OS率成为临床考量的重要因素;第二,临床治疗是否可以达到深度缓解?缓解深度与患者生存获益密切相关;第三,颅内疗效,ALK融合NSCLC具有较高的脑转移倾向,脑转移的治疗尤为重要;第四:药物安全性。随着越来越多年轻患者接受治疗,临床还需要考虑尽可能降低治疗对患者日常工作生活的影响等诸多问题。
循证为基,布格替尼CR达24%,给晚期ALK阳性NSCLC患者带来深度缓解
2007年,日本Manabu Soda教授等人首次发现了ALK重排,并在NSCLC标本中鉴定出了ALK与EML4的融合[4]。第一代ALK-TKI克唑替尼被证实可延长患者生存,但其较差的中枢神经系统(CNS)渗透性使得服用克唑替尼的患者往往在1~2年内因脑转移而出现疾病进展[5]。其后,塞瑞替尼、阿来替尼、布格替尼、恩沙替尼、洛拉替尼等相继获批,第四代ALK-TKI亦在研发中。布格替尼在ALTA-1L研究中表现出了较优的疗效及可耐受的安全性。
ALTA-1L研究结果显示,在意向治疗人群(ITT)中,布格替尼组的完全缓解(CR)率为24%[6]。布格替尼一线治疗组中有56%患者达到深度缓解,肿瘤缩小达到76%~100%,达到深度缓解组的中位PFS为44.1个月,3年OS率为85%[6,7]。
中位随访40.4个月时,在ITT中, 研究者(INV)评估的中位PFS:30.8个月vs 9.2个月(HR=0.43,p<0.0001)。不同ALK-TKIs一线治疗的Ⅲ期临床研究设计有所差异,ALTA-1L研究不同于其他ALK-TKI相关临床研究,允许交叉用药[6,9-11]。交叉设计充分考虑到了受试者利益,更符合伦理学要求,有助于患者的全程管理,提高患者的治疗依从性,但最终的OS获益会受到交叉治疗的影响。经MSM敏感性分析和逆概率删失加权法(IPCW)模型分析后,布格替尼组OS的HR为 0.54(P=0.023),降低疾病死亡风险46%[6]。
布格替尼针对基线脑转移人群4年OS率达71%,无特异中枢神经毒性
ALK阳性NSCLC患者确诊后,脑转移风险会逐年增加,研究显示,ALK阳性晚期NSCLC患者1年、2年和3年的脑转移率分别为23.8%、45.5%和58.4%[12]。而放疗、化疗、手术等治疗方法的疗效难以令人满意。在众多ALK-TKIs中,布格替尼优异的颅内疗效打破了脑转移治疗瓶颈,为患者带来了长期生存希望。
ALTA-1L研究[6]显示,在基线可测量脑转移患者中,布格替尼组的中位PFS为24.0个月,降低疾病进展或死亡风险达75%(HR=0.25,p<0.0001),布格替尼组和克唑替尼组的4年OS率分别为71%和44%(HR=0.43,p=0.020)[6];在包含基线可测量脑转移和无脑转移的ITT人群中,布格替尼一线治疗的中位颅内PFS为44.1个月[6],结果显示布格替尼具有持久的颅内疗效。结合其药物分子特征可见,布格替尼独特的二甲基氧化磷(DMPO)分子结构设计使其具有较高的选择性和活性特征;平衡的水溶性和脂溶性能够共同促进外周组织对药物的吸收,使药物易穿透血脑屏障抵达颅内病灶。此外布格替尼无特异的CNS毒性。
患者入院时存在4处脑转移病灶,在治疗1个月后即达到CR,后持续CR,这从临床病例角度验证了布格替尼较优颅内疗效。
布格替尼安全性良好,同时提高晚期ALK阳性NSCLC患者生活质量获益
在临床治疗过程,我们会更加关注药物的安全性数据,以保障患者的生活质量。布格替尼一线治疗的不良反应(AE)可控、可管理,长期使用耐受性良好。ALTA-1L研究及说明书提到[13]临床常见的任何级别治疗相关不良反应(TEAEs)为胃肠道反应、血肌酸磷酸激酶(CPK)升高、咳嗽和转氨酶升高,多为1~2级。3~4级TEAEs主要为实验室血液检查指标升高,大部分患者无症状表现。这与我们临床实践中观察的AE谱一致。本例患者在治疗过程中,AE主要是实验室检查的异常,且无临床症状。
此外,布格替尼是首个与克唑替尼在健康相关生活质量(HRQOL)上有显著差异的ALK-TKI。ALTA-1L 研究结果表明,相比克唑替尼,布格替尼一线治疗能够显著延迟HRQOL各身体机能的恶化时间,如情感功能、社交功能、疲劳、GI相关症状(恶心/呕吐、食欲降低、便秘),延迟时间超18个月,为患者带来了持久的生活质量获益。
本例患者在一线使用布格替尼靶向治疗11月,目前仍在持续治疗中,未影响患者的正常生活及工作。在治疗1月后,患者复查显示病情很快得到控制,肺部病灶较前明显缩小,疗效评估为PR,后续随访在PR基础上持续缓解;颅内病灶在一个月治疗后消失,疗效评估为CR。至今,患者的病情控制良好,疗效稳定,且耐受性良好。针对此类年轻患者,我们关注药物治疗的同时,也关注患者的生活质量。本例患者在治疗过程中,未出现肿瘤相关的疲劳、恶心/呕吐、胸痛/闷等症状。本病例中布格替尼为患者带来疾病控制的同时也改善生活质量。

[1] 中国非小细胞肺癌ALK检测模式真实世界多中心研究专家组, 中华医学会病理学分会分子病理学组. 中国非小细胞肺癌ALK检测临床实践专家共识 [J] . 中华病理学杂志,2019,48 (12): 913-920.
[2] Hallberg B, Palmer RH. Mechanistic insight into ALK receptor tyrosine kinase in human cancer biology. Nat Rev Cancer. 2013 Oct;13(10):685-700. doi: 10.1038/nrc3580. Erratum in: Nat Rev Cancer. 2013 Nov;13(11):820. PMID: 24060861.
[3] Sabir SR, Yeoh S, Jackson G, et al. EML4-ALKvariants: biological and molecular properties, and the implications for patients, Cancers (Basel).2017;9:118.
[4] Soda M, Choi YL, Enomoto M, et al. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer[J]. Nature, 2007, 448(7153): 561-566.
[5] Rothschild SI. Ceritinib-a second-generation ALK inhibitor overcoming resistance in ALK-rearranged non-small cell lung cancer[J]. Transl Lung Cancer Res. 2014;3(6):379-381.
[6] Camidge D , Kim H , Ahn M ,et al. Brigatinib Versus Crizotinib in ALK Inhibitor-Naive Advanced ALK-Positive NSCLC: Final Results of Phase 3 ALTA-1L Trial[J]. Journal of thoracic oncology: official publication of the International Association for the Study of Lung Cancer, 2021, 16(12):2091-2108. DOI:10.1016/j.jtho.2021.07.035.
[7] Camidge DR, et al. ASCO 2022 [abstract 9072].
[8] Jiahao Tao, Chuangjie Zheng, Cuifen Zhang, et al. First-line treatments for patients with advanced ALK gene rearrangements in NSCLC: a systematic review and network meta-analysis[J]. J Int Med Res. 2022 Nov;50(11):3000605221132703.
[9] T. Mok, et al. Updated overall survival and final progression-free survival data for patients with treatment-naïve advanced ALK-positive non-small-cell lung cancer in the ALEX study. Annals of Oncology. Available online 11 May 2020. In Press.
[10] Leora Horn, Ziping Wang, Gang Wu, et al. Ensartinib vs Crizotinib for Patients With Anaplastic Lymphoma Kinase−Positive Non–Small Cell Lung Cancer[J]. JAMA Oncol. 2021 Nov; 7(11): 1-9.
[11] Solomon BJ, Bauer TM, Ou SI, et al. Post Hoc Analysis of Lorlatinib Intracranial Efficacy and Safety in Patients With ALK-Positive Advanced Non-Small-Cell Lung Cancer From the Phase III CROWN Study. J Clin Oncol. 2022 May 23;JCO2102278. doi: 10.1200/JCO.21.02278.
[12] Rangachari D, Yamaguchi N, VanderLaan PA, et al. Brain metastases in patients with EGFR-mutated or ALK-rearranged non-small-cell lung cancers. Lung Cancer. 2015;88(1):108-111.
[13] 布格替尼片说明书2022年12月27日
审批编号:VV-MEDMAT-103178
审批日期:2024年4月
仅供医疗卫生专业人士使用
排版编辑:肿瘤资讯-LWT











 苏公网安备32059002004080号
苏公网安备32059002004080号


